胜红蓟根系分泌物土壤浸提液在石榴枯萎病生物防治中的作用初探
黄邦成,魏丹丽,李 铷,汤东生
(云南农业大学植物保护学院,昆明650201)
0 引言
由甘薯长喙壳引起的石榴枯萎病堪称石榴的“癌症”,采用化学药剂浇灌和生物菌剂处理均不能减轻病害的发生,亦不能控制其扩展蔓延[1]。增加地表植被,改善土壤生态条件,可优化土壤微生物定殖环境,提高生防菌剂防治土传病害的效果[2-3]。汤东生等[4]研究表明在石榴周围种植杂草胜红蓟可有效控制石榴枯萎病[1]。但胜红蓟在石榴根际定植以后,如何作用于石榴枯萎病的致病过程并不清楚,因此,有必要深入揭示胜红蓟在石榴枯萎病生防中的作用机理。
植物定植土壤以后,可通过根系分泌物、淋溶物和组织分解产物影响到土壤生态环境[5-7]和根际微生物区系[8]。其中根系分泌物与土壤中的微生物接触最密切,因此其对土壤微生物菌群的消长作用备受关注[9-10]。根系分泌物可以通过抑制土壤中病菌的生长,而控制土传病害的发展。室内试验表明,当旱稻与西瓜间作后,早稻根系分泌物显著抑制西瓜枯萎病菌(Fusarium oxysporumf.sp.niveum)生长,而西瓜自身根系分泌物促进枯萎病菌的生长[11]。田间试验表明,间作韭菜能显著减轻香蕉枯萎病的发生,是因为韭菜根系分泌物抑制导致香蕉枯萎病菌孢子的萌发和菌丝生长[12]。油菜轮作烟草以后,油菜的根系分泌物质吸引游动孢子随后抑制休眠孢子萌发和菌丝生长达到控制油菜黑胫病[13]。另一些研究证实,根系分泌物通过影响根际微生物种群结构来减轻土传病害的发展。凤梨轮作香蕉后,香蕉枯萎病发生率和危害率的降低不是由于凤梨的根系分泌物抑制枯萎病菌(Fusarium oxysporumf.sp.cubenserace 4)的生长,而是扩大了土壤中微生物的多样性,从而减少了枯萎病菌的生长与扩展[14]。有研究表明香蕉根系分泌的有机酸类物质植物生长促生菌Bacillus amyloliquefaciens的定殖,从而免于受到土传病害的发展[15]。
从调控生物防治效果的角度来分析,植物的根系分泌物质或是通过增加生防菌的生物活性或抑制病原菌的活力增殖,亦或两者兼起作用。胜红蓟在土壤定植后,是促进了生防菌枯菌芽孢杆菌的定植,还是对石榴枯萎病菌有直接的抑制作用,还是2种作用方式均存在,需要用试验来证明。笔者利用胜红蓟的土壤浸提液代表根系分泌物,在室内分别处理生防菌枯草芽孢杆菌和石榴枯萎病菌,通过检测枯草芽孢杆菌和石榴枯萎病菌的增殖速度,判明胜红蓟根系分泌物的作用途径,旨在为深入揭示利用胜红蓟生态防控石榴枯萎病提供理论依据。
1 材料与方法
1.1 供试植物与菌株
胜红蓟苗由采用石榴园的野生植物种子经实验室培育所得。供试菌株为由实验室保存的对石榴枯萎病有强烈抑制作用的枯草芽孢杆菌菌株BS5102。
1.2 供试培养基
1.2.1 PDA培养基 马铃薯200 g,葡萄糖20 g,琼脂16 g,1000 mL纯水。
1.2.2 YPG培养基 酵母膏5 g,胰蛋白胨5 g,葡萄糖5 g,琼脂15 g,1000 mL纯水。
1.3 胜红蓟土壤浸提液的获取
采用土培法获取,在土培的胜红蓟生长至5叶期后,将主根周围4 cm、深10 cm的土壤全部取出,加蒸馏水浸提,蒸馏水体积与土壤体积比为2:1,将所得根际泥水搅拌均匀后5000 r/min离心,先用定性滤纸过滤3遍,再用孔径0.2 μm的细菌过滤器过滤,即得到无菌的胜红蓟根系分泌物土壤浸提液。
1.4 胜红蓟土壤浸提液对枯草芽孢杆菌的作用
将收集好的胜红蓟土壤浸提液与制备好的去琼脂YPG培养液按7:3、5:5、3:7的比率配制成50 mL培养液装于100 mL锥形瓶中,接入浓度为2.3×107cfu枯草芽孢杆菌菌液1 mL,并以清水与YPG培养液以同样比例混合为对照,3次重复,放于恒温振荡器(30℃,120 r/min)上培养,12 h后取5 mL菌液用UV1000紫外分光光度计开始测量吸光值,每2 h测1次吸光值,并记录数据。所有试验重复2遍。
1.5 胜红蓟土壤浸提液对石榴枯萎病菌的作用
将胜红蓟土壤浸提液按照体积比加入到灭菌尚未凝固的PDA培养基(45℃)中配成两者体积比为7:3、5:5、3:7的培养基,待凝固后接种直径为1 cm的石榴枯萎病菌饼于培养基中央。并以清水与PDA培养基以同样比例混合为对照,3次重复,放于电热恒温培养箱中培养,第3天后用十字交叉法测量菌饼直径并记录,之后每天测量,直至对照出现菌落长满整个培养皿为止。所有试验重复2遍。
1.6 数据统计与分析
使用Excel和SAS 9.1软件分析数据,用Duncan’s新复极差法进行方差分析。
2 结果与分析
2.1 胜红蓟土壤浸提液对枯草芽孢杆菌生长的影响
胜红蓟土壤浸提液促进生防菌枯草芽孢杆菌的生长(图1~3)。不论YPG营养液的比例如何,在同样比例YPG营养液条件下,添加土壤浸提液的处理,枯草芽孢杆菌的生长呈现刚开始缓慢增长,而后快速生长的趋势;而添加清水的处理,枯草芽孢杆菌的生长呈现刚开始生长较快,而后停止生长的趋势。在所有处理中,当枯草芽孢杆菌培养18 h以后,胜红蓟土壤浸提液处理的枯草芽孢杆菌的数量均高于对应的清水处理的芽孢杆菌的数量。如在培养24 h时,当YPG含量为70%时,土壤浸提液处理的枯草芽孢杆菌数量是清水处理的枯草芽孢杆菌的28倍;当YPG含量为50%时,土壤浸提液处理的枯草芽孢杆菌数量是清水处理的枯草芽孢杆菌的17倍;当YPG含量为30%时,土壤浸提液处理的枯草芽孢杆菌数量是清水处理的枯草芽孢杆菌的4倍。随着YPG营养液比例的减少和胜红蓟土壤浸提液量的增加,在同一培养时段,枯草芽孢杆菌的数量在土壤浸提液的处理和清水处理之间的差距在缩小。由此可见,胜红蓟土壤浸提液具有促进枯草芽孢杆菌生长的作用,并且低浓度的土壤浸提液比高浓度的土壤浸提液对枯草芽孢杆菌的促进作用更加明显。
2.2 胜红蓟土壤浸提液对石榴枯萎病菌生长的影响
胜红蓟根系分泌水土壤粗提物对石榴枯萎病菌的生长有细微促进作用(图4),但10个时间段检测点均未发现处理的菌饼直径显著高于对照的情况。对照病菌培养的12天内,菌饼生长速率呈直线增长,而用根系分泌水土壤粗提取物处理菌饼直径总是稍高于对照处理。由此可见,胜红蓟根系分泌物土壤水提取液虽不对石榴枯萎病菌有抑制作用,但几乎也没有促进作用。与前人有关胜红蓟根系分泌物抑制土壤病原菌的生长的结果不一致[16]。也许,本试验胜红蓟根系分泌物抑制作用不明显与根系分泌物土壤浸提液浓度较低也有一定关系。
3 结论
前期研究结果发现,单独利用生防菌枯草芽孢杆菌对防治石榴枯萎病几乎没有任何作用,栽培胜红蓟后枯草芽孢杆菌的防治效果大幅提升。为进一步探索这一现象的原因而进行了本次试验。研究结果表明,根系分泌物是胜红蓟影响生防菌枯草芽孢杆菌防治石榴枯萎病效果的重要作用因子,其作用方式主要是通过促进枯草芽孢杆菌的定殖或增殖,增强枯草芽孢杆菌抑制石榴枯萎病的作用。未发现胜红蓟的根系分泌物对石榴枯萎病菌有直接的抑制作用。本研究结果对探索利用生物多样性控制土传病害的技术探索和机理研究具有一定的价值。
4 讨论
利用微生物菌剂来控制有害生物危害,常被认为是克服化学农药负面作用的一种绿色防控措施[17]。发达国家投入巨资研究如何提高生防菌剂的适应性、扩大生防菌剂的适用范围和持效性[18-19]。但到目前为止,很少听说一种菌剂像化学农药那样具有广泛的适应性和活性。究其原因,微生物菌剂是活着的微生物,土壤环境的优劣决定着生防菌能否生存与发挥生防功能[20-21]。当周围环境有利于生防菌定殖时,生防菌才能有效起到抑制土壤中病原菌的作用;当环境因子偏离微生物的承受范围时,生防菌自身的生长就受到限制,根本不可能起到抑制土壤中病原菌生长的作用。因此,定殖环境的优良与否是生防菌发挥生防作用的关键[22]。
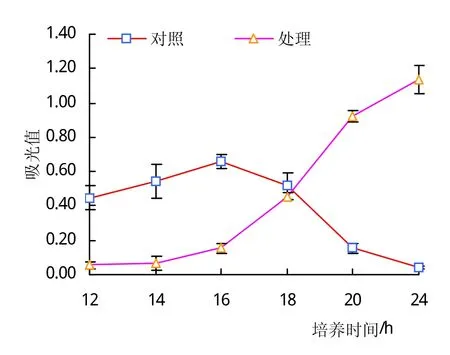
图1 枯草芽孢杆菌在70%YPG培养液中的生长情况
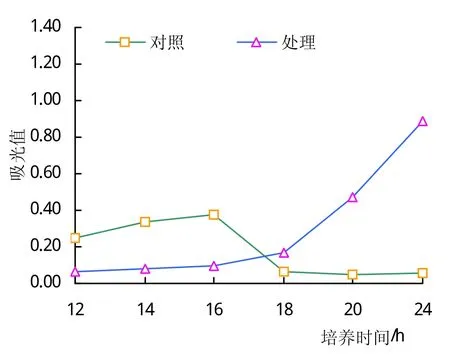
图2 枯草芽孢杆菌在50%YPG培养液中的生长情况
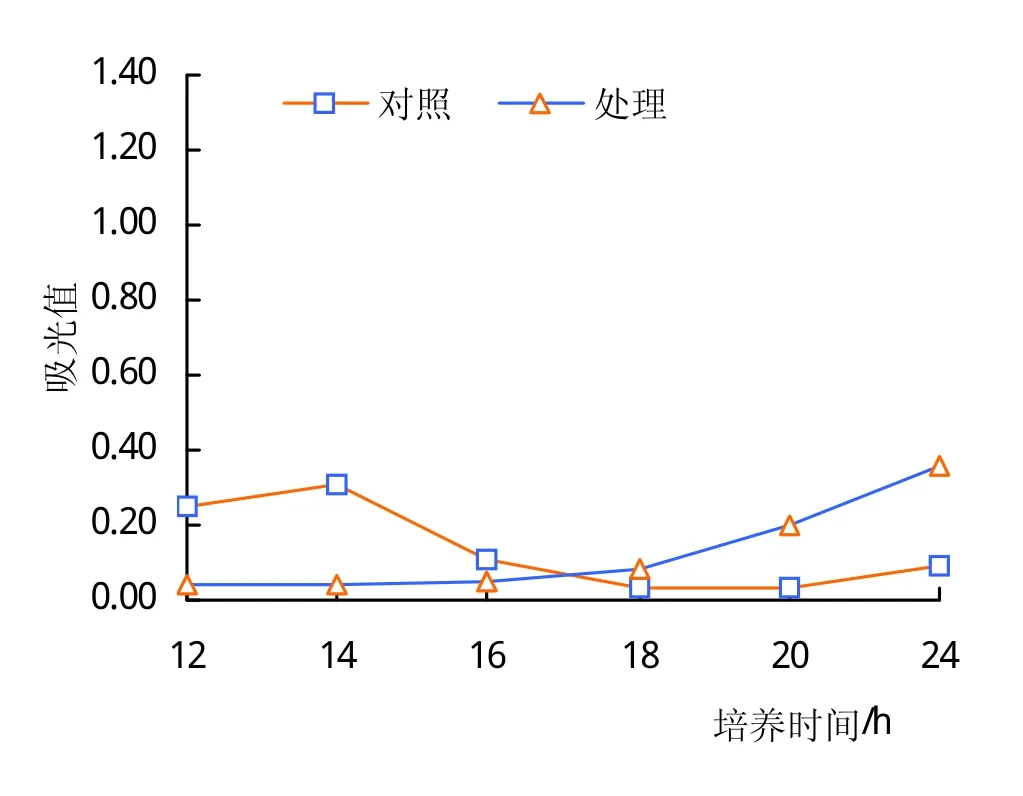
图3 枯草芽孢杆菌在30%YPG培养液中的生长情况
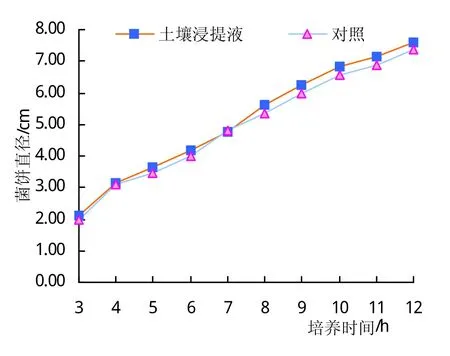
图4 胜红蓟土壤提取液对石榴枯萎病菌生长的作用
为了提高生防菌株的适应范围,通常的方法是通过系列的筛选试验甚至遗传工程的手段培养适应各种环境的“超级菌”。但农业环境的多样性,致使培养超级适应力的菌株异常困难,到目前为止市售的生防菌剂或多或少存在土壤条件的选择性[23]。本研究将生防菌的使用与环境条件结合起来,应用生态学的观点,从群落结构和功能的角度,通过增加植被多样性来促进生态系统的物质与能量流动,促进微生物生态功能更好地发挥,在一定程度上不失为一种应用上的创新。
在考虑胜红蓟对土壤中有益菌是否具有促进作用的同时,笔者也考虑到其对土壤中病原菌是否存在抑制作用。许多菊科植物存在杀菌活性,具有抑制病原菌的作用。胜红蓟也被证明对柑橘园土传病原菌具有抑制作用[24-25]。但本研究表明其对石榴枯萎病菌的作用不明显。胜红蓟是南方农田果园比较常见的一种恶性杂草,这种杂草作为果园生态系统中的一个因子,对土壤环境的作用还需要从多学科角度不断深入挖掘,以期揭示更多的生态规律。
[1]汤东生,蒋其军,毛忠顺,等.不同作物套栽对枯草芽孢杆菌控制石榴枯萎病效果的影响[J].中国生物防治学报,2012,28(2):88-94.
[2]刘亚柏,王敬根,付反生,等.果园生草栽培对土壤生态环境的影响[J].扬州大学学报:农业与生命科学版,2015,36(4):110-113.
[3]王耀锋,邵玲玲,刘玉学,等.桃园生草对土壤有机碳及活性碳库组分的影响[J].生态学报,2014,34(20):6002-6010.
[4]汤东生,蒋其军,毛忠顺,等.果园杂草对枯草芽孢杆菌控制石榴枯萎病的增效作用[J].植物保护,2012,38(3):72-76.
[5]Bais H P,Weir T L,Perry L G,et al.The role of root exudates in rhizosphere interactions with plants and other organisms[J].Annual Review of Plant Biology,2006,57:233-266.
[6]Larios L,Suding K N.Competition and soil resource environment alter plant-soil feedbacks for native and exotic grasses[J].AoB Plants,2015,7:1-9.
[7]Haichar F E Z,Santaella C,Heulin T,et al.Root exudates mediated interactions belowground[J].Soil Biology and Biochemistry,2014,77:69-80.
[8]Paul,E A.Soil microbiology,Ecology and Biochemistry(Fourth Edith)[M].New York:Elsevier,2014.
[9]Baetz U,Martinoia E.Root exudates:the hidden part of plant defense[J].Trends in Plant Science,2014,19(2):90-98.
[10]Huang X F,Chaparro J M,Reardon K F,et al.Rhizosphere interactions:root exudates,microbes,and microbial communities[J].Botany,2014,92(4):267-275.
[11]Hao W Y,Ren L X,Ran W,et al.Allelopathic effects of root exudates from watermelon and rice plants onFusarium oxysporumf.sp.niveum[J].Plant and Soil,2010,336(1):485-497.
[12]Zuo C,Li C,Li B,et al.The toxic mechanism and bioactive components of Chinese leek root exudates acting againstFusarium oxysporumf.sp.cubensetropical race 4[J].European Journal of Plant Pathology,2015,143(3):447-460.
[13]Fang Y,Zhang L,Jiao J,et al.Tobacco rotated with rapeseed for soil-borne phytophthora pathogen biocontrol:mediated by rapeseed root exudates[J].Front Microbiology,2016,7:894.
[14]Wang B,Li R,Ruan Y,et al.Pineapple-banana rotation reduced the amount ofFusarium oxysporummore than maize-banana rotation mainly through modulating fungal communities[J].Soil biology&Biochemistry,2015,86:77-86.
[15]Yuan J,Huang Q,Raza W,et al.Organic acids from root exudates ofbanana help rootcolonization ofPGPR strainBacillusamyloliquefaciens NJN-6[J].Scientific Reports,2015,5:13438.
[16]Kong C H,Liang W,Hu F,et al.Allelochemicals and their transformations in the Ageratum conyzoides intercropped citrus orchard soils[J].Plant and Soil,2004,264(1-2):149-157.
[17]Bruce,T J A,Smart L E,Birch A N E,et al.Crop Protection:Prospects for plant defense activators and biocontrol in IPMConcepts and lessons learnt so far[M].Elsevier,2016.
[18]陈源,卜元卿,单正军.微生物农药研发进展及各国管理现状[J].农药,2012,51(2):83-89.
[19]Ravensberg W J.Commercialisation of Microbes:Present Situation and Future Prospects,in Principles of Plant-Microbe Interactions[M].Springer International Publishing,2014:309-317.
[20]Hartmann A,Schmid M,van Tuinen D,et al.Plant-driven selection of microbes[J].Plant and Soil,2009,321(1):235-257.
[21]Morgan J A W,Bending G D,White P J.Biological costs and benefits to plant-microbe interactions in the rhizosphere[J].Journal of Experimental Botany,2005,417:1729-1739.
[22]van Veen J A,van Overbeek L S,van Elsas J D.Fate and activity of microorganisms introduced into soil[J].Microbiology and Molecular Biology Reviews,1997,61(2):121-135.
[23]Symondson W O C,Sunderland K D,Greenstone M H.Can generalist predators be effective biocontrol agents?[J].Annual Review of Entomology,2002,47:561-594.
[24]Kong C,Liang W,Hu F,et al.Allelochemicals and their transformations in theAgeratum conyzoidesintercropped citrus orchard soils[J].Plant and Soil,2004,264(1):149-157.
[25]胡飞,孔垂华,徐效华,等.胜红蓟黄酮类物质对柑桔园主要病原菌的抑制作用[J].应用生态学报,2002,13(9):1166-1168.

