叶内型肺隔离征肺部反复感染与基底干细胞增殖功能的关系
王巧兴,吴琦,孙昕,李敏敏,宋丽佳,刘会金,陈怀永,李红蔚
叶内型肺隔离征(ILS)是一种肺部先天发育异常性疾病,是由发育异常的肺叶接受体循环异常供血形成的[1]。ILS约占先天性肺发育异常疾病的0.15%~6.40%,常见于青少年,表现为反复或慢性的肺部感染[2]。由于反复感染及出血风险使得很多患者选择外科切除受累肺叶的治疗方法,目前尚缺乏有效的内科治疗方案[3]。尽管ILS的病因仍有争议,但深入了解肺部内环境稳态的机制对寻找ILS新的治疗方案是有益的。气道上皮由多种细胞组成,其中包括杯状细胞、纤毛细胞和基底细胞;其作为机体第一道防线阻止病原体入侵[4]。杯状细胞可分泌多种黏蛋白,其中最主要的是黏蛋白5AC(MUC5AC)和 MUC5B[5-6]。黏蛋白形成黏液层,构成气道化学屏障,对抗病原体入侵。纤毛细胞通过摆动促进黏液层移动,以清除气道中的病原体及颗粒物质[7]。基底细胞可以被角蛋白 5(KRT5)标记,当这些细胞受损时,基底细胞作为干祖细胞,增殖分化成相应的气道上皮细胞以维持气道结构的完整性[8-11]。因此,基底干细胞功能受损导致气道完整性不能得到及时修复,可能是机体呼吸道反复感染的原因之一。本研究通过比较ILS患者及健康人气道杯状上皮细胞比例、MUC5AC和MUC5B的分泌及表达、纤毛细胞的分布及基底细胞的增殖情况,探讨基底干细胞增殖能力与ILS发病的关系,为ILS治疗提供新的方向。
1 资料与方法
1.1 研究标本 4例健康对照肺石蜡包埋标本(对照组)来自美国Cedar Sinai医学中心,并通过了该中心机构审查委员会(IRB)的批准(协议号:pro00032727)。于2004年6月—2014年5月从天津市海河医院收集了4例接受外科切除的ILS的肺组织标本(ILS组),通过了天津市海河医院IRB的批准(协议号:2015HHLL02);所有组织标本的采集均经患者或家属同意,并已签署知情同意书。4例ILS患者中男3例,女1例,1例为新鲜肺组织,3例为石蜡包埋肺组织,年龄21~28岁,平均25岁。
1.2 主要试剂及仪器 苏木素-伊红染液购自生工生物工程(上海)股份有限公司;PAS染色液购自珠海贝索科技有限公司;免疫荧光所需抗体如下:鼠源一抗MUC5AC购自Thermo Scientific公司;鼠源一抗乙酰化α-微管蛋白(ACT)购自Sigma公司;兔源一抗KRT5购自Covance公司;兔源一抗Ki67购自eBioscience公司;驴抗鼠二抗及驴抗兔二抗购自Invitrogen公司;固定组织RNA提取试剂盒购自康为世纪生物科技有限公司;IQTMSYBR®Green Supermix购自Bio-Rad Laboratories 公司;10×PCR buffer(无 MgCl2)、MgCl2购自Roche公司;dATP、dGTP、dCTP、dUTP、Hexamers(随机引物)、RNA酶抑制剂购自Talana公司;逆转录酶Super ScripⅢ(SSⅢ)购自Invitrogen公司;正置显微镜购自Olympus公司(型号SZX7),倒置荧光显微镜购自Olympus公司,荧光定量PCR仪购自Roche公司,PCR扩增仪购自Bio-Rad公司,微量紫外分光光度计购自Thermo公司。
1.3 方法
1.3.1 HE染色观察气道结构及炎性改变 将2组肺组织块均切成5µm的薄片,脱蜡后用苏木素溶液染核5 min,1%盐酸乙醇分化10 s,流水冲洗,0.5%水溶性伊红溶液染色1 min,流水冲洗、脱水、封片;HE染色后在显微镜下用cellSens Dimension拍照系统拍摄获取图像(×400)。
1.3.2 PAS染色观察气道杯状细胞的数量 2组石蜡切片脱蜡后用高碘酸溶液处理10~15 min,蒸馏水冲洗,雪夫试剂10~15 min,流水冲洗,Mayer苏木精染核3 min,流水冲洗、脱水、封片;PAS染色后用cellSens Dimension拍照系统拍摄获取图像(×400);胞浆红染、胞核蓝染的细胞为PAS染色阳性;每例患者肺组织标本均选取5个气道统计其细胞总数及阳性细胞数并计算其百分比。
1.3.3 免疫荧光染色观察含MUC5AC、ACT、KRT5及Ki67的细胞 用已知的阳性染色标本作为阳性对照、标本一抗和二抗以PBS代替作为自发荧光对照、标本不加一抗加二抗作为阴性对照;2组石蜡切片脱蜡、抗原修复(柠檬酸抗原修复法)、PBS泡洗、BSA封闭30 min,加一抗于4℃冰箱过夜,PBST泡洗,加二抗于室温孵育90 min,PBS泡洗,DAPI荧光封片剂封片;染色后立即用倒置荧光显微镜以适当激发波长观察染色标本,若标本自发荧光对照和阴性对照无荧光或有微弱荧光,阳性对照及待测标本为显著荧光,则为荧光染色阳性;于倒置荧光显微镜下用cellSens Dimension拍照系统在同一视野中获取不同波长下的图像(×400),软件合成后得到最终图像;每例患者肺组织标本均选取5个气道统计其细胞总数及阳性细胞数并计算其百分比。
1.3.4 Real-time PCR测定MUC5AC和MUC5B的基因表达量 将2组石蜡包埋肺组织块切成15µm厚的切片,弃去表面2~3片接触空气的切片不用,参照说明书要求提取RNA,将RNA溶液稀释到40 g/L,按照反转录反应体系中各种溶液用量配好反应体系,混匀后于PCR仪中进行反转录得到cDNA;反转录反应体系:10×PCR buffer 5µL、MgCl215µL、dNTP-Mix 1µL、Hexamers 1µL、RNA 酶抑制剂 0.5µL、SSⅢ0.625µL、RNA样品5µL、H2O补足至50µL。反转录程序:25℃10 min,48℃ 40 min,92℃ 5 min,4℃恒温保存。按照Real-time PCR反应体系中各种溶液用量配制反应体系,混匀后置于Real-time PCR仪中反应获得目的基因表达量;反应条件:95℃预变性3 min;94℃变性 40 s,60℃退火30 s,72℃延伸30 s,循环40次;72℃延伸7 min。25µL的反应体系包含 cDNA 5µL、SYBR Green 12.5µL、上下游引物各0.5 µL、H2O 6.5 µL。引物分别为 β-actin:上游 5′-GGCACCCAGCACAATGAAGATCAA-3′,下游 5′-ACTCGT⁃CATACTCCTGCTTGCTGA-3′;MUC5AC:上游 5′-TCCG⁃GCCTCATCTTCTCC-3′,下 游 5′-ACTTGGGCACTGGT⁃GCTG-3′;MUC5B:上游 5′-CACATCCACCCTTCCAAC-3′,下游 5′-GGCTCATTGTCGTCTCTG-3′。管家基因 β-actin标化样品,结果数值以Ct值来表示。待测样品目的基因的相对表达量为 2-ΔCt。
1.4 统计学方法 采用SPSS 20.0软件进行数据分析,正态分布的计量资料用均数±标准差(±s)表示,两组比较采用t检验;非正态分布的计量资料用中位数和四分位数[M(P25,P75)]表示,2组比较采用秩和检验;P<0.05为差异有统计学意义。
2 结果
2.1 2组气道的炎性改变 ILS组切除肺叶均为左肺下叶,且均为降主动脉异常供血。其中获得的1例新鲜肺叶呈深红色,表面呈现大小不同的囊性病变,在开放的囊性病变中可见大量黄色脓液(图1A)。对照组肺组织HE染色后未见明显的炎性细胞浸润,且小气道结构正常(图1B);而ILS组表现为大量的炎性细胞浸润,且小气道结构严重扭曲(图1B)。
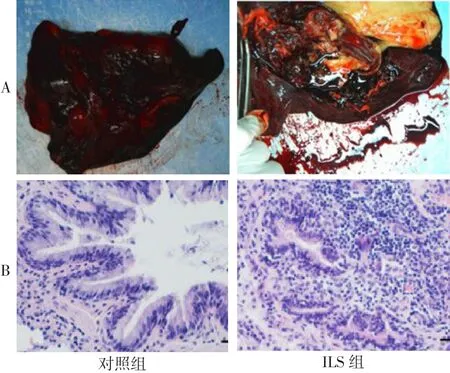
Fig.1 Inflammatory changes of lung lobes in two groups图1 2组肺叶的炎性改变
2.2 2组气道上皮的改变 ILS组气道中PAS染色较对照组更为密集(图2A)。免疫荧光染色发现ILS组气道中含有较多的 MUC5AC(图 2B),而且MUC5AC阳性细胞/气道细胞百分比也明显增多,Real-time PCR发现ILS组MUC5AC和MUC5B mRNA水平也较对照组升高,见表1。免疫荧光结果表明ILS组和对照组的ACT阳性细胞/气道细胞百分比差异无统计学意义(P>0.05),见图3、表1。
2.3 2组中基底干细胞的增殖能力比较 在远端气道中,KRT5+细胞占气道细胞的比例在ILS组和对照组是相当的,见图4、表1。但是,Ki67+KRT5+细胞占KRT5+细胞的比例,ILS组明显少于对照组,见表1。
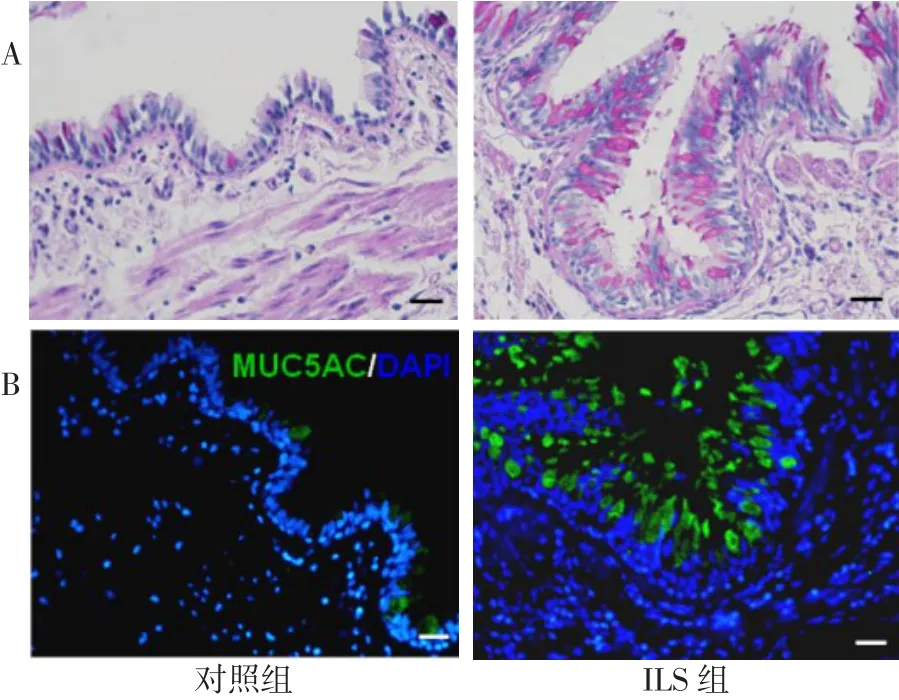
Fig.2 Secretion of mucin in two groups(×400)图2 2组中黏蛋白的分泌情况(×400)
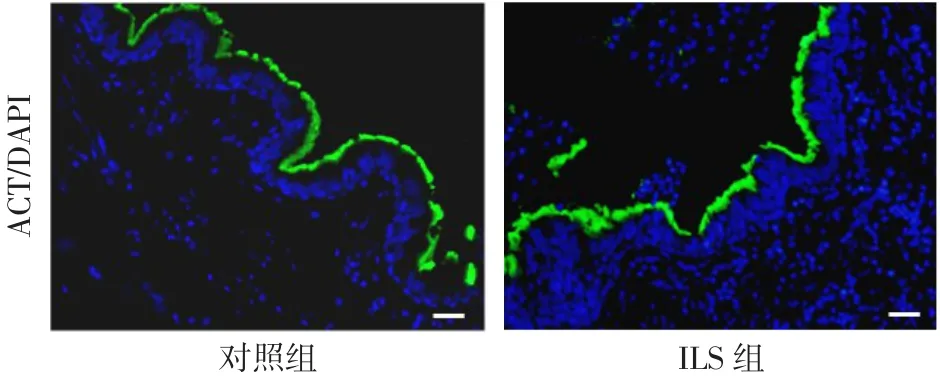
Fig.3 Changes of ciliated cells in two groups(immunofluorescence staining,×400)图3 2组中纤毛细胞改变(免疫荧光染色,×400)
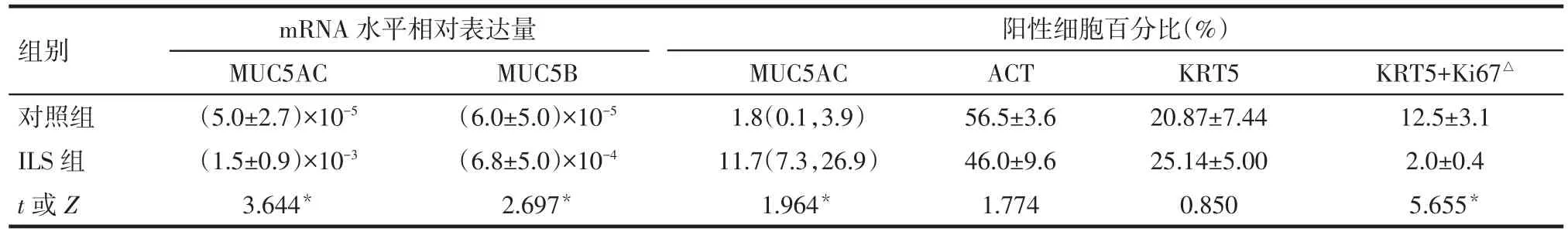
Tab.1 Comparison of expressions of all kinds of cells between two groups表1 2组中各类细胞表达情况的比较 (n=4)
3 讨论
本研究中,ILS肺叶的病理改变显而易见。主要的病理改变是囊性或实性改变,这与以前的报道是一致的[12]。这种囊性改变可能与异常肺叶的循环动脉供血有关,因为循环动脉的压力较肺动脉压力高。开放的囊性病变中含有大量黄色脓液表明异常肺叶已严重感染,而异常肺叶对细菌和其他病原体的易感性可能与其和支气管树相通有关。
气道上皮作为第一道防御屏障抵抗病原体入侵,不仅是通过其物理屏障作用而且具有黏液纤毛系统[13-14]。黏液纤毛清除系统是一个重要的先天性防御机制,可以保护肺组织免受吸入性过敏原和病原体的侵袭。黏液纤毛功能障碍是人类气道反复感染的常见特征。黏液纤毛系统包括纤毛、保护性黏液层和气道表面液体层,它们一起协同工作,移除从肺吸入的病原体[15]。ACT是纤毛细胞的标志物,可以特异性地标记纤毛细胞。本研究中,ILS组和对照组中ACT阳性细胞的百分比无明显差异,即纤毛细胞的数量相似;由于未检测ILS中纤毛摆动的频率是否改变,因此ILS中纤毛细胞的功能是否发生改变需要进一步研究。MUC5B的缺失会导致呼吸道中致病微生物的积累,最终导致慢性感染[16]。然而,黏蛋白的过表达可能会减弱黏液纤毛的清除能力,为微生物的生长提供适宜的环境,从而导致气道感染[7,17-18]。本研究中,ILS 的异常肺叶中 MUC5AC和MUC5B表现为过表达,所以ILS患者肺部反复感染可能与黏蛋白过表达有关。因此,减少黏蛋白的产生可能是治疗ILS的新方法。
本研究是对ILS末端气道干细胞行为的初次研究。基底细胞存在于人类气管、支气管和细支气管中。当病原体入侵时,气道基底干细胞可以通过增殖修复来保证气道上皮的完整性[19]。通常,当病原体感染引起气道上皮细胞损伤时,基底细胞增殖并分化成CLUB细胞和纤毛细胞来补足受损的气道上皮细胞[10,18]。基底细胞可以被KRT5特异性标记,细胞的增殖活动可以被Ki67特异性标记;本研究中,KRT5+细胞占气道细胞的比例在ILS组和对照组无明显差异,Ki67+KRT5+细胞占KRT5+细胞的比例,ILS组明显少于对照组;可见ILS组与对照组相比,基底干细胞的数量无明显差异,但具有增殖能力的基底干细胞数量明显减少。由此可知,ILS组基底干细胞的增殖能力受损。因此,ILS患者发生肺部的反复感染可能与基底干细胞增殖能力的受限有关。
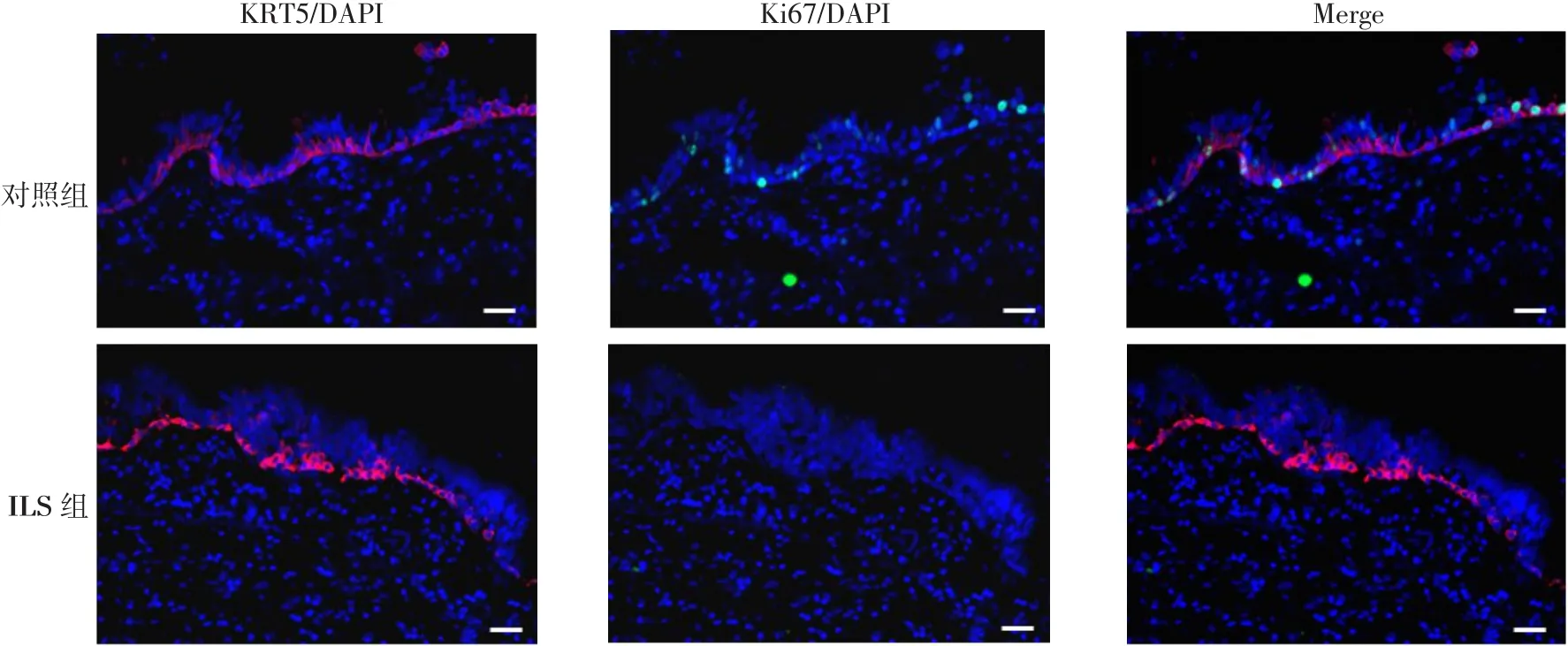
Fig.4 Comparison of the proliferative potential of airway basal stem cells between two groups(immunofluorescence staining,×400)图4 2组中气道基底干细胞的增殖潜能的比较(免疫荧光染色,×400)
病原体感染导致的纤毛细胞的缺失可以通过基底细胞增殖来补偿,以此来修复气道上皮细胞的完整性[20]。当病原体感染时,基底细胞还可以通过气道上皮细胞去分化再生[21-22]。本研究中,尽管ILS组基底干细胞的比例保持不变,但是基底干细胞的增殖潜能受到了抑制。基底细胞不能维持上皮细胞完整性,导致入侵的病原体易通过气道上皮屏障引起感染。异常肺叶的血供来源于主动脉而非肺动脉[23],而主动脉内皮细胞可能与基底干细胞行为的改变有关。研究表明,内皮基质金属蛋白酶-14对人类基底细胞的生长至关重要[24]。因此,需要进一步研究内皮-基质相关性以揭示ILS的发病机制。
总之,黏蛋白的高分泌状态和基底干细胞增殖潜能受限导致ILS中气道上皮细胞的防御能力减低可能是导致ILS患者反复感染的原因。因此,通过提高气道上皮的再生来恢复气道的完整性为探索ILS的非外科治疗提供了一个新方向。
[1]Corbett HJ,Humphrey GM.Pulmonary sequestration[J].Paediatr Respir Rev,2004,5(1):59-68.doi:10.1016/j.prrv.2003.09.009.
[2]Zener R,Bottoni D,Zaleski A,et al.Transarterial embolization of intralobar pulmonary sequestration in a young adult with hemoptysis[J].J Thorac Dis,2017,9(3):E188-E193.doi:10.21037/jtd.2017.02.82.
[3]Hewett L,Kwon J,Adams JD,et al.Intralobar pulmonary sequestration with aneurysmal feeding vessel:Use of hybrid surgical management[J].Ann Thorac Surg,2016,102(6):e533-e535.doi:10.1016/j.athoracsur.2016.05.043.
[4]Chen H,Matsumoto K,Stripp BR.Bronchiolar progenitor cells[J].Proc Am Thorac Soc,2009,6(7):602-606.doi:10.1513/pats.200907-078RM.
[5]Chen Y,Zhao YH,Di YP,et al.Characterization of human mucin 5B gene expression in airway epithelium and the genomic clone of the amino-terminal and 5'-flanking region[J].Am J Respir Cell Mol Biol,2001,25(5):542-553.doi:10.1165/ajrcmb.25.5.4298.
[6]Hattrup CL,Gendler SJ.Structure and function of the cell surface(tethered)mucins[J].Annu Rev Physiol,2008,70:431-457.doi:10.1146/annurev.physiol.70.113006.100659.
[7]Fahy JV,Dickey BF.Airway mucus function and dysfunction[J].N Engl J Med,2010,363(23):2233-2247.doi:10.1056/NEJMra0910061.
[8]BoersJE,Ambergen AW,Thunnissen FB.Numberand proliferation of basal and parabasal cells in normal human airway epithelium[J].Am J Respir Crit Care Med,1998,157(6 Pt 1):2000-2006.doi:10.1164/ajrccm.157.6.9707011.
[9]GaoX,BaliAS,RandellSH,etal.GRHL2 coordinates regeneration of a polarized mucociliary epithelium from basal stem cells[J].J Cell Biol,2015,211(3):669-682.doi:10.1083/jcb.201506014.
[10]Hong KU,Reynolds SD,Watkins S,et al.Basal cells are a multipotent progenitor capable of renewing the bronchial epithelium[J].Am J Pathol,2004,164(2):577-588.doi:10.1016/s0002-9440(10)63147-1.
[11]Butler CR,Hynds RE.Rapid expansion of human epithelial stem cells suitable for airway tissue engineering[J].Am J Respir Crit Care Med,2016,194(2):156-168.doi:10.1164/rccm.201507-1414OC.
[12]Gustafson RA,MurrayGF,Warden HE,etal.Intralobar sequestration.A missed diagnosis[J].The Annals of thoracic surgery,1989,47(6):841-847.
[13]Proud D,Leigh R.Epithelial cells and airway diseases[J].Immunol Rev,2011,242(1):186-204.doi:10.1111/j.1600-065X.2011.01033.x.
[14]Vareille M,Kieninger E,Edwards MR,et al.The airway epithelium:soldier in the fight against respiratory viruses[J].Clin Microbiol Rev,2011,24(1):210-229.doi:10.1128/cmr.00014-10.
[15]Mall MA.Role of cilia,mucus,and airway surface liquid in mucociliary dysfunction:lessons from mouse models[J].J Aerosol Med Pulm Drug Deliv,2008,21(1):13-24.doi:10.1089/jamp.2007.0659.
[16]Roy MG,Livraghi-Butrico A,Fletcher AA,et al.Muc5b is required for airway defence[J].Nature,2014,505(7483):412-416.doi:10.1038/nature12807.
[17]Johnson DC.Airway mucus function and dysfunction[J].N Engl J Med,2011,364(10):978.doi:10.1056/NEJMc1014719#SA1.
[18]Zuo W,Zhang T,Wu DZ,et al.p63(+)Krt(5+)distal airway stem cells are essential for lung regeneration[J].Nature,2015,517(7536):616-620.doi:10.1038/nature13903.
[19]Kumar PA,Hu Y,Yamamoto Y,et al.Distal airway stem cells yield alveoli in vitro and during lung regeneration following H1N1 influenza infection[J].Cell,2011,147(3):525-538.doi:10.1016/j.cell.2011.10.001.
[20]Wu NH,Yang W,Beineke A,et al.The differentiated airway epithelium infected by influenza viruses maintains the barrier function despite a dramatic loss of ciliated cells[J].Sci Rep,2016,6:39668.doi:10.1038/srep39668.
[21]Zheng D,Yin L,Chen J.Evidence for Scgb1a1(+)cells in the generation of p63(+)cells in the damaged lung parenchyma[J].Am J Respir Cell Mol Biol,2014,50(3):595-604.doi:10.1165/rcmb.2013-0327OC.
[22]Tata PR,Mou H,Pardo-Saganta A,et al.Dedifferentiation of committed epithelial cells into stem cells in vivo[J].Nature,2013,503(7475):218-223.doi:10.1038/nature12777.
[23]Desai S,Dusmet M,Ladas G,et al.Secondary vascular changes in pulmonary sequestrations[J].Histopathology,2010,57(1):121-127.doi:10.1111/j.1365-2559.2010.03586.x.
[24]Ding BS,Gomi K,Rafii S,et al.Endothelial MMP14 is required for endothelial-dependent growth support of human airway basal cells[J].J Cell Sci,2015,128(16):2983-2988.doi:10.1242/jcs.168179.

