川西北沙化土壤对双酚A的吸附特征
杨慧敏,李云桂*,武彩霞,江仁涛,李富程,赵 丽,魏 良 (.西南科技大学环境与资源学院环境工程系,四川 绵阳 6200;2.四川省低成本废水处理技术国际科技合作基地,四川 绵阳 6200)
双酚 A是一种典型的内分泌干扰物[1-3],具有生物毒性和内分泌干扰作用[4-7].具有高脂溶性、疏水性和弱酸性等性质,是生活中重要的化工原料,主要用于聚碳酸酯和环氧树脂的制造,全球年产量高达27亿kg[8].生产、制造、使用或处置过程中BPA的直接排放和无序排放是环境中BPA 的重要来源[9-10].目前,在人体[11-12]、水[13-14]、土壤[15]、沉积物[14]等介质中都能检测出BPA.
释放到环境中的BPA主要通过空气、水体、土壤等途径迁移转化.土壤是BPA重要的存储汇和再释放源[16],土壤中有机污染物主要是由于被吸附而导致其生物有效性降低[17].通过研究土壤对 BPA的吸附规律,发现吸附等温线符合Freundlich模型,且随有机质含量的增加,对 BPA的吸附能力越强[18].此外,发现土壤吸附 BPA 的分配系数KOC在636~931之间,土壤中的BPA具有很低的迁移性[19].目前大量文献关注了SOM[18]、反应温度[20]、离子强度[20]等对BPA吸附的影响,发现SOM是最重要的影响因素[21].
土壤结构的基本单元是土壤团聚体,表土中近 90%的 SOM 位于团聚体内[22],团聚体粒级增大,SOM 氧化稳定性下降[23].土壤沙化会使养分流失,破坏土壤结构,导致SOM含量减少,可直接导致土壤质量及土壤生产潜力降低[24].然而,目前有关不同粒级团聚体及沙化后土壤对吸附污染物的影响研究甚少.本文以川西北高原不同沙化程度的土壤为模型,以BPA为内分泌干扰物的代表,旨在揭示沙化对土壤吸附有机污染物的影响,探讨SOM、土层深度和团聚体对吸附作用的影响.对准确评估沙化后环境风险的演变和防治具有重要的理论价值.
1 材料与方法
1.1 土壤的采集及处理
实验所用土壤取自四川省阿坝藏族羌族自治州红原县,采样季节为草地植被生长最旺盛的7月.根据GB19377-2003天然草地退化、沙化、盐渍化的分级标准[25],选择不同沙化程度的草地作为研究样地,分别为:泥炭土壤(PS、N 33°10′23.0″,E 102°37′2.4″)、未沙化土壤(ND、N 33°10′47.555″,E 102°37′34.172″)、轻度沙化土壤(LD、N 33°10′45.710″,E 102°37′34.016″)、中度沙 化 土 壤 (MD 、 N 33°10′43.667″,E 102°37′33.488″).
采用随机取样,每种土壤选择2个样方,样方大小为 10m×10m,样方内随机选取 3个采样点,按照 0~10、10~20、20~30、30~40cm 分层采集土壤,3个同层土样混合成1个土样,装入采样盒以避免挤压破坏团聚体.同时用100cm3的环刀采集 0~10cm 表层土壤样品,带回实验室立即测定土壤含水率.土样采集后风干,研磨,过 100目筛,密封保存备用.团聚体采取干筛法制备[26]:称取0~10cm的风干土 100g置于套筛上,用振荡机振荡 10min,分离出<0.25、0.25~0.5、0.5~1.0、1.0~2.0、>2.0mm的土壤机械稳定性团聚体,称重并计算出各级团聚体所占百分率(表1).
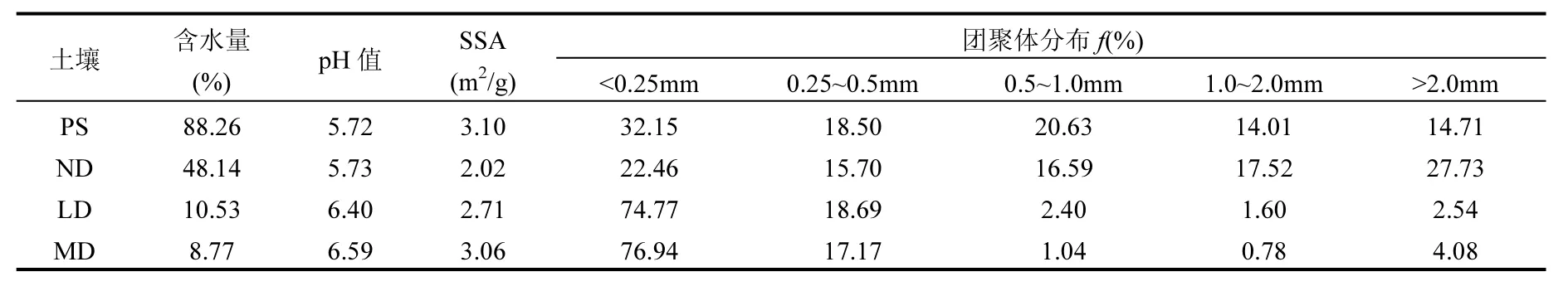
表1 4种表层土的理化性质及团聚体分布Table 1 Physicochemical properties and distribution of aggregates in four surface soils
1.2 土壤的基本性质
土壤含水率采用烘干法测定;土壤 pH值采用pH计测定,土水比为1:2.5,振荡0.5h后,静置测定上清液;土壤比表面积(SSA)根据BET理论,采用N2吸附法用ST-08型比表面积测定仪进行测定;土壤有机质(SOM)含量采用 K2Cr2O7-H2SO4外加热法测定(表2).4种表层土(0~10cm)基本理化性质见表1.

表2 4种受试土壤的有机质含量Table 2 Organic content of four selected soils
1.3 仪器与试剂
ZWY-211C型恒温振荡器(上海智城分析仪器有限公司)、PHS-2C型精密酸度计(上海精科雷磁)、Agilent 1260型高效液相色谱仪(美国安捷伦公司).双酚A(化学纯)、CaCl2与NaN3(分析纯);实验用水为超纯水(美国Millipore公司).
1.4 吸附实验
动力学实验:称取4种受试土壤300~800mg(PS:泥炭土壤300mg,ND:未沙化土壤300mg,LD:轻度沙化土壤700mg,MD:中度沙化土壤800mg)于样品瓶中,加入8mL 80mg/L BPA溶液(溶液中均含0.01mol/L CaCl2,200mg/L NaN3),分别于(1、6、12h)、1、3、5、7、10、15、45d 取出样品.非稳态与稳态等温吸附实验:分别称取 4种受试土壤300~800mg于样品瓶中,加入8mL不同浓度(0~250mg/L)的BPA溶液,振荡时间为7d和30d.深度的影响:称取 4种受试土壤的 4个深度(0~10、10~20、20~30、30~40cm)土样 600mg 于样品瓶中,加入8mL 77mg/L BPA溶液,振荡时间为7d.团聚体的影响:称取4种受试土壤的5种粒级团聚体(<0.25、0.25~0.5、0.5~1.0、1.0~2.0、>2mm)600mg于样品瓶中,加入 8mL 77mg/L BPA溶液,振荡时间为7d.以上实验样品均设置2个平行和 2个空白对照(不加土样),于 25℃、150r/min避光条件下恒温振荡,达到吸附时间后,以3000r/min离心20min得上清液,用高效液相色谱仪(HPLC)测定.
1.5 分析方法和质量保证
高效液相色谱仪型号为 Agilent 1260,色谱柱为C18反相柱(5µm,4.6mm×150mm),柱温25℃,紫外检测波长为 280nm,流动相为乙腈与去离子水(V:V,50:50),流速为 1mL/min,进样量为 10µL.在上述色谱条件下BPA保留时间为3.8min.
实验所用色谱瓶、胶头滴管等玻璃器皿均在无水乙醇溶剂中浸泡,置于 350℃高温程序马弗炉中烘烤 30min,保存备用.整个分析过程按照方法空白、加标空白、基质加标和样品平行样进行质量控制和质量保证.全程跟踪样品前处理及分析测试过程,考察样品制备过程对BPA分析的影响,防止实验过程中其他因素的干扰和样品之间的交叉污染,每个样品进行2组平行实验.目标化合物采用外标法进行定量分析,标准曲线:y=6.480x-0.031,相关系数 R2大于 0.999,线性范围1~250mg/L,相对标准偏差(RSD)是 0.15%,检测限为0.153mg/L.
1.6 数据处理
土壤对BPA的吸附量Qe计算公式如下:
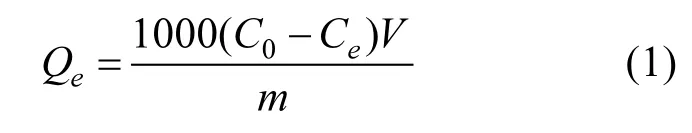
式中:Qe为单位土壤吸附溶液中 BPA的量,mg/kg;V为溶液的体积,mL;C0和 Ce为初始和吸附平衡后 BPA的质量浓度,mg/L;m为土壤的质量,mg.
采用拉格朗日准一级动力学(2)、准二级动力学(3)、双室一级动力学(4)吸附模型对4种受试土壤吸附BPA的数据进行拟合.
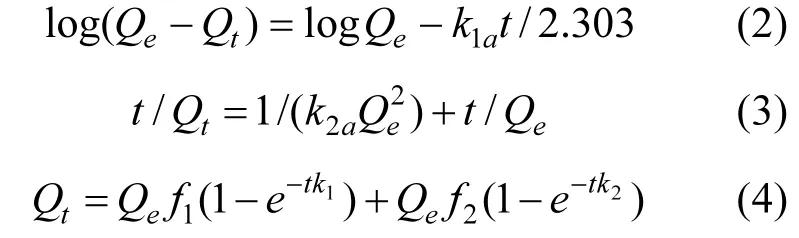
式中:Qe和Qt分别是在吸附平衡和t时刻的吸附量,mg/kg;k1a、k2a分别为准一级(d-1)、准二级(mg/(kg·d))速率常数.k1和 k2分别为快室和慢室吸附速率常数,d-1.f1和f2分别为快、慢室所占总吸附的百分率,f1+ f2=1.
采用 Langmuir(5)和 Freundlich(6)等温吸附模型对土壤吸附BPA数据进行拟合.
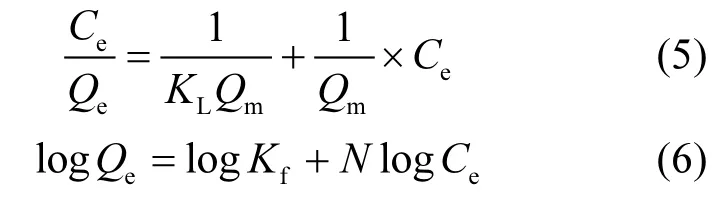
式中:Qe和 Qm分别是在吸附平衡和理论最大单位的吸附量,mg/kg;Ce是吸附平衡时溶液中 BPA的浓度,mg/L;KL表示吸附BPA的能力,L/mg;Kf、N为Freundlich吸附常数.
土壤团聚体对BPA的吸附贡献率R计算公式如下:
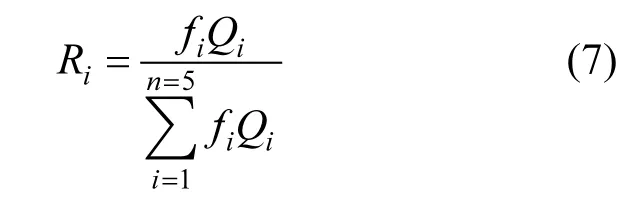
式中:Ri是土壤各级团聚体对BPA的吸附贡献率(i=1,2,3,4,5),%;fi是各级团聚体所占的百分比,%;Qi是各级团聚体对BPA的吸附量,mg/kg.
2 结果与讨论
2.1 吸附动力学
4种受试土壤对BPA的吸附动力学曲线见图1.4种受试土壤对BPA的吸附速率均呈现先快后慢的变化趋势.在最初的 1d内,土壤的吸附速率较快,之后便缓慢上升最后趋于平衡,这是由于吸附开始时吸附剂表面的吸附位点充分,BPA与吸附位点的空间限制少,随着吸附位点逐渐达到饱和时,空间阻力增大,吸附速率显著降低.PS与ND在3d即可达到吸附平衡,LD与MD需9d才达到表观平衡.
分别采用准一级、准二级与双室一级动力学模型对数据进行拟合,拟合结果见表 3.准一级动力学的R2大于0.64,准二级动力学的R2大于0.78,双室一级动力学模型的R2大于0.98.双室一级动力学模型的相关系数R2较好,说明双室一级动力学模型更适合描述4种受试土壤对BPA的吸附过程.丁霞等[27]运用该模型对磺胺甲噁唑在水稻土上的吸附进行研究,也证实其更符合双室一级动力学模型.Johnson等[28]和Pan等[29]对6种常见的吸附动力学模型进行比较研究,发现双室一级动力学模型相对其他模型可以更精确地描述有机污染物在土壤或沉淀物上的吸附[28-29],因此,后续讨论均基于双室一级动力学模型的拟合结果.
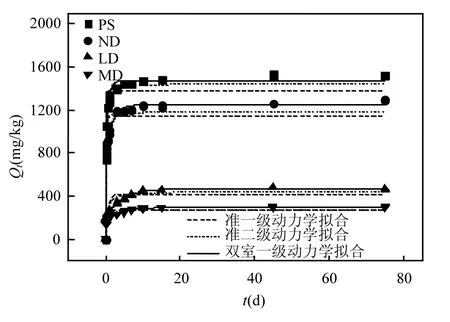
图1 4种受试土壤对BPA的动力学吸附曲线Fig.1 Kinetics of BPA sorption by four selected soils

表3 4种受试土壤吸附BPA的准一级、准二级和双室一级动力学模型拟合参数Table 3 Regression parameters of pseudo-first-order, pseudo-second-order and two-compartment first order kinetic models for the sorption of BPA by four selected soils
双室一级动力学模型将吸附区分为快室吸 附单元和慢室吸附单元.其中,快室吸附速率常数(k1)较大,慢室吸附速率常数(k2)则较小.k1/k2的比值越大则说明快速吸附与慢速吸附差异越显著,双室吸附现象越明显[30].由表 3可知,PS、ND、LD、MD 的 k1/k2分别为 60、118、347和 233,表明 LD的双室吸附现象最明显,MD、ND次之,PS最弱.f1、f2分别为快、慢室所占总吸附的比率,ND的f1值为0.66,快吸附所占比率要大,其吸附过程应是快吸附为主;沙化后,LD、MD的f1值均减小,分别为 0.43、0.54,该吸附过程快慢吸附所占比重相近.
2.2 等温吸附曲线
4种受试土壤对BPA的等温吸附曲线如图2所示,Langmuir和 Freundlich回归参数见表4.Langmuir和 Freundlich均能较好的拟合 BPA的吸附过程,Freundlich模型能更好的拟合不同吸附时间下(7d、30d)不同沙化土壤(PS、ND、LD、MD)对 BPA 的吸附过程(R2>0.99).不同沙化土壤在不同吸附时间下吸附 BPA的 Freundlich等温吸附曲线呈“L型”,N值为0.52~0.70,非线性显著[31].LD、MD比PS、ND的Freundlich N值小(30d,由0.69减小至0.52),即沙化土壤与未沙化土壤相比,吸附等温线非线性增强.BPA在土壤上的吸附作用包括线性的分配作用和非线性的表面吸附,其中线性分配作用的主要介质是土壤有机质[32].土壤沙化后,有机质含量显著下降(表 2),因此分配作用减弱、等温吸附曲线的非线性显著增强.
由表4可知,在30d内,Langmuir饱和吸附量最大的是PS(8901mg/kg);而后是ND(7011mg/kg);其次是 LD(1506mg/kg);吸附容量最小的是MD(1050mg/kg).以未沙化土壤 ND为对照(7011mg/kg),沙化土壤LD与MD的吸附量分别相差4.66、6.68倍.土壤对BPA的吸附量(Qm)与沙化程度显著相关(P<0.05),且随着沙化程度的加剧,BPA的吸附量减小,增加了 BPA在土壤中的移动性.
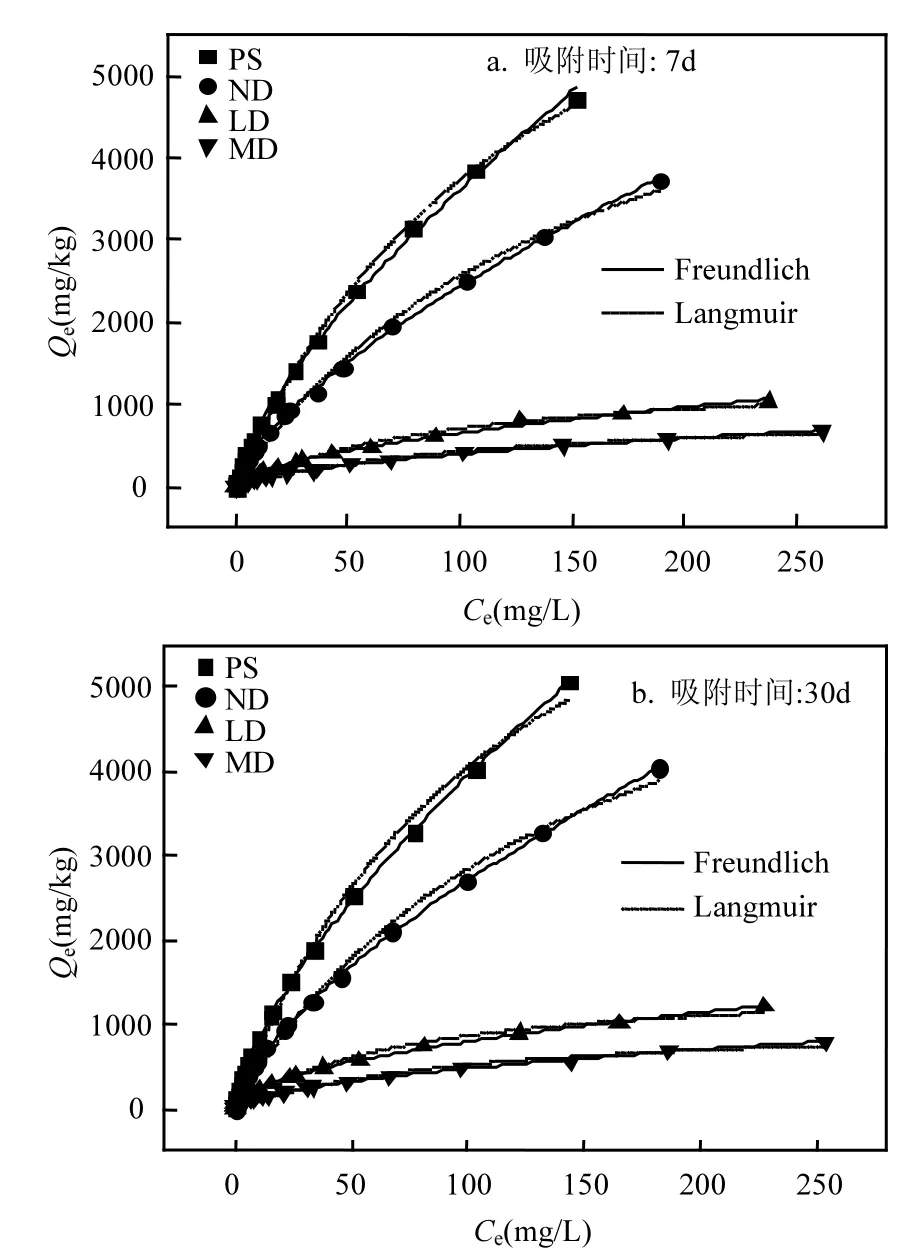
图2 4种受试土壤对BPA的等温吸附曲线Fig.2 Sorption isotherms of BPA by four selected soils
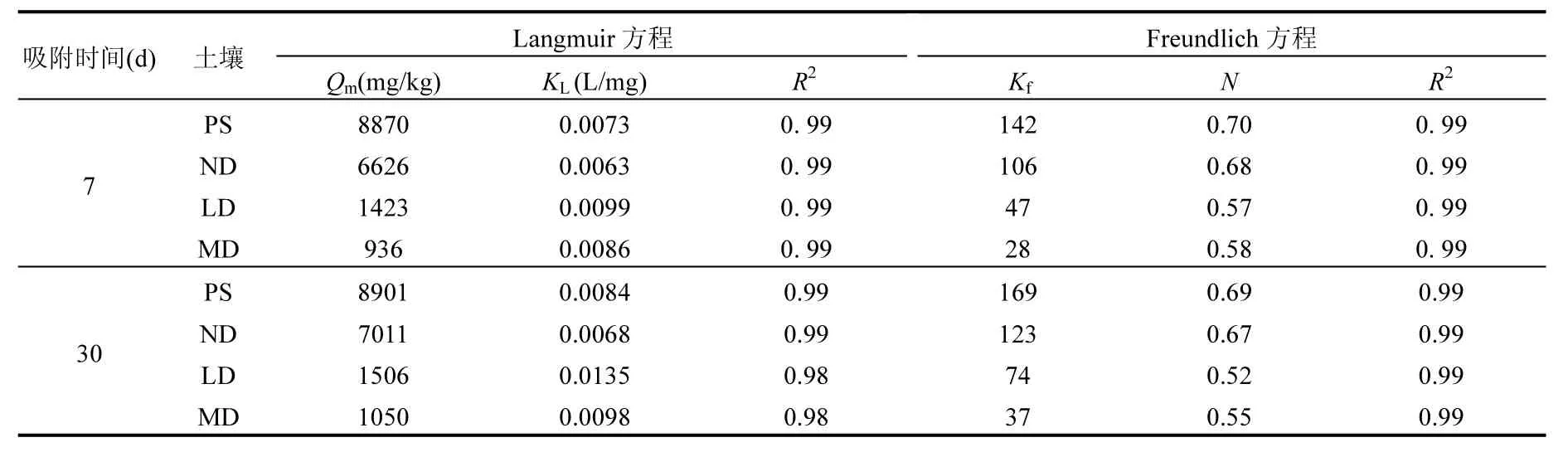
表4 4种受试土壤吸附BPA的Langmuir和Freundlich等温吸附曲线拟合参数Table 4 Regression parameters of Langmuir and Freundlich model for sorption isotherms of BPA by four selects soil

图3 SOM与BPA最大吸附量的关系Fig.3 Relationship between SOM and maximum sorption amount of BPA
沙化对土壤吸附BPA具有重要影响,这与沙化导致土壤的理化性质变化有关.由表 1可知,4种受试土壤的比表面积(SSA)较为接近(2.02~3.10),pH值相当(5.72~6.59);而土壤SOM含量随土壤沙化程度的加剧而减小,SOM含量由160.10减小至14.38g/kg,减小11.13倍.SOM含量与Qm的关系如图3所示,随SOM含量增加,BPA在土壤中的最大吸附量逐渐增加.SOM与Qm呈显著正相关(r>0.999,P<0.01),表明 SOM 是影响土壤吸附 BPA 的重要因素.这与姜鲁等研究一致,土壤对壬基酚饱和吸附容量与有机质含量显著正相关(r=0.92,P<0.05),有机质含量越高的土壤对内分泌干扰物的吸附能力越强[33].
2.3 土层深度对吸附BPA的影响
4 种土层深度(0~10、10~20、20~30、30~40cm)对4种受试土壤(PS、ND、LD、MD)吸附BPA的影响见图 4. 4种受试土壤在每一层的吸附量规律一致(PS>ND>LD>MD),且 0~10cm 的表层土对BPA的吸附量最大,这可能是由于表层土壤能够不断接纳凋零物及根系生长代谢输入的有机质.
0~10cm的表层土中沙化土壤MD(285mg/kg)与未沙化土壤 ND(794mg/kg)相比,吸附量相差2.78 倍.10~20cm 范围内 MD(87mg/kg)与 ND(670mg/kg)吸附量相差 7.70倍.20~30cm 范围内MD(78mg/kg)与 ND(394mg/kg)吸附量相差 5.05倍.30~40cm范围内MD(67mg/kg)与ND(366mg/kg)吸附量相差5.46倍.故在0~10cm范围内,沙化与未沙化土壤的吸附量相差最小.可见,沙化后土壤环境容量的改变不仅仅发生在0~10cm的表层土,而是 0~40cm 土壤的环境容量都将发生显著地改变.这与其SOM含量有关.由图5可知,不同深度的土壤对BPA的吸附量与其SOM呈指数正相关关系(R2=0.73).
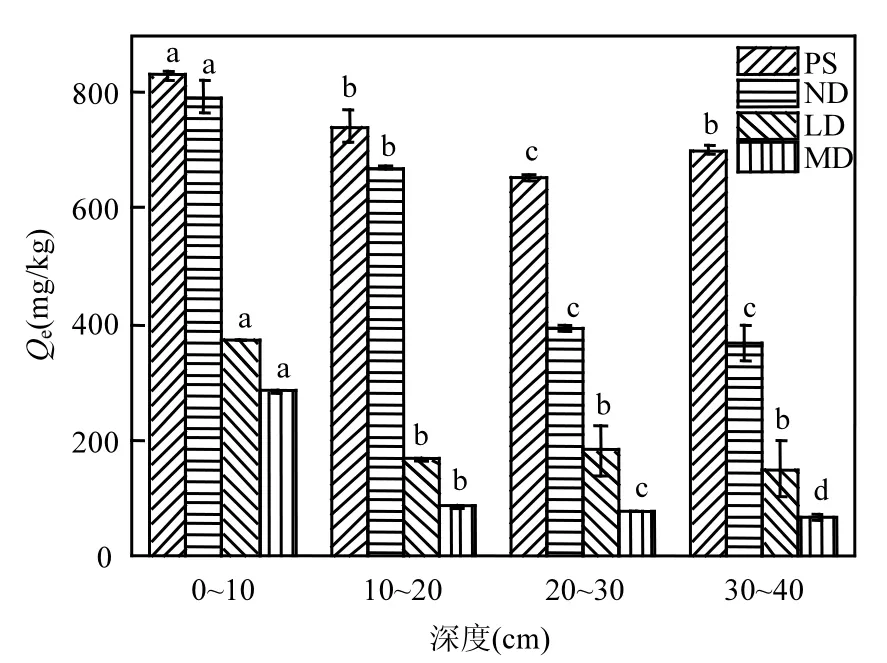
图4 土层深度对BPA吸附的影响(C0=77mg/kg)Fig.4 Effects of soil depth on sorption of BPA(C0=77mg/kg)
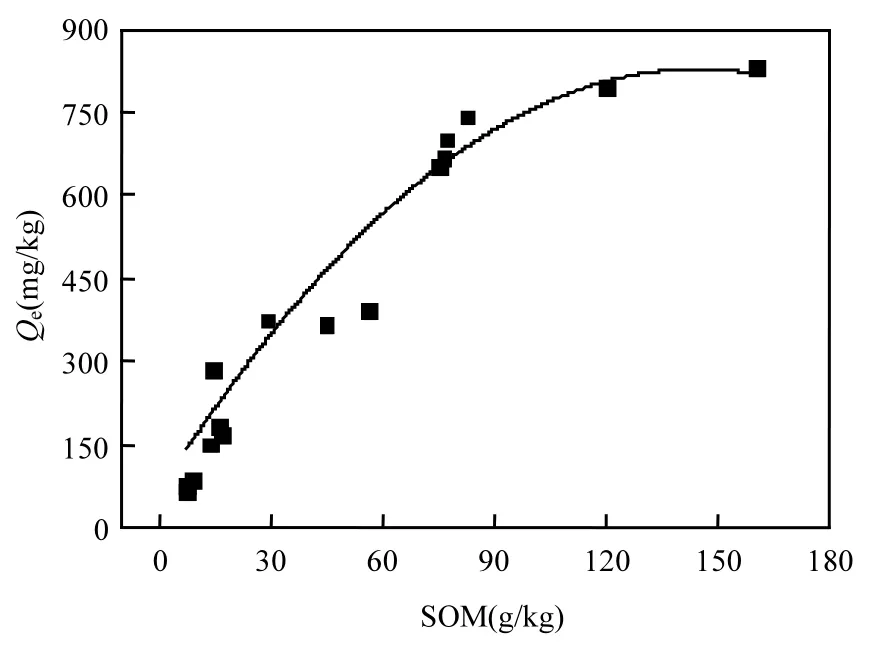
图5 土壤各层SOM含量与BPA吸附量的相关性Fig.5 Correlation between SOM content and sorption amount of BPA at different soil depths
2.4 土壤团聚体对吸附BPA的影响
不同粒级的团聚体直接影响到BPA的吸附能力.5种粒级的团聚体(<0.25、0.25~0.5、0.5~1.0、1.0~2.0、>2mm)对土壤吸附 BPA 的影响见图6.粒级增大,团聚体对BPA吸附性能呈先增加后减小的总体趋势,4种受试土壤中各级团聚体的吸附性能差异又有所不同.PS中各粒级团聚体对 BPA 的吸附量无显著差异(836~866mg/kg).ND中各粒级团聚体的吸附量影响也较小(638~792mg/kg),相差1.24倍.沙化后,各粒级团聚体的吸附性能差异显著增大.LD中各粒级团聚体的吸附量差异显著增加,0.5~1.0mm 的团聚体对BPA的吸附量最大(873mg/kg),<0.25mm的吸附量最小(375mg/kg),两种团聚体吸附性能相差2.33倍.沙化最严重的MD中各粒级团聚体的吸附量差异最大,相差6.41倍(147~942mg/kg);吸附量从大到小依次为:0.5~1.0mm(942mg/kg), 1.0~2.0mm(511mg/kg),>2mm(305mg/kg),0.25~0.5mm(252mg/kg),<0.25mm(147mg/kg).各级团聚体对BPA的吸附量不同,这与其SOM含量有关.由图7可知,各粒级团聚体对 BPA的吸附量与其 SOM呈指数正相关关系(R2=0.82).
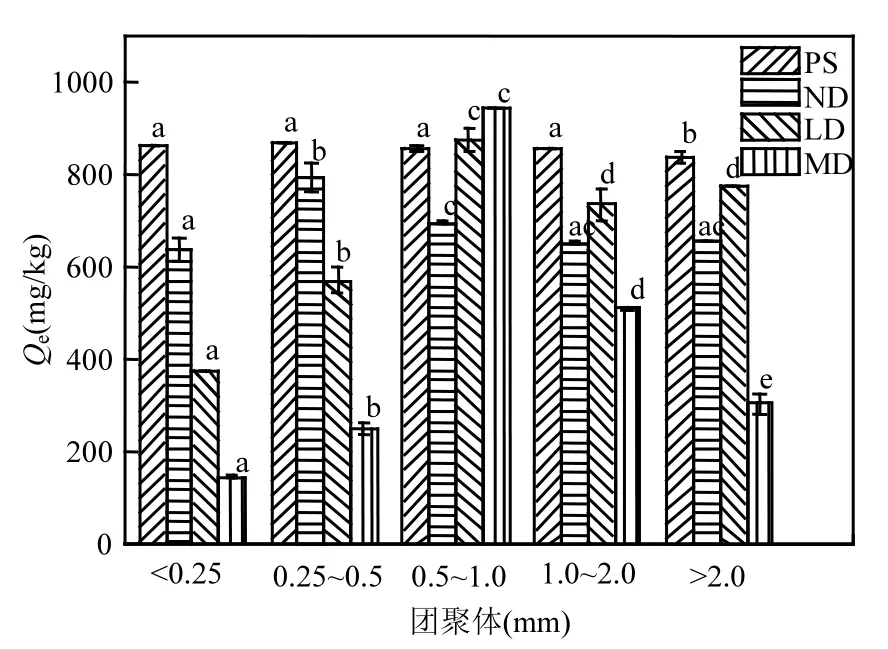
图6 各粒级团聚体对BPA吸附的影响(C0=77mg/kg)Fig.6 Sorption of BPA onto soil aggregate fractions with different particle size(C0=77mg/kg)
沙化后,各粒级团聚体对BPA的吸附量都有不同程度的下降,唯有吸附能力最强的 0.5~1.0mm 粒级团聚体吸附量基本相当(695~942mg/kg).4种受试土壤中,<0.25mm的粒级团聚体吸附量为 147~860mg/kg,最大相差 5.85倍;0.25~0.5mm 的粒级团聚体的吸附量为 252~866mg/kg,最大相差3.44倍;1.0~2.0mm的粒级团聚体的吸附量为 511~856mg/kg,最大相差 1.68倍;>2mm 的粒级团聚体的吸附量在 305~836mg/kg之间,最大相差2.74倍.

图7 土壤各粒级团聚体SOM含量与BPA吸附量的相关性Fig.7 Correlation between SOM content and sorption amount of BPA onto soil aggregate fractions with different particle size
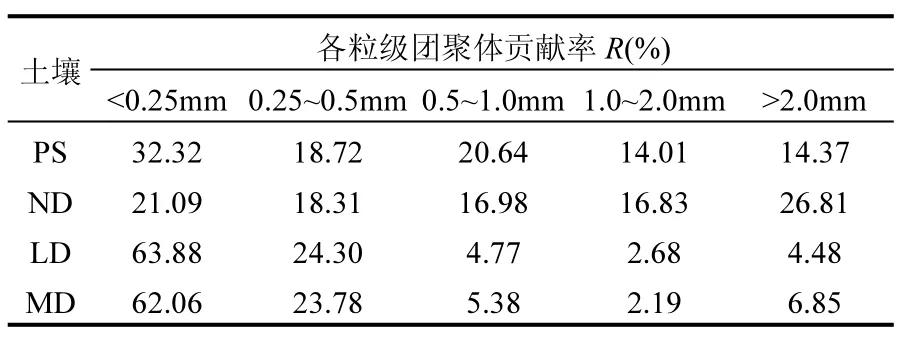
表5 各粒级团聚体对土壤吸附BPA的贡献率Table 5 Contribution rates of different aggregate fractions to sorption of BPA by soils
团聚体对土壤吸附BPA的贡献除了与其吸附性能有关,还与团聚体的分布有关.如表1所示,未沙化土壤 ND中各级团聚体所占百分比相近(15.70%~27.73%),沙化后的土壤 LD、MD 以<0.25mm 粒级团聚体为主,分别为 74.77%、76.94%.为准确地评估各级团聚体对土壤吸附BPA的贡献,根据机械相加的方法计算各级团聚体的吸附相对贡献率(表 5).PS吸附 BPA时,<0.25mm粒级团聚体的吸附贡献率最大(32.32%);而未沙化土壤ND中的5种粒级团聚体对BPA的吸附贡献率较为接近(16.83%~26.81%).沙化后,土壤对BPA的吸附主要来自小粒级团聚体(<0.25、0.25~0.5mm)的贡献,其中<0.25mm 的粒级团聚体贡献率高达 63.88%(LD)和 62.06%(MD).而吸附性能最强的0.5~1.0mm粒级团聚体,尽管吸附性能不受沙化影响,但沙化后 0.5~1.0mm 团聚体的比例急剧下降(6.5~16倍),因此吸附贡献率较小.
3 结论
3.1 4种受试土壤对BPA的吸附过程符合双室一级动力学模型(R2≥0.98).等温吸附过程符合Freundlich 和 Langmuir模型(R2≥0.98).受试土壤Qm与其SOM含量显著正相关.
3.2 土层深度增加土壤对 BPA吸附性能下降,下降幅度与土壤沙化程度显著相关,沙化越严重下降幅度越大(MD>LD>ND>PS);沙化后的土壤LD、MD与ND相比,各层土壤对BPA的吸附性能都显著下降.
3.3 团聚体粒级增大,吸附性能先增加后减小,0.5~1.0mm粒级团聚体吸附性能最强.沙化后,各粒级团聚体的吸附性能差异显著增大,吸附贡献率分布也不同.LD和MD吸附BPA的贡献主要来自小粒级团聚体.
参考文献:
[1]Tordjman K, Grinshpan L, Novack L, et al. Exposure to endocrine disrupting chemicals among residents of a rural vegetarian community [J]. Environment International, 2016,97(12):68-75.
[2]Alonsomagdalena P, Ropero A B, Soriano S, et al. Bisphenol A acts as a potent estrogen via non-classical estrogen triggered pathways [J]. Molecular & Cellular Endocrinology, 2012,355(2):201-207.
[3]Diamantikandarakis E, Bourguignon J P, Giudice L C, et al.Endocrine-disrupting chemicals:an endocrine society scientific statement [J]. Endocrine Reviews, 2009,30(4):293-342.
[4]Deb P, Bhan A, Hussain I, et al. Endocrine disrupting chemical,bisphenol-A, induces breast cancer associated gene HOXB9 expression in vitro and in vivo [J]. Gene, 2016,590(2):234-243.
[5]Verdú I, Trigo D, Martínezguitarte J L, et al. Bisphenol A in artificial soil: Effects on growth, reproduction and immunity in earthworms [J]. Chemosphere, 2017,190:287-295.
[6]Meeker J D, Calafat A M, Hauser R. Urinary bisphenol A concentrations in relation to serum thyroid and reproductive hormone levels in men from an infertility clinic [J].Environmental Science & Technology, 2010,44(4):1458-1463.
[7]朱思瑞,高乃云,鲁 仙,等.热激活过硫酸盐氧化降解水中双酚A [J]. 中国环境科学, 2017,37(1):188-194.
[8]Lorber M, Schecter A, Paepke O, et al. Exposure assessment of adult intake of bisphenol A (BPA) with emphasis on canned food dietary exposures [J]. Environment International, 2015,77(4):55-62.
[9]Staples C A, Dome P B, Klecka G M, et al. A review of the environmental fate, effects, and exposures of bisphenol A [J].Chemosphere, 1998,36(10):2149-2173.
[10]Citulski J A, Farahbakhsh K. Fate of endocrine-active compounds during municipal biosolids treatment: A Review [J].Environmental Science & Technology, 2010,44(22):8367-8376.
[11]Yang Y, Guan J, Yin J, et al. Urinary levels of bisphenol analogues in residents living near a manufacturing plant in south China [J]. Chemosphere, 2014,112(10):481-486.
[12]Calafat A M, Ye X, Wong L Y, et al. Exposure of the U.S.Population to Bisphenol A and 4-tertiary-Octylphenol:2003â2004 [J]. Environmental Health Perspectives, 2008,116(1):39-44.
[13]Lee S, Liao C, Song G J, et al. Emission of bisphenol analogues including bisphenol A and bisphenol F from wastewater treatment plants in Korea [J]. Chemosphere, 2015,119(119C):1000-1006.
[14]陈玫宏,郭 敏,刘 丹,等.典型内分泌干扰物在太湖及其支流水体和沉积物中的污染特征 [J]. 中国环境科学, 2017,37(11):4323-4332.
[15]王 茜,曹燕花,马 冬,等.高效液相色谱法测定淤泥和土壤中双酚 A、壬基酚和辛基酚 [J]. 分析科学学报, 2012,28(6):851-854.
[16]Stumpe B, Marschner B. Dissolved organic carbon from sewage sludge and manure can affect estrogen sorption and mineralization in soils [J]. Environmental Pollution, 2010,158(1):148-154.
[17]Cao X, Ma L, Liang Y, et al. Simultaneous immobilization of lead and atrazine in contaminated soils using dairy-manure biochar [J].Environmental Science & Technology, 2011,45(11):4884-4889.
[18]Sun K, Jin J, Gao B, et al. Sorption of 17α-ethinyl estradiol,bisphenol A and phenanthrene to different size fractions of soil and sediment [J]. Chemosphere, 2012,88(5):577-583.
[19]Fent G, Hein W J, Moendel M J, et al. Fate of 14C-bisphenol A in soils [J]. Chemosphere, 2003,51(8):735-746.
[20]鲁佳铭,王欣泽,沈 剑,等.两种土壤对内分泌干扰物双酚 A 和类固醇的吸附性能 [J]. 净水技术, 2011,30(1):67-71.
[21]Sun K, Jin J, Gao B, et al. Sorption of 17α-ethinyl estradiol,bisphenol A and phenanthrene to different size fractions of soil and sediment [J]. Chemosphere, 2012,88(5):577-583.
[22]Jastrow J D. Soil aggregate formatin and the accrual of particulate and mineral-associated organic matter [J]. Soil Biology &Biochemistry, 1996,28(4/5):665-676.
[23]Cambardella C A, Elliott E T. Carbon and Nitrogen Distribution in Aggregates from Cultivated and Native Grassland Soils [J].Soil Science Society of America Journal, 1993,57(4):1071-1076.
[24]Gad A, Abdelsamie A G. Study on desertification of irrigated arable lands in Egypt II- salinization [J]. Egyptian Journal of Soil Science, 2000,40(3):373-384.
[25]GB19377-2003 天然草地退化、沙化、盐渍化的分级标准 [S].
[26]Zhang S, Li Q, Ying L, et al. Contributions of soil biota to C sequestration varied with aggregate fractions under different tillage systems [J]. Soil Biology & Biochemistry, 2013,62(5):147-156.
[27]丁 霞,王 彬,朱静平,等.川西平原水稻土对磺胺甲噁唑的吸附动力学研究 [J]. 安全与环境学报, 2016,16(2):205-211.
[28]Johnson M D, Keinath T M, Weber W J. A distributed reactivity model for sorption by soils and sediments. 14. Characterization and modeling of phenanthrene desorption rates [J]. Environmental Science & Technology, 2001,35(8):1688-1695.
[29]Pan B, Xing B S, Liu W X, et al. Two-compartment sorption of phenanthrene on eight soils with various organic carbon contents[J]. Journal of Environmental Science & Health, 2006,41(8):1333-1347.
[30]黎 明,王 彬,朱静平,等.川西平原还田秸秆 DOM 对矿物细颗粒吸附SMX的影响 [J]. 中国环境科学, 2016,36(11):3441-3448.
[31]Srivastava R K, Singh B K, Mani D. Effect of organic matter on sorption and persistence of thiram fungicide in different soils [J].Asian Journal of Chemistry, 2013,25(1):292-296.
[32]夏星辉,孟丽红,呼丽娟.苯并(a)芘在黄河水体不同团聚体颗粒物上的表面吸附和分配作用特征 [J]. 环境科学学报, 2006,26(2):269-274.
[33]姜 鲁,王继华,李建忠,等.炔雌醇和壬基酚在土壤中的吸附-解吸特征 [J]. 环境科学, 2012,33(11):3885-3892.

