HCO3−和NO3−对水中双氯芬酸紫外光解的影响
刘义青,史鸿乐,付永胜 (西南交通大学地球科学与环境工程学院,四川 成都 611756)
自 20世纪 90年代,药品和个人护理品(PPCPs)、内分泌干扰物(EDCs)等被列为新兴环境污染物以来,它们在环境中的存在、迁移和转化逐渐得到了国内外环境工作者的广泛关注和重视[1-2].其中,双氯芬酸(DCF)是一种常用的消炎镇痛药,属于非甾体抗炎药(NSAIDs).它在医药行业中使用较多,被广泛用于消炎镇痛、治疗风湿和抗关节炎[3].由于DCF在传统的污水处理厂较难被有效去除,它会随着污水处理厂出水进入到自然环境中[4-5].因此,DCF在不同环境介质中(如地表水、地下水、底泥等)频繁被检出,浓度在ng/L-µg/L之间[6-7].研究表明,DCF在环境中的长期暴露不仅会对鱼类、陆生脊椎动物等生物体造成不良影响,还可能导致抗药性病原体的出现,从而威胁人类健康和生态系统的平衡[8-9].因此,有必要对水中DCF的消除进行研究.
有研究表明,DCF在太阳光照下可以发生快速降解,其降解过程包括直接光解和间接降解(即自敏化光解)两种途径,光降解是它在自然水体中消除的重要路径之一[10-11].硝酸盐(NO3−)和碳酸氢盐(HCO3−)是水中比较常见的两种阴离子.NO3−作为一种光敏剂在太阳光照下可以产生强氧化性的羟基自由基(HO•),生成的HO•既可以与水中污染物发生反应从而加快目标污染物的去除[12-13];又可以与 HCO3−反应产生碳酸根自由基(CO3•−)[14].CO3•−是一种选择性的单电子氧化剂,作为一种亲电自由基,它可以和富含电子的化合物(如酚类、含氮有机物、含硫有机物等)发生反应,反应速率常数在 106~109L/(mol·s)之间[15-17].因此,水中NO3−和HCO3−的存在会影响有机化合物的光降解.作者之前已发现NO3−的存在可以明显促进土霉素的紫外光解,NO3−和HCO3−的同时存在可以进一步加快土霉素的去除,分析证明是由于生成的 HO•和 CO3•−的作用[18].虽然 DCF 在低压汞灯(UV-254nm)照射下可以被有效去除[19-20],但是 NO3−和 HCO3−对 DCF 紫外光解的影响却少有报道.为此,本文拟在UV-254nm照射下,研究 NO3−和 HCO3−对水中 DCF紫外光解的影响,并利用液相色谱——质谱联用仪分析DCF在 UV/NO3−/HCO3−体系中的转化产物和反应机理.
1 材料与方法
1.1 试剂
双氯芬酸钠(纯度≥99%)购于 Sigma-Aldrich公司;硝酸钠(NaNO3)、碳酸氢钠(NaHCO3)、硫代硫酸钠(Na2S2O3)、磷酸一氢钾(K2HPO4)和磷酸二氢钾(KH2PO4)为分析纯级,乙腈和甲醇为HPLC级,均购自Fisher Scientific公司;去离子水(Milli-pore, 18MΩ·cm)用于试剂和反应溶液的配置.
1.2 光照实验
光照实验在装有两根低压汞灯(15W)的平行光发射装置中进行,光源主要发射波长 254nm的紫外光,进入反应液的平均光强为0.1mW/cm2.在 DCF光解影响因素实验中,DCF初始浓度为1µmol/L,在指定的取样时间点,取出0.15mL反应液与 0.1mL硫代硫酸钠(50mmol/L,淬灭自由基)混合均匀后避光待测.在 DCF降解产物分析中,DCF初始浓度为 10µmol/L,在指定的时间间隔,直接取样检测,未添加其它任何药剂以防止干扰产物的测定.除了产物分析,其它所有实验均至少重复 3次,得出的数据进行平均数和标准偏差求值,结果图中以平均值做曲线,标准偏差作为误差棒.
1.3 分析方法
高效液相色谱仪(HPLC, Agilent 1100)用于DCF浓度的定量.具体方法为:固定相为Discovery HS C18 色谱柱(2.1×150mm, 5µm);流动相为50%乙腈和50%0.1%乙酸水溶液;流速为0.3mL/min;检测波长为276nm;柱温为25℃;进样体积为50µL.液相色谱——四级杆飞行时间串联质谱仪(LC-QTOF/MS, Agilent公司)用于DCF降解产物的检测.固定相为 Agilent ZORBAX Eclipse XDB-C18 色谱柱(2.1×50mm, 3.5µm);流动相为 0.05%甲酸乙腈溶液(A)和 0.05%甲酸水溶液(B);采用梯度洗脱的方式:0~8min,A由 20%增加到85%;然后保持1min;9~10min,A由85%降回到20%.流速为0.4mL/min;柱温为30℃;进样体积为 20µL.质谱仪利用电喷雾电离(ESI)在正离子模式下进行扫描,所得的质谱数据通过Agilent MassHunter B.04.00专用软件进行分析.IL 1700型光辐射计(International Light公司)用于紫外光光强的测定.反应溶液pH值利用pH计(pH meter 245, Corning公司)进行测定.
2 结果与讨论
2.1 HCO3−和 NO3−对 DCF 紫外光解的影响
为了研究HCO3−和NO3−对DCF紫外光解的影响,分别向反应溶液中加入3mmol/L HCO3−和10mmol/L NO3−,结果如图1所示.为了避免pH值对 DCF降解的影响,同时进行 DCF在 UV/pH 8.5 buffer (pH 8.5磷酸盐缓冲液)中的光解作为控制实验.与控制体系 UV/pH 8.5 buffer相比,DCF在UV/3mmol/L HCO3−(两者pH值相同,均为 8.5)中的降解基本相同.该结果表明:HCO3−对 DCF的单独紫外光解几乎无影响.DCF在UV/10mmol/L NO3−/DI water (去离子水) (pH =5.7)中的去除明显快于控制体系 UV/DI water(pH = 6)的降解,NO3−的存在可以明显促进DCF的光解,可能是由于紫外光激发NO3−产生HO•的作用.有研究表明,HO•和DCF的二级反应速率常数为(9.29± 0.11)×109L/(mol·s)[21],故两者可以快速反应.与单独存在 HCO3−和 NO3−相比,HCO3−和 NO3−的共存可以进一步加快 DCF的降解,见图 1.为了确定是否为 pH值的影响,同时进行了一组控制实验,即DCF在UV/10mmol/L NO3−/pH 8.5 buffer中(两个反应体系 pH值均为 8.5)的降解,结果如图 1所示.DCF在 UV/10mmol/L NO3−/pH 8.5 buffer中的降解效率低于UV/10mmol/L NO3−/3mmol/L HCO3−中的去除,和在UV/10mmol/L NO3−/DI water中的降解基本类似,该结果排除了pH值影响的可能.因此,DCF在 UV/NO3−/HCO3−体系中降解的促进效应可能归因于生成的 HO•和 HCO3−反应产生的 CO3•−.
2.2 UV/NO3−/HCO3−体系中 CO3•−对 DCF 降解的证明
为了验证 UV/NO3−/HCO3−体系中 CO3•−对DCF的降解,向反应体系中加入 10mmol/L的甲醇(MeOH).甲醇是一种良好的 HO•淬灭剂,两者的二级反应速率常数为 9.7×108L/(mol·s)[14],但是甲醇和 CO3•−的二级反应速率常数小于2.6×103L/(mol·s)[22],故甲醇几乎不与 CO3•−反应.同时,进行了一组控制实验,即向 UV/NO3−/pH 8.5 buffer体系中加入 HO•淬灭剂甲醇,结果如图2所示.DCF在 UV/NO3−/pH 8.5buffer/MeOH 和UV/pH 8.5 buffer两个体系中的降解基本相同,这一结果表明:10mmol/L MeOH几乎可以完全淬灭 UV/NO3−/pH 8.5 buffer体系中产生的 HO•.与UV/NO3−/HCO3−体系相比,DCF 在 UV/NO3−/HCO3−/MeOH 中的降解受到抑制,这可能是由于UV/NO3−/HCO3−体系中 MeOH 的存在淬灭了部分HO•导致DCF在该体系中降解效率的降低.在UV/NO3−/HCO3−/MeOH 体系中,HCO3−可以与MeOH竞争反应体系中的HO•分别产生CO3•−和有机物自由基,但是相比于 CO3•−,有机物自由基的活性较弱,基本不与有机物反应.因此,与控制体系UV/NO3−/pH 8.5 buffer/MeOH相比,DCF在UV/NO3−/HCO3−/MeOH 中去除的促进效应可能是由于生成的 CO3•−和 DCF反应造成的.该结果有力地证明了UV/NO3−/HCO3−体系中CO3•−的存在及其对DCF的降解.
在 UV/NO3−/HCO3−体系中, 可以生成 HO•和CO3•−,这两种自由基均可以与DCF发生反应.因此,DCF在UV/NO3−/HCO3−中的去除可能归因于3种反应途径,即DCF直接紫外光解、HO•氧化和 CO3•−氧化.DCF 在 UV/pH 8.5 buffer和UV/10mmol/L NO3−/3mmol/L HCO3−中的降解遵循准一级反应动力学,故DCF在这两个反应体系中的表观速率常数可以根据式(1)计算求得,分别为(5.96±0.03)×10−3和(2.38±0.08)×10−2cm2/mJ.因此,在 UV/10mmol/L NO3−/3mmol/L HCO3−体系中,直接紫外光解和自由基氧化(包括HO•氧化和CO3•−氧化)对 DCF去除的贡献分别为 25%和75%[23],具体 HO•氧化和 CO3•−氧化对 DCF 去除的贡献无法进一步确定.


图 2 UV/NO3−/HCO3−体系中 CO3•−降解 DCF 的证明Fig.2 Confirmation of DCF degradation by CO3•− in UV/NO3−/HCO3− system
2.3 UV/NO3−/HCO3−体系中 NO3−和 HCO3−用量对DCF降解的影响
上述研究发现NO3−和HCO3−的共存可以加快 DCF的光解,分析证明是由于生成的 CO3•−的作用.为了研究 UV/NO3−/HCO3−体系中 NO3−用量对 DCF光解的影响,分别向反应体系中加入5、10 和 20mmol/L 的 NO3−,结果如图 3所示.随着 NO3−浓度的提高,DCF的降解效率逐渐提高,这可能是由于 NO3−用量的提高导致了体系中生成的HO•稳态浓度的提高,从而加快了DCF的去除.邱慧敏等[24]在研究水中亚磷酸盐光氧化时也发现 NO3−浓度的提高可以促进亚磷酸盐的光氧化速率.类似的现象在展漫军等[25]研究双酚A在NO3−溶液中的光解时也有发现.

图 3 UV/NO3−/HCO3−体系中 NO3−用量对 DCF 降解的影响Fig.3 The effect of NO3− dose on DCF degradation in UV/NO3−/HCO3− system

图 4 UV/NO3−/HCO3−体系中 HCO3−用量对 DCF 降解的影响Fig.4 The effect of HCO3− dose on DCF degradation in UV/NO3−/HCO3− system
图 4 为 UV/NO3−/HCO3−体系中 HCO3−用量对 DCF降解的影响,HCO3−浓度的提高对 DCF光解的促进作用较小.这可能是因为 UV/NO3−/HCO3−体系中NO3−的用量一定,故体系中产生的HO•稳态浓度一定,该浓度可能远低于实验所用的 HCO3−的浓度,因此,即使增加 HCO3−的用量,体系中生成的 CO3•−稳态浓度可能变化不大,故UV/NO3−/HCO3−体系中 HCO3−用量的变化对DCF的降解影响较小.
2.4 DCF 在 UV/NO3−/HCO3−体系中的降解产物和反应机理
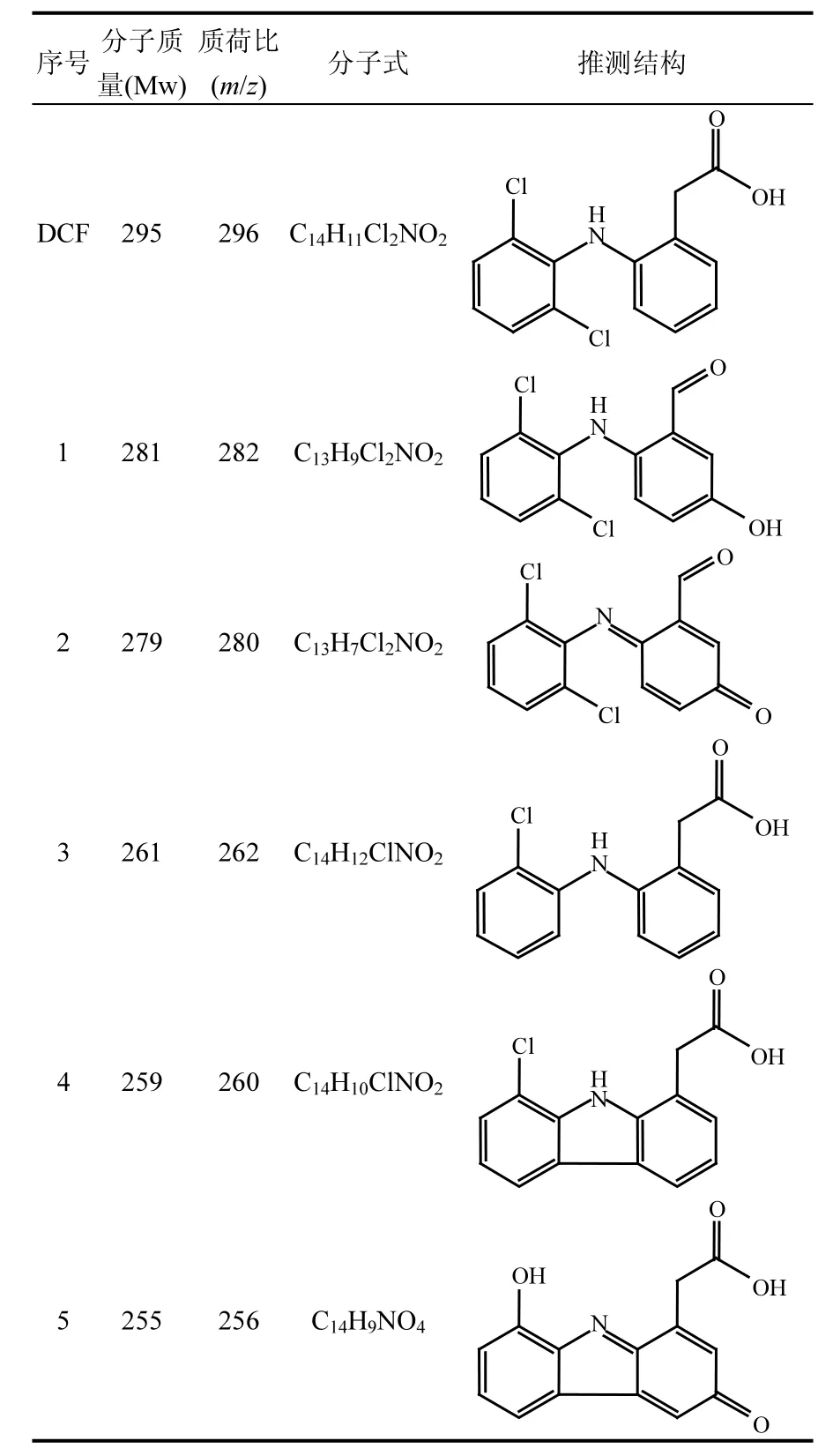
表1 UV/NO3−/HCO3−体系中DCF的降解产物Table 1 Degradation products of DCF in UV/NO3−/HCO3− system

续表1
DCF 在 UV/NO3−/HCO3−体系中的降解产物通过液相色谱——四级杆飞行时间串联质谱仪(LC-QTOF/MS)进行检测和鉴定.为了提高反应产物的浓度,使用初始浓度为 10µmol/L的 DCF.在 UV/NO3−/HCO3−降解 DCF 反应中,共检测到11种转化产物,它们的分子质量(Mw)、质荷比(m/z)、分子式和可能的结构如表1所示.图5为这些降解产物的浓度随时间的变化.因为缺少这些反应产物的标准物,故不能对它们的浓度进行定量,因此本研究直接利用它们的峰体积(从质谱分析软件MassHunter B.04.00获得)来代表它们在反应体系中浓度的变化.从图5可以看出,产物m/z 260、256、252、226、216和212相对浓度较高,为反应过程中的主要产物.基于这些检出的转化产物,提出DCF在UV/NO3−/HCO3−体系中的反应机理主要包括 5种不同的降解路径,分别为:(1)脱氯氢化、(2)脱氯环化、(3)脱羧基反应、(4)甲酰化反应、(5)醌化反应,如图 6所示.DCF通过脱氯氢化、脱氯环化、脱羧基反应和甲酰化反应分别生成产物m/z 262、260、252和282.生成的 m/z 262通过路径(1)可以转化为产物 m/z 228,紧接着通过甲酰化反应可以进一步转化为产物m/z 198.产物m/z 260通过脱氯氢化和脱羧基反应可以分别生成产物m/z 226和216,生成的m/z 226通过醌化反应可以转化为产物m/z 256,紧接着通过路径(3)可以进一步生成产物 m/z 212.m/z 216除了由m/z 260通过反应(3)生成,还可以由生成的 m/z 252通过路径(2)转化得到.产物 m/z 282通过路径(5)可以生成产物 m/z 280.Lekkerkerker-Teunissen等[20]在 UV 和 UV/H2O2降解DCF的反应中检测到相同的5种反应产物,分别为 m/z 260、256、242、216 和 212.除了产物m/z 242 (C14H11NO3),其它转化产物在本研究中均被检出.
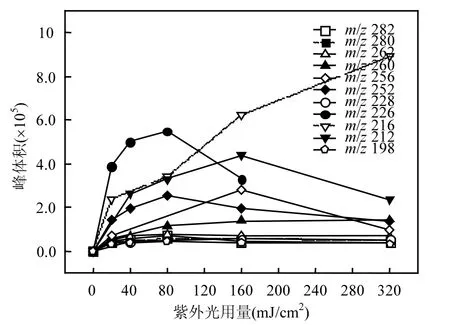
图5 DCF降解产物随时间的变化Fig. 5 Evolution of the degradation products of DCF in UV/NO3−/HCO3− system
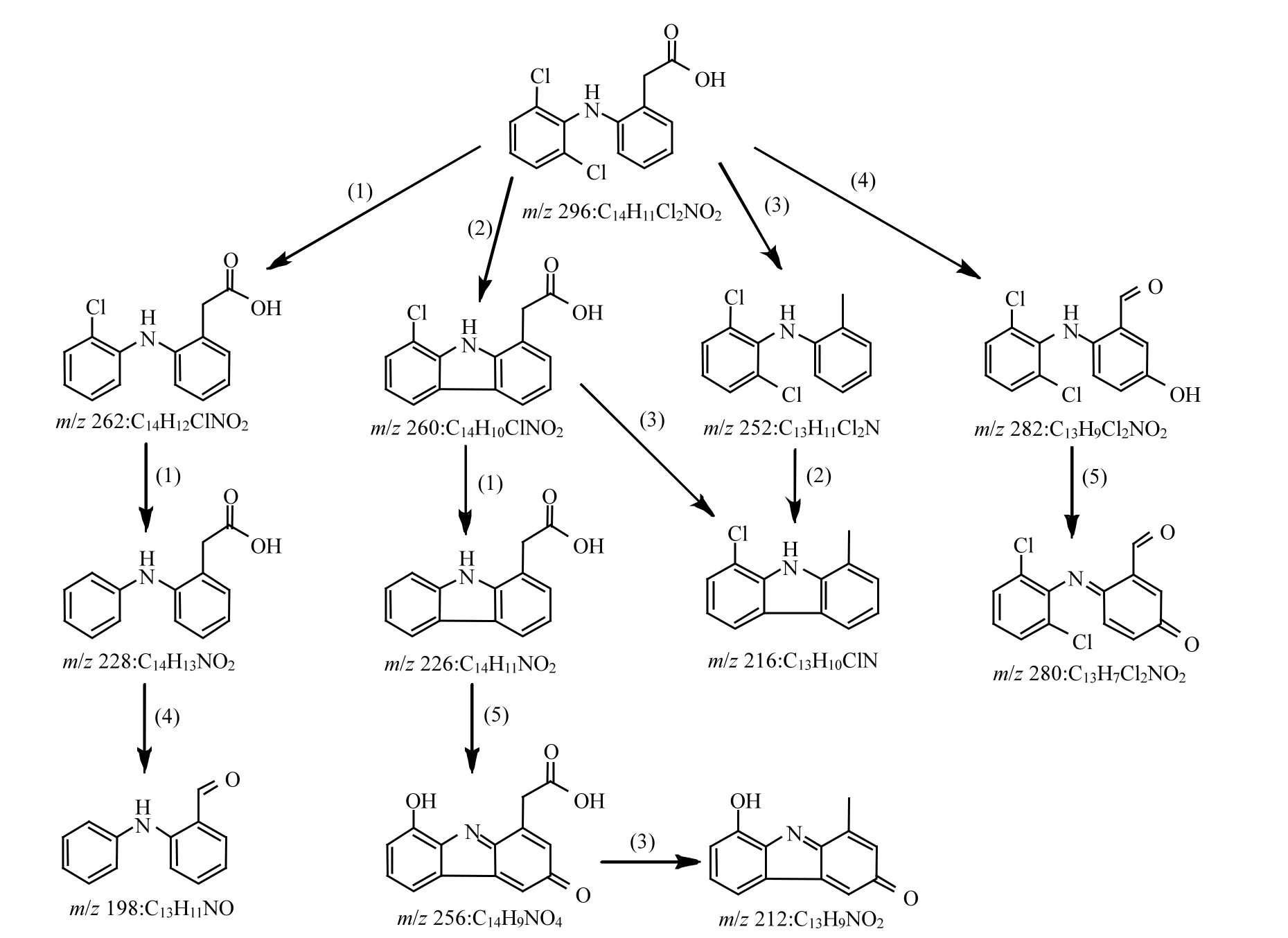
图6 DCF在UV/NO3−/HCO3−体系中可能的降解路径Fig.6 Possible degradation pathways of DCF in UV/NO3−/HCO3− system
3 结论
3.1 单独HCO3−的存在对DCF的紫外光解几乎无影响;单独 NO3−的存在可以明显加快 DCF的光解;HCO3−和NO3−的共存可以进一步促进DCF的去除,这可能归因于生成的 HO•和 HCO3−反应产生的 CO3•−.
3.2 通过向 UV/NO3−/HCO3−体系中加入 HO•淬灭剂甲醇证明了该体系中 CO3•−的存在及其对DCF的降解;DCF在 UV/10mmol/L NO3−/3mmol/L HCO3−中的降解归因于 3种反应途径,分别为DCF直接紫外光解、HO•氧化和CO3•−氧化,直接紫外光解和自由基氧化对DCF去除的贡献分别为25%和75%.
3.3 在UV/NO3−/HCO3−体系中,DCF 的降解效率随着NO3−用量的提高而逐渐增大,这可能是由于NO3−浓度的提高导致了体系中生成的 HO•稳态浓度的提高;HCO3−用量的提高对DCF去除的影响较小.
3.4 在 UV/NO3−/HCO3−降解 DCF 反应中,共检出11种反应产物,根据这些检出的降解产物提出DCF在该体系中的反应机理主要包括5种不同的转化路径,分别为脱氯氢化、脱氯环化、脱羧基反应、甲酰化反应和醌化反应.
参考文献:
[1]Halling-Sorensen B, Nors Nielsen S, Lanzky P F, et al.Occurrence, fate and effects of pharmaceutical substances in the environment–a review [J]. Chemosphere, 1998,36(2):357-393.
[2]Daughton C G, Ternes T A. Pharmaceuticals and personal care products in the environment: agents of subtle change? [J]. Environmental Health Perspectives, 1999,107(Supplement 6):907-938.
[3]Perez-Estrada L A, Malato S, Gernjak W, et al. Photo-Fenton degradation of diclofenac: identification of main intermediates and degradation pathway [J]. Environmental Science &Technology, 2005,39(21):8300-8306.
[4]Zhang Y, Geiβen S U, Gal C. Carbamazepine and diclofenac:Removal in wastewater treatment plants and occurrence in water bodies [J]. Chemosphere, 2008,73(8):1151-1161.
[5]史 瑞,张付申.碱催化水热氧化法处理废弃双氯芬酸钠类药物[J]. 中国环境科学, 2017,37(4):1386-1393.
[6]Vieno N M, Harkki H, Tuhkanen T, et al. Occurrence of pharmaceuticals in river water and their elimination in a pilot-scale drinking water treatment plant [J]. Environmental Science & Technology, 2007,41(14):5077-5084.
[7]王 月,熊振湖,周建国.杯[4]芳烃修饰 Amberlite XAD-4树脂去除水中双氯芬酸 [J]. 中国环境科学, 2012,32(1):81-88.
[8]于万禄,熊振湖,马华继.Photo-Fenton法降解水中新型污染物双氯芬酸及降解产物的毒性评价 [J]. 环境科学学报, 2009,29(10):2070-2075.
[9]Letzel M, Metzner G, Letzel T. Exposure assessment of the pharmaceutical diclofenac based on long-term measurements of the aquatic input [J]. Environment International, 2009,35(2):363-368.
[10]张 楠,刘国光,刘海津,等.双氯芬酸在水环境中光降解的初步研究 [J]. 环境化学, 2013,32(1):42-47.
[11]Buser H R, Poiger T, Muller M D. Occurrence and fate of the pharmaceutical drug diclofenac in surface waters: rapid photodegradation in a lake [J]. Environmental Science &Technology, 1998,32(22):3449-3456.
[12]Chen Y, Hu C, Hu X X, et al. Indirect photodegradation of amine drugs in aqueous solution under simulated sunlight [J].Environmental Science & Technology, 2009,43(8):2760-2765.
[13]Keen O S, Love N G, Linden K G. The role of effluent nitrate in trace organic chemical oxidation during UV disinfection [J].Water Research, 2012,46(16):5224-5234.
[14]Buxton G V, Greenstock C L, Helman W P. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (•OH/•O−) in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1988,17(2):513-886.
[15]Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1988,17(3):1027-1284.
[16]Canonica S, Kohn T, Mac M, et al. Photosensitizer method to determine rate constants for the reaction of carbonate radical with organic compounds[J]. Environmental Science & Technology, 2005,39(23):9182-9188.
[17]Wu C, Linden K G. Phototransformation of selected organophosphorus pesticides: roles of hydroxyl and carbonate radicals [J]. Water Research, 2010,44(12):3585-3594.
[18]Liu Y, He X, Duan X, et al. Significant role of UV and carbonate radical on the degradation of oxytetracycline in UV-AOPs:Kinetics and mechanism [J]. Water Research, 2016,95:195-204.
[19]Kim I, Tanaka H. Photodegradation characteristics of PPCPs in water with UV treatment [J]. Environment International, 2009,35(5):793-802.
[20]Lekkerkerker-Teunissen K, Benotti M J, Snyder S A, et al.Transformation of atrazine, carbamazepine, diclofenac and sulfamethoxazole by low and medium pressure UV and UV/H2O2treatment [J]. Separation and Purification Technology, 2012,96:33-43.
[21]Yu H, Nie E, Xu J, et al. Degradation of diclofenac by advanced oxidation and reduction processes: kinetics studies, degradation pathways and toxicity assessments [J]. Water Research, 2013,47(5):1909-1918.
[22]Chen S N, Cope V W, Hoffman M Z. Behavior of CO3•−radicals generated in the flash photolysis of carbonatoamine complexes of cobalt (III) in aqueous solution [J]. The Journal of Physical Chemistry, 1973,77(9):1111-1116.
[23]Kim I, Yamashita N, Tanaka H. Photodegradation of pharmaceuticals and personal care products during UV and UV/H2O2treatments [J]. Chemosphere, 2009,77(4):518-525.
[24]邱慧敏,耿金菊,韩 超.亚磷酸盐在硝酸根溶液中的光氧化过程及影响因素 [J]. 中国环境科学, 2016,36(5):1442-1448.
[25]展漫军,杨 曦,鲜啟鸣.双酚A在硝酸根溶液中的光解研究 [J].中国环境科学, 2005,25(4):487-490.

