盐胁迫对13种芍药品种部分生理指标的影响研究
蒋昌华,叶 康,高 燕,宋 垚,莫健彬,赵广琦,奉树成*
(1.上海植物园,上海 200231;2.上海城市植物资源开发应用工程技术研究中心,上海 200231)
芍药(Paeonialactiflora)为芍药科(Paeoniaceae)芍药属(Paeonia)的多年生宿根草本花卉,被誉为“花中之相”,与牡丹尊称“花中二绝”,素有“绰约之花”的美名,象征着繁荣富强和美满幸福,多年来一直作为我国的传统名花被广为栽培。中国是世界芍药野生种的原产中心和分布中心,也是世界芍药园艺品种的栽培中心[1]。以北京林业大学等为代表的一些科研院所也曾经或正在围绕芍药引种、新品种选育等方面开展了研究。上海地区自然环境特殊,存在地下水位高、土壤含盐量高、高温高湿的特点。尽管芍药的适应性较强,在上海的园林绿化中也有应用,但品种较少,尤其在崇明、金山等沿海区县几乎没有应用。因此,筛选耐盐芍药品种并在上海地区加以应用的研究就显得尤为重要。目前,芍药的耐盐相关方面研究尚未见报道。因此,耐盐芍药品种在上海具有很大的开发应用潜力。
1 材料与方法
试验材料取自上海植物园,从田间适应性较强的2年生芍药品种中选取13个耐盐性能差异较大的品种,上盆浇透水置于露天阳台(室外气温25℃)恢复1周后用于后续试验。
1.1 盐胁迫处理
将上盆恢复1周后的盆苗以芍药品种耐受的最高盐浓度800 mM NaCl溶液[2]倒灌至盆土完全湿透,24 h后剪取其成熟度相当的叶片用作后续试验。盐胁迫处理10 d后观察其形态表现。
1.2 生理指标检测
1.2.1 叶片相对电导率检测 将叶片均匀剪碎(不取中脉),称取0.2 g碎叶片置于有盖子的试管中,加入10 mL去离子水,虚掩盖子,真空机抽气15 min,室温下静置30 min(期间轻摇1次)后用DDS-11A型电导率仪测得电导值。沸水中水浴10 min,取出后于冷水中水浴冷却至室温,轻摇后测得绝对电导值,并计算相对电导率,以每克鲜重占有的相对电导率表示电导值(单位:%/g FW)[3]。
1.2.2 叶片相对含水量检测 称取0.2 g碎叶片置于小型称量瓶中,于干燥烘箱中杀青30 min(105℃),然后调至80℃烘至恒重,取出后在干燥器中冷却至室温,称其干重,计算相对含水量,以每克鲜重占有的相对含水量表示[3]。
1.2.3 叶片可溶性蛋白含量检测 称取0.2 g碎叶片,加入1 mL蒸溜水,少许石英砂,冰浴中充分研磨后再加1 mL蒸溜水洗涤。4℃,27 000×g离心20 min,吸取上清液,备用。考马斯亮兰染色法测定蛋白含量,对照Bradford法制定的蛋白质标准曲线确定样品浓度[3]。
1.2.4 叶片游离脯氨酸含量检测 参照张殿忠[4]等(1990)方法。称取样品0.5 g,用5 mL 3%(w/v)磺基水杨酸溶液充分碾磨提取,沸水中水浴10 min,3 000 r·min离心10 min,吸取2 mL上清液与2.5%酸性茚三酮共煮沸60 min,冷却后用甲苯萃取红色物质,于520 nm波长下比色,根据标准曲线计算脯氨酸含量。
1.2.5 叶片丙二醛含量检测 参照G.Hendry等(1993)的方法提取和测定MDA的含量。0.5 mL提取液,3 mL 0.5%硫代巴比妥酸,煮沸15 min,迅速冷却,1 800×g离心10 min后,测定534 nm和600 nm的光密度值。用标准MDA溶液作工作曲线,计算样品中的MDA含量。蛋白质含量的测定按Bradford(1976)方法,以牛血清白蛋白为标准[5]。
上述生理指标测定均重复3次。
2 结果与分析
2.1 芍药品种耐盐形态指标
13个芍药品种经800 mmol·L-1NaCl溶液胁迫处理10 d后,品种间的形态表现存在明显差异,其中品种4、6、7、9仍然表现良好,而其他品种有较严重萎蔫甚至死亡(表1、图1)。表明品种4、6、7、9强耐盐,品种1、5、10、13有一定的耐盐性,而品种2、3、8、11、12耐盐性差。
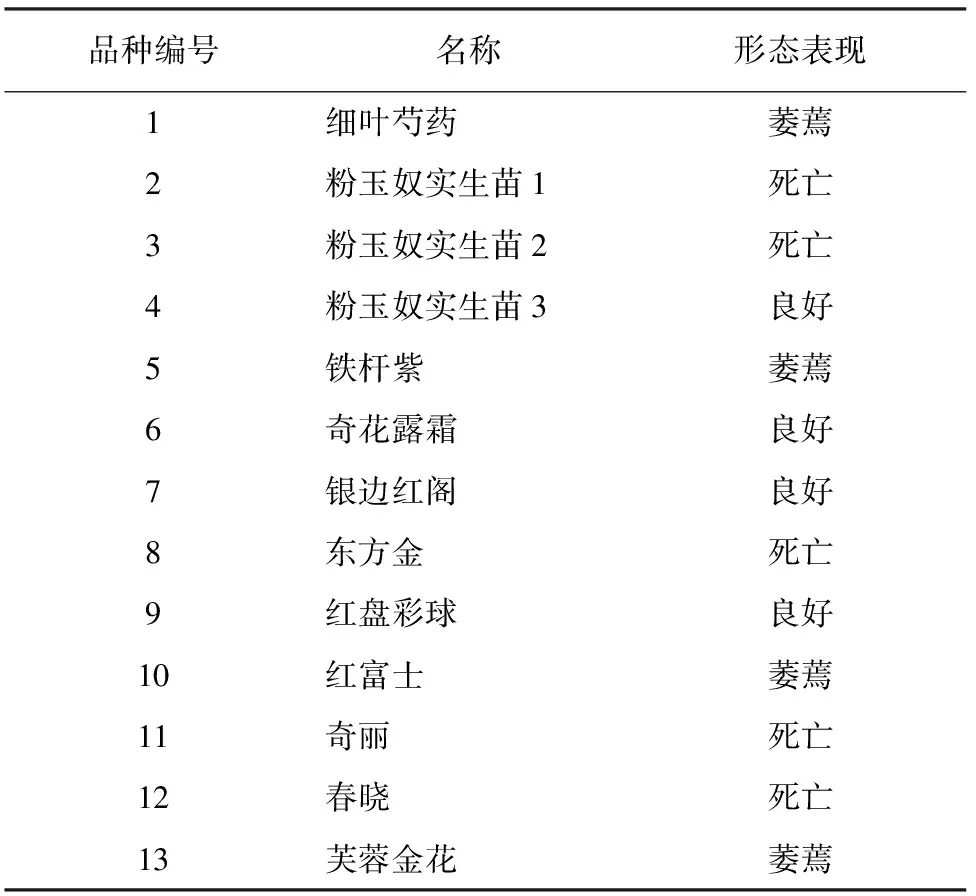
表1 芍药品种盐胁迫后形态表现
2.2 叶片相对含水量检测
叶片相对含水量与芍药品种的耐盐性直接相关,耐盐性强的品种叶片保水能力强,在高盐处理后,其叶片相对含水量略有上升,而耐盐性差的品种,其叶片的相对含水量下降明显。表2表明,品种4、6、7、9号耐盐性明显高于其他品种。
2.3 叶片相对电导率检测
高盐胁迫引起细胞膜损伤,质膜透性增大,细胞内原生质外渗,导致电导率上升[6],电导率与芍药品种耐盐性呈负相关。表3显示,不耐盐品种经高盐胁迫后其电导率上升值明显高于4个耐盐品种,电导率可以用于说明芍药品种的耐盐性。
2.4 叶片可溶性蛋白含量检测
高盐胁迫下植物可溶性蛋白含量与植物的耐盐性相关,强耐盐品种可溶性蛋白含量略有增加,不耐盐品种可溶性蛋白含量有所下降[6],可溶性蛋白含量与芍药品种耐盐性一致,可作为芍药耐盐性鉴定指标之一。表4显示,品种4、6、7、9号叶片可溶性蛋白含量明显高于其他不耐盐品种。

图1 芍药品种盐胁迫后形态表现
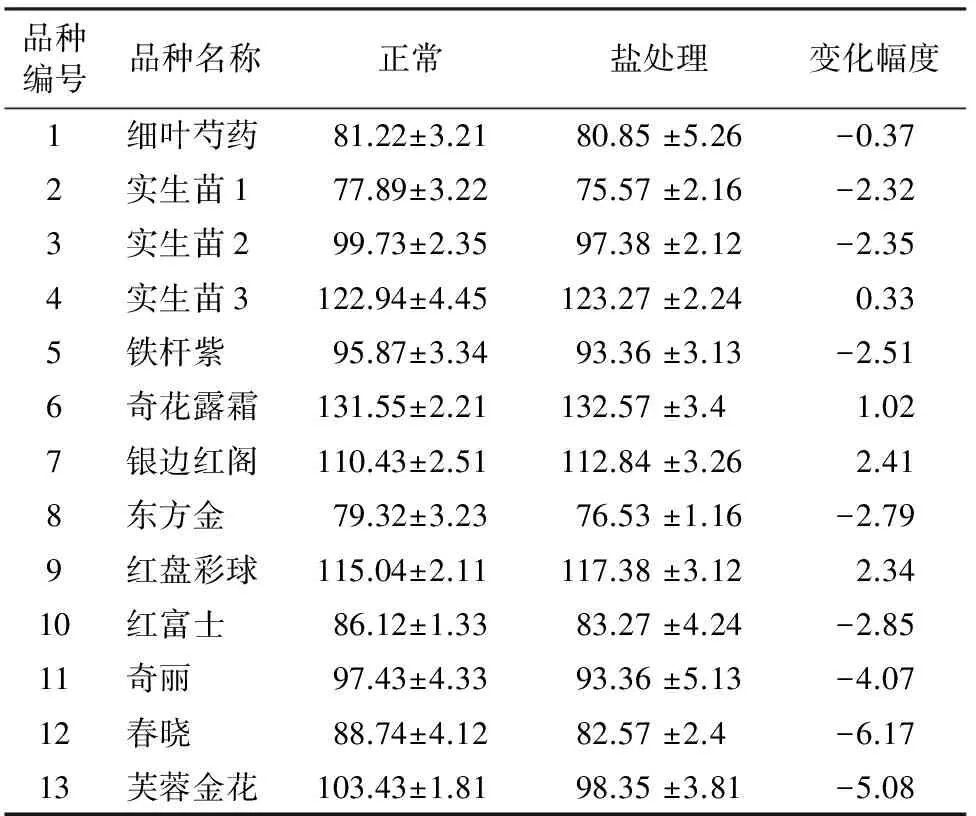
品种编号品种名称正常盐处理变化幅度1细叶芍药81.22±3.2180.85±5.26-0.372实生苗177.89±3.2275.57±2.16-2.323实生苗299.73±2.3597.38±2.12-2.354实生苗3122.94±4.45123.27±2.240.335铁杆紫95.87±3.3493.36±3.13-2.516奇花露霜131.55±2.21132.57±3.41.027银边红阁110.43±2.51112.84±3.262.418东方金79.32±3.2376.53±1.16-2.799红盘彩球115.04±2.11117.38±3.122.3410红富士86.12±1.3383.27±4.24-2.8511奇丽97.43±4.3393.36±5.13-4.0712春晓88.74±4.1282.57±2.4-6.1713芙蓉金花103.43±1.8198.35±3.81-5.08
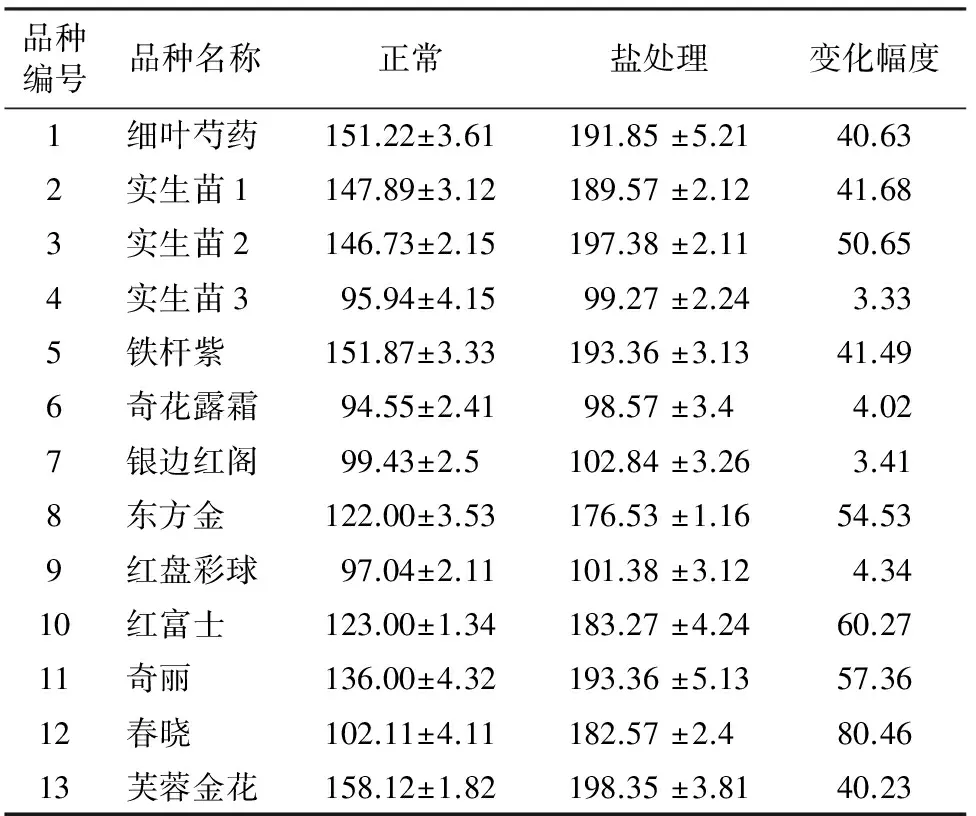
表3 相对电导率的变化
2.5 叶片游离脯氨酸含量检测
表5显示,耐盐品种(品种4、6、7、9)脯氨酸含量增幅明显大于不耐盐品种,因此脯氨酸含量变化是芍药品种耐盐性检测的理想指标之一。
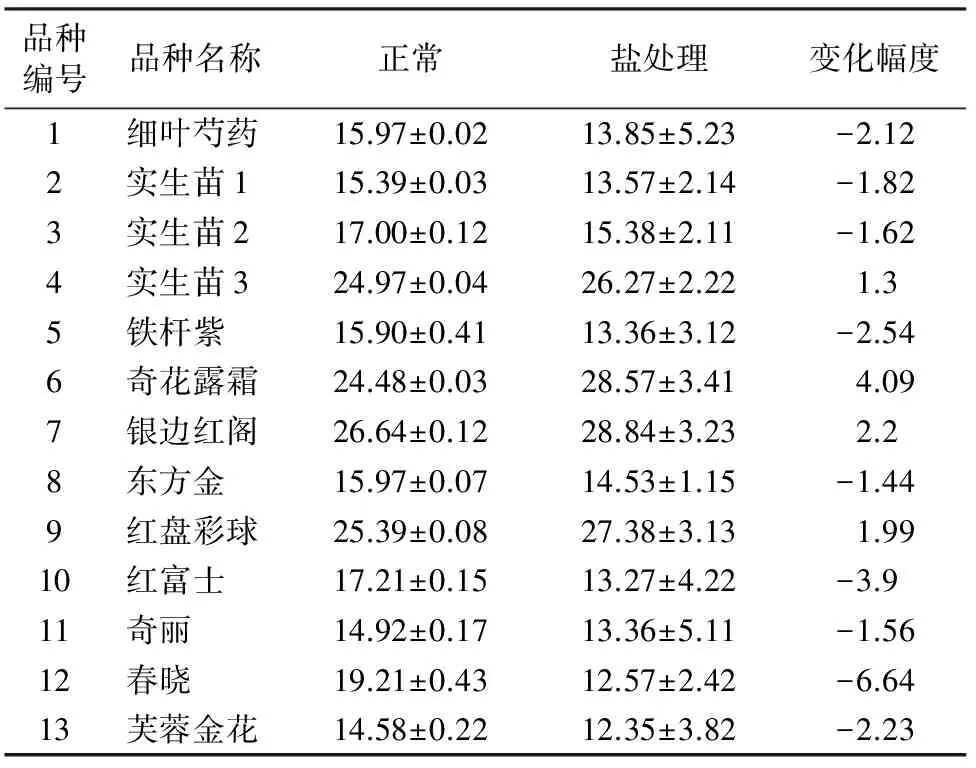
表4 可溶性蛋白含量的变化
2.6 叶片丙二醛(MDA)含量检测
表6显示,在高盐胁迫条件下,耐盐芍药品种MDA含量明显比不耐盐品种低,甚至略有下降,而不耐盐品种的MDA含量上升较为明显。
上述储多生理指标均与芍药品种耐盐性直接相关,根据上述生理指标的变化幅度判断,13种芍药品种中,有4、6、7、9号4个品种耐盐性能佳。
2.7 5个生理指标变化幅度的检测结果主成分分析
对5个生理指标变化幅度的检测结果进行主成分分析(表7)。13个芍药品种的5个指标相关性高,只有1个主成分(表8)。
主成分表达式:
F=0.902×相对含水率-0.973×相对电导率+0.962×可溶性蛋白+0.896×游离脯氨酸-0.921×丙二醛。
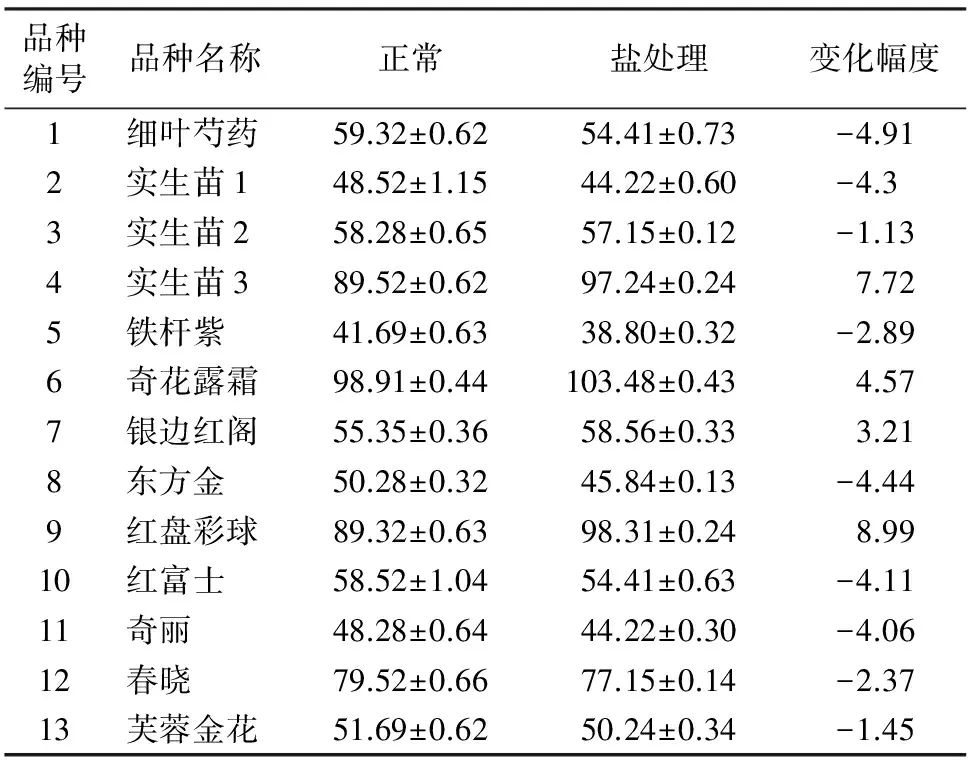
表5 游离脯氨酸含量的变化
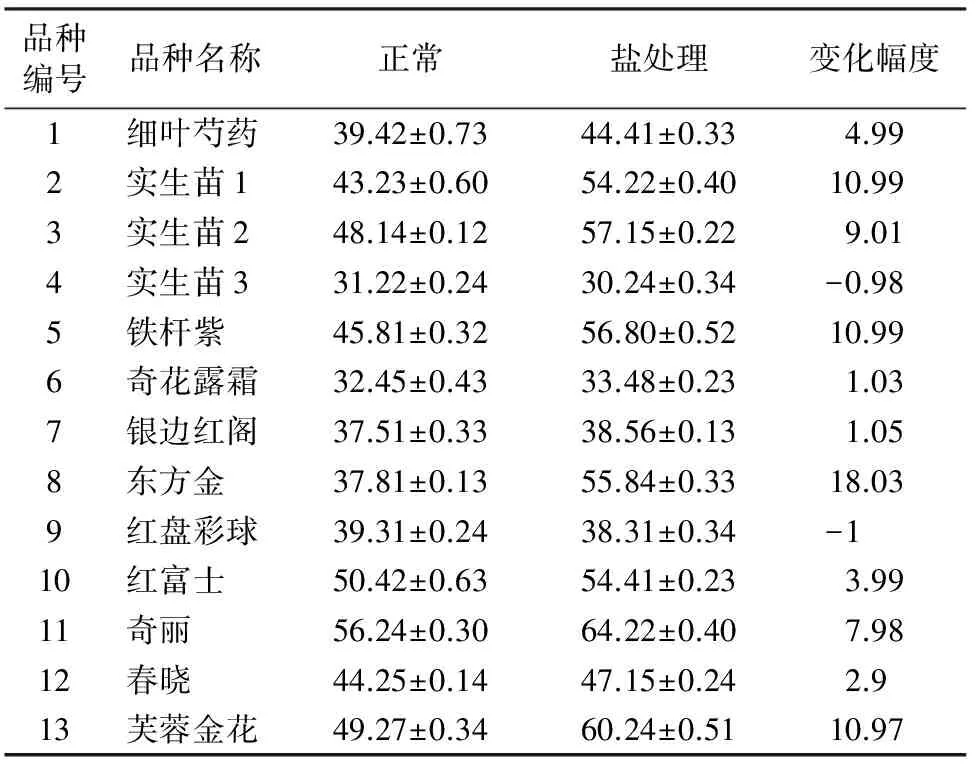
表6 丙二醛(MDA)含量的变化
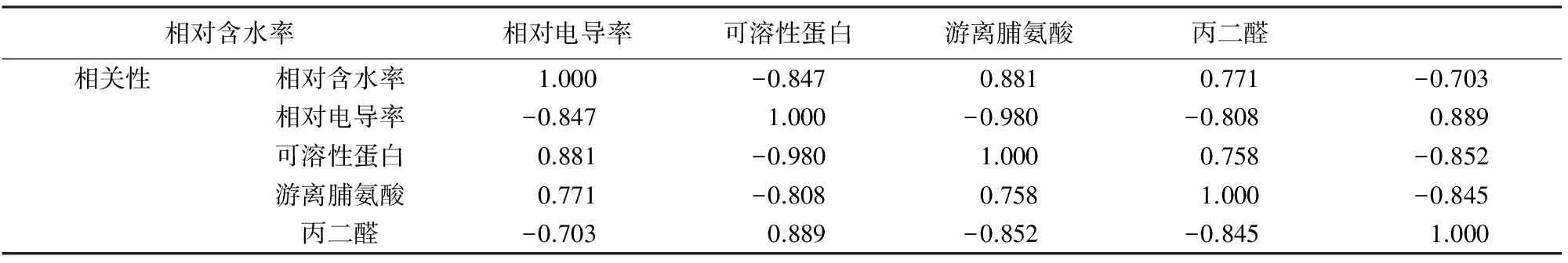
表7 5个指标的相关性
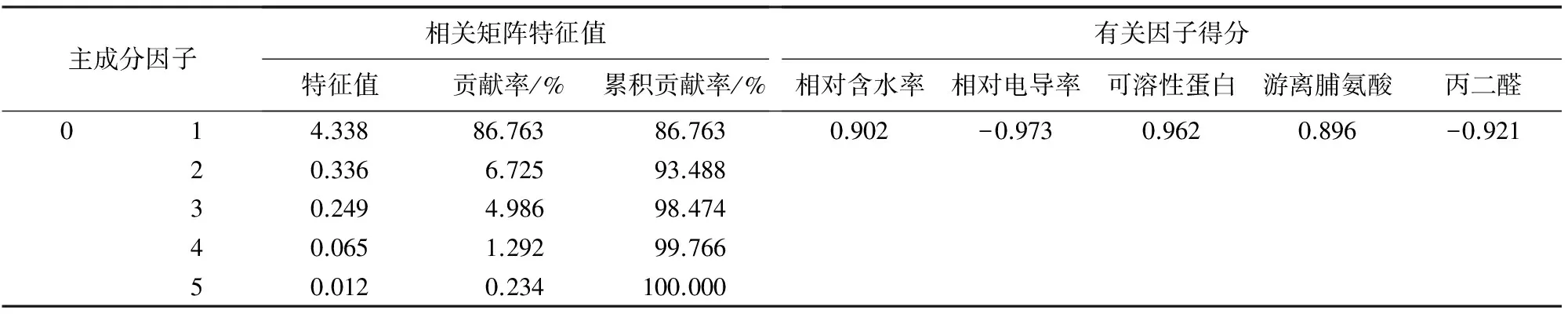
表8 总方差分解及有关因子得分系数
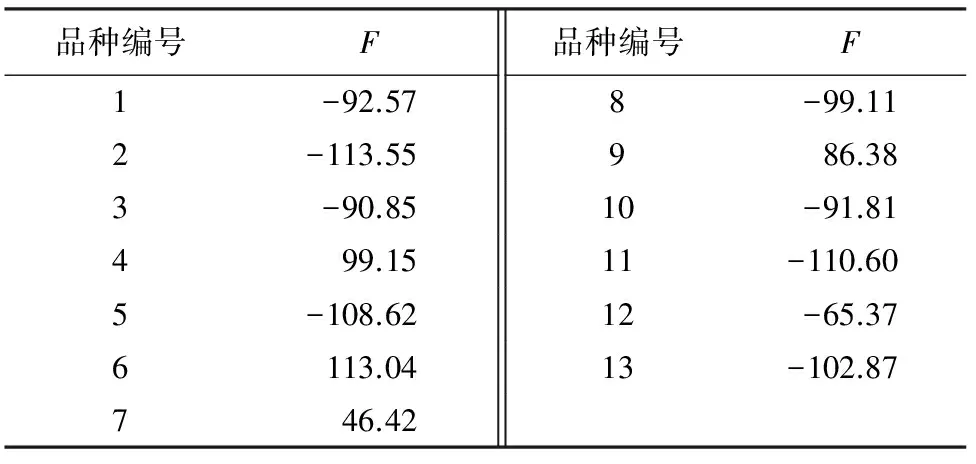
表9 13个芍药品种的1个因子得分新变量
通过聚类分析,将13个芍药品种分成了2类,耐盐的有品种4、6、7、9,不耐盐的有品种1、2、3、5、8、10、11、12、13(图2)。
上述诸多生理指标均与芍药品种耐盐性直接相关,根据上述生理指标的变化幅度以及主成分分析结果判断,13个芍药品种中,有4、6、7、9号4个品种耐盐性能佳。

图2 13个芍药品种聚类图
3 结论与讨论
植物在高盐胁迫条件下,叶片持水能力下降,水份流失。耐盐性强的品种,其叶片保水能力较强,表现在叶片的含水量略有上升,而耐盐性差的品种叶片失水更为严重,叶片含水量下降[6]。在该试验中,品种‘银边红阁’(品种编号7)含水量上升最大,在形态上也表现出强的耐盐性。品种1、5、10、13叶片相对含水量略有下降,形态上表现出萎蔫较严重,而品种2、3、8、11、12均不耐盐,含水量下降,形态上表现为死亡。由于本试验盐胁迫浓度高,随着胁迫时间的延长,芍药品种叶片失水非常严重,致使不耐盐品种严重萎蔫甚至整株死亡,这也表明叶片相对含水量的变化与芍药品种的耐盐性相关。
高盐胁迫后,细胞膜受损,其选择性半透膜功能部分丧失,细胞内电解质外渗,引起电导率上升。细胞电解质渗透率直接反映细胞受盐害程度及细胞膜的稳定性,叶片电导率变化可以作为判断植物耐盐性高低的一种手段[6]。在本试验中,通过该指标测定得出耐盐性强的品种为实生苗3(品种编号4)、‘奇花露霜’(品种编号6)、‘银边红阁’(品种编号7)、‘红盘彩球’(品种编号9),与它们在盐胁迫10天后的形态表现基本吻合。
可溶性蛋白是植物细胞内重要的渗透调节物质,对细胞膜的结构与功能具有保护和稳定的作用[7-8]。盐胁迫条件下正常蛋白合成受阻,蛋白的加剧分解是造成膜完整性破坏导致电解质渗漏及植物盐伤害的原因之一[9]。耐盐品种可溶性蛋白含量在盐胁迫后略有增加,不耐热品种则表现为下降。可见,可溶性蛋白含量的变化与芍药品种耐盐性能有相关性。
游离脯氨酸是细胞内主要起渗透调节作用的物质之一,正常情况下,植物体内的脯氨酸含量很低,但当其处于逆境时其含量可急剧增加。在高盐胁迫下,耐盐品种的脯氨酸含量迅速增加,增强了细胞的抗脱水力,盐胁迫下游离脯氨酸含量增加是个极灵敏的指标[10-11]。
丙二醛(MDA)是脂质过氧化的主要产物之一,其含量可反映脂质过氧化的程度,细胞膜脂过氧化越严重其过氧化产物丙二醛(MDA)含量就越高,而且MDA本身对植物细胞具有明显的毒害作用[10-11]。耐盐性强的芍药品种MDA含量低,耐盐性弱的品种膜脂过氧化作用强,MDA含量则高。MDA含量与芍药品种耐盐性强弱呈负相关。
已有研究发现,植物的茎叶部对盐碱胁迫的敏感性较强,因此叶片的生长状况可作为判断植物受盐碱胁迫程度的指标[5]。
上述生理指标在正常与盐胁迫过程中的变化趋势与芍药品种耐盐性相一致,也与芍药品种经盐胁迫后的形态表现基本吻合,可作为芍药品种耐盐性筛选指标,本研究结果也可作为其他园林植物耐盐筛选指标,为园林植物耐盐筛选生理指标体系的建立奠定了基础。
参考文献:
[1] 王建国,张佐双.中国芍药[M].北京:中国林业出版社,2005.
[2] 成明亮,吕长平,莫宁捷,等.芍药的研究进展[J].林业调查规划,2007,32(3):44-49.
CHENG M L,LV C P,MO N J,etal.Research progress ofPaeonialactiflor[J].Research Progress of Paeonia lactiflor,2007,32(3):44-49.(in Chinese)
[3] 上海市植物生理学会.现代植物生理学实验指导指南 [M].北京:科学出版社,1999:12-14,16-18.
[4] 张殿忠,汪沛洪,赵会贤.测定小麦叶片游离氨基酸含量的方法[J].植物生理学通讯,1990 (4) :62-65.
ZHANG D Z,WANG P H,ZHANG H X.The method of determination for the content of free amino acid in wheat leaves[J].Plant Physiology Communications,1990(4):62-65.(in Chinese)
[5] 王琪, 袁燕波 ,于晓南.盐碱胁迫下2个芍药品种生理特性及耐盐碱性研究[J].河北农业大学学报,2013,36(6):52-60.
WANG Q,YUAN Y B,YU X N.Study on physiological characteristics and saline-alkali tolerance for two cultivars of herbaceous peony[J].Journal of Agricultural University of Hebei,2013,36(6):52-60.(in Chinese)
[6] HENDRY G A,GRIME J P.(eds).Methods in Comparative[M]//Plant Ecology.London:Chapman &Hall,1993:154-156.
[7] ASHRAF M,FOOLAD M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance [J].Environmental and Experimental Botany,2007,59:206-216.
[8] 黄增艳,蒋昌华.热激对荚蒾品种部分生理指标的影响研究[J].西北林学院学报, 2017,32(2):97-100.
HUANG Z Y,JIANG C H.Research on effect of high temperature on physiological indexes of varieties in viburnum[J].Journal of Northwest Forestry University,2017,32(2):97-100.(in Chinese)
[9] 汤章城.不同抗旱品种高温苗中脯氨酸积累的差异[J].植物生理学报,1986,12(2):154-162.
[10] 蒋昌华,胡永红,秦俊,等.高温胁迫对月季品种部分生理指标的影响研究[J].种子,2008,27(6):31-34.
JIANG C H,HU Y H,QIN J,etal.Research in effect of high temperature on physiological indexes of varieties in China Rose[J].Seed,2008,27(6):31-34.(in Chinese)
[11] 徐琼,师桂英,贺新红,等.低温处理对观赏百合种球碳水化合物及蛋白质代谢的影响[J].甘肃农业大学学报,2010,45(3):74-80.
XU Q,SHI G Y,HE X H,etal.Carbohydrate and protein metabolism of lily bulb at low-temperature storage[J].Journal of Gansu Agricultural University,2010,45(3):74-80.(in Chinese)

