缺镁对杉木根系活力及抗氧化酶活性影响研究
汪凤林,马志慧,叶义全,黄田盛,王 飞,曹光球*
(1.福建农林大学 林学院,福建 福州 350002;2.国家林业局 杉木工程技术研究中心,福建 福州 350002;3.福建农林大学 资源与环境学院,福建 福州 350002)
镁是植物生长和发育过程中所必需的大量营养元素[1],是构成植物体内叶绿素的主要成分之一,能直接参与植物的光合作用[2]。同时,镁对植物体内的酶活性、活性氧代谢以及脂肪代谢等方面均有重要影响[3]。我国镁资源较为丰富,但土壤中缺镁严重[4],特别在我国南方地区,伴随着酸沉降的加重土壤中镁不断风化、淋失,土壤供镁能力下降,从而影响植物的生长和发育,限制植物的产量和品质[5]。目前,国内外对植物镁元素的研究逐渐增多,主要侧重于镁对光合作用以及碳水化合物的合成等方面[6],且多为大豆(Glycinemax)[7]、黄瓜(Cucumissativus)[8]、厚皮甜瓜(Cucumismelovar.cantaloupensis)[9]、龙眼(Dimocarpuslongan)[10]、柑橘(Citrusreticulata)[11]等农作物或果木的叶片和根系研究,对于林木类的研究较少。
杉木(Cunninghamialanceolata)是我国南方重要的造林树种[12],其种植区域与缺镁严重的区域部分重合。酶活性对逆境变化较为敏感[13],根系活力反映植物根系主动吸收能力[14]。本研究以1年生杉木无性系020为试验材料,研究了缺镁对杉木根系活力、丙二醛含量和保护酶活性的影响,并分析其相关性。初步探索分析杉木根系对缺镁的生理响应机理,以期探索缺镁对杉木生长、发育以及酶在杉木不同组织中转换的影响。
1 材料与方法
1.1 试验材料
供试杉木为福建省顺昌县洋口国有林场提供的1年生无性系020杉木幼苗。平均株高20.8 cm,地径0.57 cm,冠幅28.9 cm。
1.2 试验设计
选取长势一致,且健康的1年生无性系020杉木幼苗植株为试验对象。于2017年3月初在试验地内采用营养液基质(基质为蛭石与珍珠岩配比3∶1)培养方式进行缺镁试验。选用上端内径12 cm、下端内径8 cm、高12 cm的塑料盆作为盆栽容器,各塑料盆内填充2/3基质,每盆栽种1株幼苗,放置于温室内(温度27 ℃,湿度65%)。在幼苗生长的1个月适应期内,每隔2 d对各幼苗均匀浇灌100 mL营养液。营养液配方参照Peng[15]等的配方。驯化1个月后,开始进行缺镁和正常供镁(对照)的处理。镁以MgSO4形态加入营养液,分别为缺镁(0 mM)和对照(1 mM),缺镁处理的SO42-用Na2SO4补充以维持离子浓度的平衡和避免硫元素的缺乏。
每个处理20株苗,共40株,并编号标记(缺镁:QM,正常:ZM)。隔2 d定量每株浇灌100 mL改良的不同浓度镁营养液,每隔15 d用去离子水淋洗1次,以防止基质中盐分积累影响试验结果。处理12周后进行样品采集。
1.3 测定方法
每个处理取12株长势一致的苗,每4株混合为1个重复,共3个重复。取整株根系,经纯水淋洗后取白色根尖(长度6~9 mm)4℃保存,进行相关参数的测定。
根系活力采用(TTC,氯化三苯基四氮唑)法测定[16],用μgTTF·g-1·h-1表示。丙二醛(MDA)含量采用硫代巴比妥酸(TBA)比色法测定[17],用μmol·g-1FW表示。超氧化物歧化酶(SOD)活性采用采用氮蓝四唑(NBT)光化还原法测定[17],用gFW·h-1表示。过氧化氢酶(CAT)活性采用紫外吸收法测定[17],用g·min-1表示。过氧化物酶(POD)活性采用愈创木酚法测定[17],用g·min-1表示。多酚氧化酶(PPO)活性采用邻苯二酚法测定[17-18],用g·min-1表示。
1.4 数据处理与分析
利用SPSS 18.0、Excel 2003和Origin Pro 8.5软件对数据进行统计分析和作图;利用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)检验根系活力、丙二醛含量和保护酶活性的显著性;利用SPSS 18.0软件中的Pearson相关性分析对根系活力、MDA含量和保护酶活性进行相关性分析,显著性水平为0.05。
2 结果与分析
2.1 缺镁对杉木根系活力的影响
缺镁处理会降低杉木的根系活力。正常供镁的杉木根系活力为72.66 μgTTF·g-1·h-1,缺镁的根系活力为53.93 μgTTF·g-1·h-1,即根系活力表现为ZM>QM,与QM相比,ZM的根系活力高出34.73%,但两者之间差异性不显著(P>0.05)(图1)。
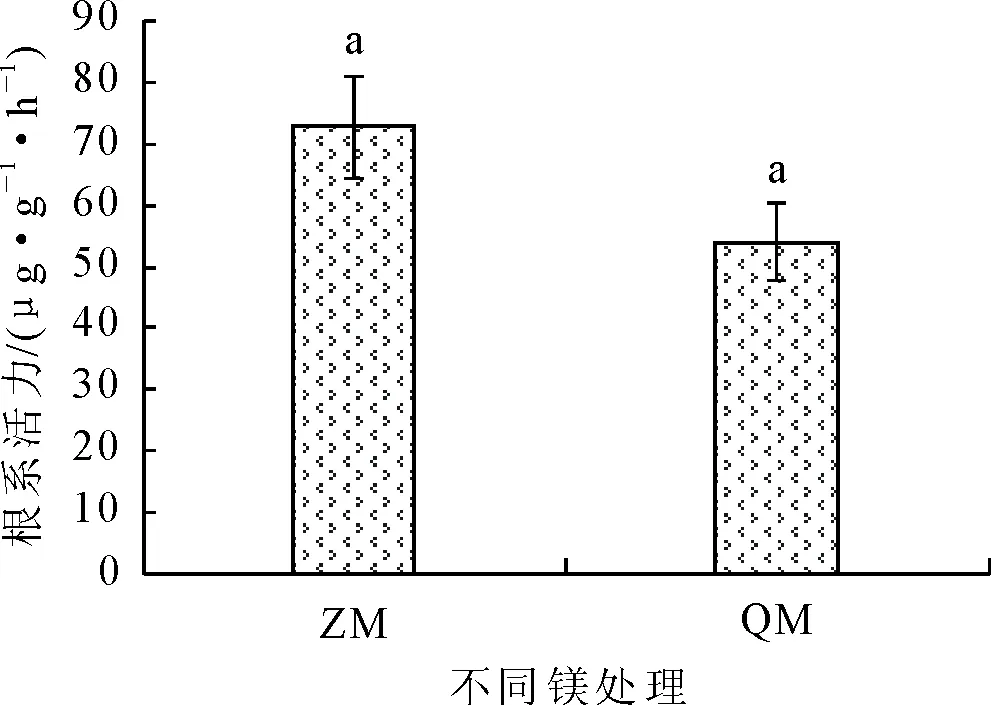
图1 缺镁(QM)和对照(ZM)下杉木1年生苗根系活力(TTC)
2.2 缺镁对杉木根系MDA含量和保护酶系统的影响
缺镁处理对杉木根系MDA含量和保护酶活性具有不同程度的影响(图2)。由图2a和图2b可知,QM的MDA含量和SOD活性均低于ZM。QM的MDA含量比ZM低了1.32%,差异性不显著(P>0.05);QM的SOD活性比ZM低了13.63%,且两者表现出显著性差异(P<0.05)。而QM的CAT活性、POD活性和PPO活性均高于ZM,分别提高了53.02%、0.35%和22.88%,且差异性均不显著(P>0.05,图2c、图2d和图2e)。
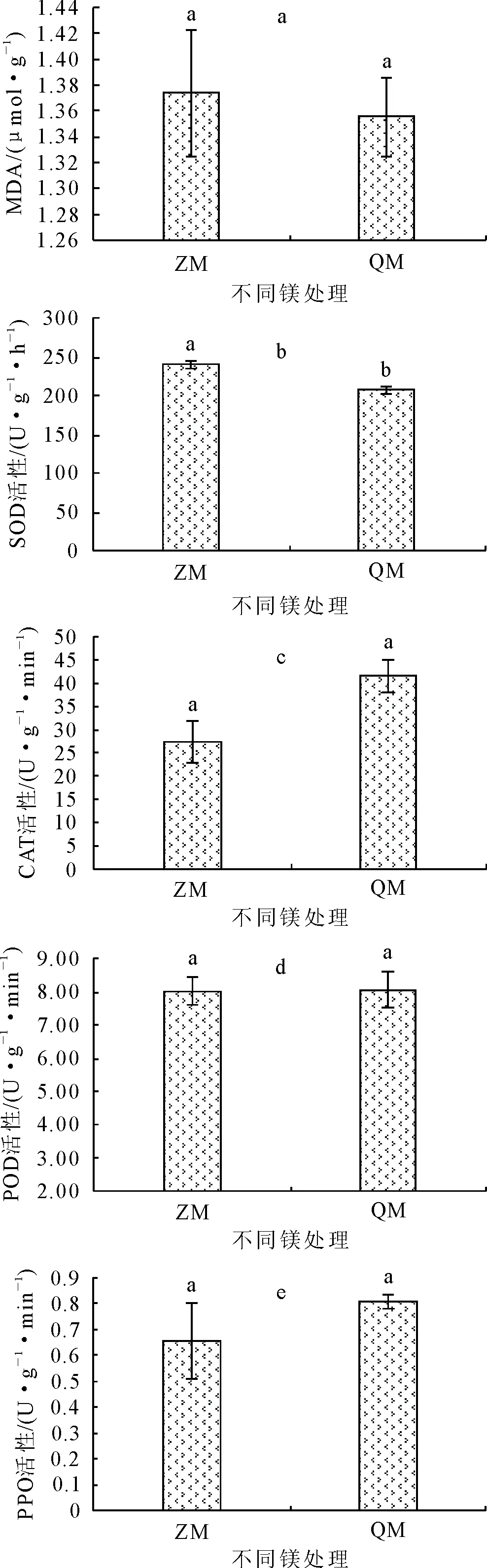
注:不同小写字母表示差异显著(P=0.05)。
图2缺镁对杉木丙二醛(MDA)和保护酶的影响
Fig.2 Effects of magnesium deficiency on malondialdehyde (MDA) and protective enzymes ofC.lanceolata
在正常供镁处理下,杉木根系活力(TTC)与根系MDA含量、SOD活性和CAT活性呈负相关关系,其中与CAT活性呈极显著负相关关系(P<0.01),而与POD活性和PPO活性呈显著正相关关系;根系MDA含量与SOD活性、POD活性和PPO活性均呈负相关关系(P<0.01),除SOD活性外,其他相关性均达到极显著水平(P<0.01),而MDA含量与其CAT活性表现出极显著正相关关系(P<0.01);根系SOD活性与POD活性呈极显著正相关(P<0.01),而与CAT活性呈极显著负相关(P<0.01);根系CAT活性与POD活性和PPO活性均呈极显著负相关(P<0.01);根系POD活性与PPO活性则表现为极显著正相关关系(P<0.01)(表1)。
注:**在P<0.01水平(双侧)上显著相关。表2同。
在缺镁处理下,除与SOD活性呈负相关关系外,杉木根系活力(TTC)与MDA含量、CAT活性、POD活性和PPO活性均呈正相关系,且均达到极显著水平(P<0.01);根系MDA含量与CAT活性、POD活性和PPO活性呈极显著正相关(P<0.01),而与SOD活性呈负相关且不显著;根系SOD活性与CAT活性、POD活性和PPO活性均呈负相关关系且均达到极显著水平(P<0.01);根系CAT活性与POD活性和PPO活性呈极显著正相关水平(P<0.01);根系POD活性与PPO活性呈正相关关系,同时也达到了极显著水平(P<0.01)(表2)。
3 结论与讨论
逆境胁迫下,植物的叶片和根系等都会产生具有不同破坏作用的物质。本研究表明,缺镁对杉木根系活力、MDA含量、保护酶活性和多酚氧化酶具有不同程度的影响。
根系活力是植物生长的重要指标之一[16],能够反映根系新陈代谢的强弱程度,根系活力越高表明其吸收养分的能力越强。本研究表明,缺镁处理会抑制杉木的根系活力,从而进一步影响根系对养分的吸收,这一结果与王芳[7]等的研究结论一致。
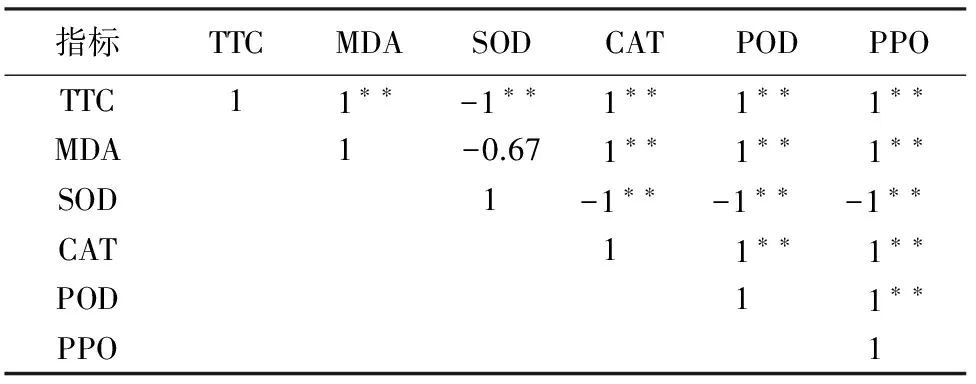
表2 缺镁处理下杉木根系活力与根系MDA含量和保护酶的关系
MDA含量是细胞膜脂过氧化作用的一种产物[16],能够衡量植物对外部逆境的抵御能力[19]。本研究结果显示,与正常供镁相比,缺镁条件下的杉木根系所产生的MDA含量相对较低,即在缺镁环境下,杉木根系表现出更强的抗氧化能力,与R.K.Tewari[20]等对桑树叶片在缺镁条件下的研究结果一致。植物在逆境胁迫环境下,细胞内的自由基代谢平衡被破坏,活性氧积累,由此对植物产生毒害[21]。SOD、CAT和POD等酶活性是植物细胞膜中酶促防御系统的重要保护酶,其活性常作为植物衰老的生理生化指标。本研究表明,与正常供镁相比,缺镁处理下的SOD活性较高,且达到极显著水平(P<0.01),而CAT和POD活性均较低,但差异性不显著(P>0.05),这一研究结果与王芳[22]等对大豆叶片CAT活性和POD活性在缺镁处理下的结果一致,均低于正常供镁的CAT和POD活性,而与之结果不同的是本研究中正常供镁的SOD活性高于缺镁处理。植物体中多酚氧化酶(PPO)是重要的保护酶。逆境胁迫下,植物体内的PPO活性会有所上升[23]。与正常供镁的杉木根系相比,缺镁处理的杉木根系PPO活性提高了22.88%,与上述研究结果一致[23]。
逆境胁迫下,为保持植物体内自由基的动态平衡,一般通过维持最高的SOD水平和保持几种抗氧化酶之间的协调和平衡两种途径来提高抗活性氧的能力[24]。本研究表明,缺镁下的杉木根系SOD活性未达到正常供镁SOD活性的同一水平,而CAT、POD和PPO活性均表现出较高的活性。由此可知,缺镁使得根系内自由基的平衡被破坏,杉木根系活力降低,进而影响根系对养分的吸收和转换,最终影响植物正常生长发育。
本文对杉木根系对缺镁的生理机理进行了初步探索,而缺镁对杉木植株内镁元素的迁移,叶片光合作用以及酶活在不同组织中的活性等影响还需后期进一步探索研究。
参考文献:
[1] 李延,刘星辉,庄卫民.植物Mg素营养生理的研究进展[J].福建农林大学学报:自然版,2000,29(1):74-80.
LI Y,LIU X H,ZHUANG W M.Advances in magnesium nutritional physiology in plants[J].Journal of Fujian Agricultural University:Nat.Sci.Edi.,2000,29(1):74-80.(in Chinese)
[2] WALKER C J,WEINSTEIN J D.Further characterization of the magnesium chelatase in isolated developing cucumber chloroplasts :substrate specificity,regulation,intactness,and ATP requirements[J].Plant Physiology,1991,95(4):1189-96.
[3] GERENDAS J,FVHRS H.The significance of magnesium for crop quality[J].Plant & Soil,2013,368(1-2):101-128.
[4] 朱帅.镁对低温弱光下黄瓜光合作用的调控研究[D].泰安:山东农业大学,2014.
[5] 李延,刘星辉.缺镁胁迫对龙眼叶片衰老的影响[J].应用生态学报,2002,13(3):311-314.
LI Y,LIU X H.Effects of magnesium deficiency on senescence of dimocarpus longana leaves[J].Chinese Journal of Applied Ecology,2002,13(3):311-314.(in Chinese)
[6] 靳晓琳.缺镁胁迫下柑橘幼苗cDNA-AFLP分析[D].福州:福建农林大学,2013.
[7] 王芳,刘鹏,朱靖文.镁对大豆根系活力叶绿素含量和膜透性的影响[J].农业环境科学学报,2004,23(2):235-239.
WANG F,LIU P,ZHU J W.Effect of magnesium on root activity,chlorophyll content and membrane permeability of soybean[J].Journal of Agro-Environment Science,2004,23(2):235-239.(in Chinese)
[8] 谢小玉,张喆.低温和镁胁迫对黄瓜幼苗生长和生理特性的影响[J].中国蔬菜,2012,1(22):54-58.
[9] 朱立保,刘海河,张彦萍,等.镁对厚皮甜瓜坐果节位叶片叶绿素荧光特性和活性氧清除系统的影响[J].植物营养与肥料学报,2015,21(5):1279-1285.
[10] 李延,刘星辉.缺镁对龙眼叶组织活性氧代谢及膜系统的影响[J].热带作物学报,2000,21(4):39-44.
LI Y,LIU X H.Effects of magnesium deficiency on active oxygen metabolism and membrane system of longan (Dimocarpuslongana.Lour) leaves[J].Chinese Journal of Tropical Crops,2000,21(4):39-44.(in Chinese)
[11] YANG G H,YANG L T,JIANG H X,etal.Physiological impacts of magnesium-deficiency inCitrus,seedlings:photosynthesis,antioxidant system and carbohydrates[J].Trees,2012,26(4):1237-1250.
[12] 俞新妥.杉木栽培学[M].福州:福建科学技术出版社,1996:1-8.
[13] 钟楠,王进鑫,马惠芳,等.水分和镉交互胁迫对刺槐幼苗抗氧化酶活性的影响[J].西北林学院学报,2010,25(6):5-9.
ZHONG N,WANG J X,MA H F,etal.Effects of interactive stress of drought and antioxidant enzyme activity ofRobiniapseudoacaciaseedlings[J].Journal of Northwest Forestry University,2010,25(6):5-9.(in Chinese)
[14] 冯志培,赵佳宝,孔玉华,等.种基盘对侧柏幼苗根系形态和生理特性的影响[J].西北林学院学报,2015,30(3):107-112.
FENG Z P,ZHAO J B,KONG Y H,etal.Effect of seed-base technique on the root morphological and physiological properties of platycladus orientalis[J].Journal of Northwest Forestry University,2015,30(3):107-112.(in Chinese)
[15] PENG H Y,QI Y P,LEE J,etal.Proteomic analysis ofCitrussinensis,roots and leaves in response to long-term magnesium-deficiency[J].Bm.Genomics,2015,16(1):253.
[16] 蔡永萍.植物生理学实验指导[M].北京:中国农业大学出版社,2014.
[17] 张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011.
[18] 张立军.植物生理学实验教程[M].北京:中国农业大学出版社,2007.
[19] 陈志刚,张红蕊,周晓红,等.铝胁迫对黑麦草根系抗氧化酶活性和丙二醛含量的诱导特征研究[J].土壤通报,2012(2):391-395.
CHEN Z G,ZHANG H R,ZHOU X H,etal.Study on characteristics of antioxidant enzymes activities and MDA contents in lolium multiflorum roots induced by aluminum stress[J].Chinese Journal of Soil Science,2012(2):391-395.(in Chinese)
[20] TEWARI R K,KUMAR P,SHARMA P N.Magnesium deficiency induced oxidative stress and antioxidant responses in mulberry plants[J].Scientia Horticulturae,2006,108(1):7-14.
[21] 李妍.铅镉胁迫对小麦幼苗抗氧化酶活性及丙二醛含量的影响[J].麦类作物学报,2009,29(3):514-517.
LI Y.Effect of lead and cadmium stress on antioxidant enzymes activites and malondialdehyde concentration of wheat[J].Journal of Triticeae Crops,2009,29(3):514-517.(in Chinese)
[22] 王芳,刘鹏,史锋,等.镁对大豆叶片细胞膜透性和保护酶活性的影响[J].植物营养与肥料学报,2005,11(5):659-664.
[23] 田荣荣,王岩,王伟,等.大豆叶片黄酮类及多酚类物质对臭氧浓度升高的响应[J].生态环境学报,2016,25(8):1277-1282.
TIAN R R,WANG Y,WANG W,etal.Response of soybean leaves flavonoids and polyphenols to elevated ozone [J].Ecology and Environmental Sciences,2016,25(8):1277-1282.(in Chinese)
[24] SCANDALIOS J G.Oxygen stress and superoxide dismutases[J].Plant Physiology,1993,101(1):7.
——缺镁对柑橘光合作用及相关生理生化的影响

