种植前遗传学诊断/筛查周期的临床资料分析
向卉芬,徐祖滢,张 影,郝 燕,陈大蔚,章志国,周 平,曹云霞
遗传性疾病已经成为威胁人类健康的主要疾病之一。1990年世界首例种植前遗传学诊断(preimplantation genetic diagnosis,PGD)技术婴儿的诞生,开辟了人类干预遗传性疾病的新纪元[1]。PGD是指在移植之前对胚胎进行遗传学检测,确定胚胎的遗传组成,选择正常或没有发病风险的胚胎移植,避免有遗传病发病风险的婴儿出生。种植前遗传学筛查(preimplantation genetic screening,PGS)技术是指在移植前对早期胚胎进行非整倍体筛查,挑选正常的胚胎移植,以期提高种植率,降低流产率。诊断技术包括PCR技术、荧光原位杂交(fluorescence in situ hybridization, FISH)技术、微阵列比较基因组杂交技术(array comparative genomic hybridization,array-CGH)、二代测序技术(next generation sequencing, NGS)等。该文回顾性分析了实施PGD/PGS技术的共309个治疗周期的资料,包括对病因构成、治疗过程及临床结局的分析和总结,旨在为临床上PGD/PGS的具体实施提供参考。
1 材料与方法
1.1资料来源
1.1.1病例资料 2009年1月~2016年12月在安徽医科大学第一附属医院生殖医学中心行PGD/PGS助孕的283对夫妇的309个治疗周期的资料。
1.1.2PGD适应证 ① 夫妇一方或双方染色体数目或结构异常;② 基因病;③ 性连锁遗传病;④ HLA配型;⑤ 癌症易感基因携带者。
1.1.3PGS适应证 ① 高龄;② 不明原因复发性流产或不良妊娠史;③ 反复种植失败。
1.2研究方法
1.2.1治疗过程 有PGD/PGS适应证的患者,根据基础内分泌水平及超声下窦卵泡计数,选择合适的促排卵方案,采用经阴道B超监测卵泡发育,当主导卵泡群至合适大小时,肌注人绒毛膜促性腺激素5 000~10 000 IU,36 h后经阴道B超引导下穿刺取卵。减数第2次分裂中期(metaphase Ⅱ, MⅡ)的卵子常规行单精子卵胞浆内注射受精,16~18 h后观察受精情况,受精后2~5 d观察并记录卵裂及胚胎发育情况。所有活检过程采用激光透明带打孔法。
1.2.2FISH法 48个周期采用FISH法进行诊断。受精后第3天,胚胎发育至6~10细胞时,活检取出1~2个卵裂球,转移至载玻片上,加入细胞裂解液(0.01 mol/L HCL+1%Tween20)并注意标注细胞核的位置。经PBS及梯度乙醇(50%,70%,100%)溶液各脱水2 min后置于消化液(0.1 mg/ml 胃蛋白酶+0.01 mol/L HCL)37 ℃水浴条件下处理10 min。过蒸馏水,经固定液(1%多聚甲醛)5 min固定后再依次经PBS 和上述梯度乙醇各脱水2 min。将每张片加探针约2 μl,加盖盖玻片,封片,启动杂交过程后置于37 ℃湿盒过夜。次日晨洗片,待玻片避光自然晾干后滴加含染核剂的抗荧光淬灭剂AntifadeⅡ,放置于荧光显微镜下观察结果。活检后的胚胎继续培养,于第5天根据FISH结果选择胚胎移植。诊断异常、失败或胚胎质量差的胚胎则不予移植。
1.2.3array-CGH法 225个周期采用array-CGH法进行诊断。受精后5~6 d,胚胎发育至囊胚期时,活检取5~10个滋养外胚层细胞,利用Sure Plex DNA Amplification System 试剂盒进行全基因组扩增,对扩增产物进行Cy3-Cy5 荧光标记并杂交于Blue Gnome 24 sure V3 芯片上。洗片后,通过Inno Scan 710 扫描仪扫描和Blue Fuse Multi 软件分析后获得数据。将活检后的胚胎编号冷冻。根据诊断结果,选择诊断正常的胚胎行冻融胚胎移植。诊断异常或不明确的胚胎不予移植。
1.2.4NGS法 36个周期采用NGS法进行诊断。受精后5~6 d,胚胎发育至囊胚期时,活检取5~10个滋养外胚层细胞,MDA法全基因组扩增,将产物纯化检测后,用life tech 和ION XPRESS LIBRARY KIT构建文库,获得数据后分析。将活检后的胚胎编号冷冻。根据诊断结果,选择诊断正常的胚胎行冻融胚胎移植。诊断异常或不明确的胚胎不予移植。
1.2.5妊娠的确认和随访 移植后14 d测定血中人绒毛膜促性腺激素水平确定是否妊娠,移植后30 d B超检测胎心及胚胎发育情况。妊娠者均随访至分娩并详细记录产前诊断、母婴情况、新生儿孕周、出生体重、有无出生缺陷等。

2 结果
2.1女性患者的基本临床资料本中心自2009年起开展PGD/PGS技术以来,有283对夫妇接受治疗,共行309个周期。其中女性患者的平均年龄为(29.37±4.76)岁,不孕年限为(3.15±2.73)年,身高体重指数(body mass index,BMI)为(22.25±2.88) kg/m2, 基础卵泡刺激素(basic follicle stimulating hormone, bFSH)为(6.58±1.63) IU/L, 基础促黄体生成素(basic luteinizing hormone, bLH)为(4.99±2.54) IU/L。
2.2实施PGD/PGS夫妇的病因构成分析283对夫妇中,因一方或双方染色体异常行PGD治疗的共有223例,占78.8%,其中男性异常有131例,女性异常有89例,3例为夫妻双方均有异常。因基因病行PGD治疗的有4例,占1.4%,其中1例为杜氏肌营养不良致病基因携带者采用FISH技术行性别选择,另3例分别为先天性成骨发育不全患者、多囊肾患者、先天性耳聋基因携带者,均采用NGS法诊断;因不明原因复发性流产或不良妊娠史(38例)、反复种植失败(13例)和高龄(5例)行PGS治疗的共有56例,占19.8%。
2.3PGD/PGS实施情况分析
2.3.1FISH、array-CGH和NGS 3种诊断方法的比较 分析通过FISH、array-CGH和NGS这3种方法诊断的309个PGD周期,比较这3种方法的诊断效率,结果显示:FISH组的年龄小于NGS组,差异有统计学意义(P<0.05);FISH组的获卵数和平均活检胚胎数多于array-CGH组和NGS组,差异均有统计学意义(P<0.05);array-CGH组的活检成功率高于FISH组和NGS组,差异均有统计学意义(P<0.05);FISH组的无胚胎移植周期比率低于array-CGH组,差异有统计学意义(P<0.05),FISH组的正常胚胎率高于array-CGH和NGS组,但胚胎种植率低于array-CGH组和NGS组,差异均有统计学意义(P<0.05),FISH组的临床妊娠率低于NGS组,差异有统计学意义(P<0.05);3种方法患者的BMI、卵巢基础情况、Gn用量、Gn天数、受精数、卵裂数、流产率比较,差异均无统计学意义。见表1。
2.3.2不同病因行PGD/PGS临床妊娠率比较 因女方、男方染色体异常、反复流产或不良妊娠史和反复种植失败行PGD/PGS治疗的临床妊娠率分别为:48.7%、46.3%、46.2%和25.0%,各组间妊娠率差异无统计学意义。见图1。
2.3.3因染色体易位行PGD周期的分析 染色体易位可包括罗伯逊易位和相互易位, 通过PGD技术可以有效地筛除因非均衡的配子导致早期胚胎遗传物质不均衡的的异常胚胎,改善这类患者临床结局。针对这两种易位类型,本中心采用array-CGH技术共实施113个PGD周期,其中罗伯逊易位43个周期,相互易位70个周期,比较这两组患者各项指标,差异均无统计学意义,详细见表2。
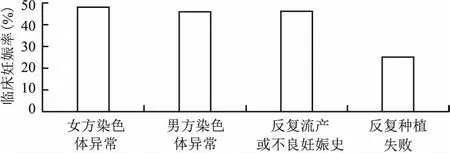
图1 不同病因行PGD/PGS临床妊娠率比较
2.4PGD/PGS出生子代情况截止2016年12月,随访出生新生儿共70例,均未显示有出生缺陷。由于应用NGS法仅出生4例,数量太少,故只比较FISH和array-CGH两种诊断方法出生的新生儿。其性别比、身长及体重差异均无统计学意义,见表3。
3 讨论
正如前面介绍,PGD临床上一般应用于以下患者:① 染色体异常,包括夫妻任意一方的异常或者双方染色体异常。其中,染色体易位(相互易位、罗氏易位)、倒位、嵌合体、性染色体异常(包括Y染色体微缺失)等均包含在内。染色体异常可以在减数分裂过程中形成异常的配子,导致不孕不育、复发性流产、甚至生育畸形或智力低下的胎儿、死胎死产等。染色体异常在一般人群中的发生率为0.5%~1.0%,在有不良孕产史人群中的发生率则可达2%~10%[2]。因此,PGD技术可帮助因染色体异常而不孕的夫妇进行胚胎活检,从而降低流产风险,获得正常后代。本文行PGD/PGS助孕的283例患者中,因染色体异常行PGD有223对夫妇,占总例数的78.8%,可见染色体异常是本中心不孕患者行PGD的最主要原因。② 单基因病。本中心有3例单基因病行PGD,其中1例为先天性成骨发育不全患者,采用NGS法诊断,已生育一健康女婴;另2例分别是多囊肾患者和先天性耳聋基因携带者,均采用NGS法诊断,截至随访日,均为持续妊娠。③ 性连锁遗传病。本中心有1例性连锁遗传病,为杜氏肌营养不良症的致病基因携带者,采用FISH法行性别选择,未孕。综上,因基因病来我中心行PGD共4例,占总例数的1.4%。本中心暂无因HLA配型或是癌症易感基因携带者行PGD的不孕夫妇。相对于PGD,PGS周期所占比例较少,仅有56对夫妇因不明原因复发性流产或不良妊娠史(38例)、反复种植失败(13例)和高龄(5例)来我中心行PGS助孕,占总例数的19.8%。但随着二胎政策的全面开放,许多高龄妇女会寻求二胎的生育,PGS的应用比例可能会有一定幅度的增加。

表1 采用3种诊断方法的PGD/PGS周期比较±s)
与NGS法比较:*P<0.05;与FISH法比较:**P<0.05;与array-CGH法比较:#P<0.05

表2 因染色体罗伯逊易位和相互易位行array-CGH法PGD周期的比较±s)

表3 FISH和array-CGH法出生子代情况比较±s)
自1994年Harper et al[3]学者成功采用FISH技术对胚胎进行性别诊断后,FISH技术开始逐步应用于PGD领域中。该技术是用带有荧光标记的特异性探针与待测的DNA杂交后,在荧光显微镜下观察荧光信号,可对染色体异常及性别诊断进行检测分析,具有简单快速、重复性好、检测结果直观清晰的优点。但运用FISH技术行PGD也存在较多的局限性,包括单细胞固定实验技术的难度和要求较高;分辨率较低,能检测的染色体数目也有限;人为判读FISH检测的信号结果,具有一定的主观性,易导致误诊。近年来,array-CGH和NGS也开始应用于PGD的领域中。array-CGH是FISH技术的一大延伸和突破,相比于FISH技术,array-CGH技术有具有高通量,高分辨率,高灵敏度,快速及自动化等优点。NGS又称高通量测序,是DNA测序史上一次划时代的革命。NGS的优势在于不仅可以对染色体病进行诊断,还能通过构建单体型与深度捕获测序相结合,对单基因病进行诊断。随着单细胞扩增技术的发展成熟,测序成本和耗时的下降,NGS在PGD/PGS技术中发挥了越来越重要的作用[4-5]。
因此本研究比较了FISH、array-CGH和NGS 3种诊断方法在PGD/PGS技术中的应用,显示FISH组患者年龄相对于其他两组较小,且与NGS组相比差异有统计学意义,可能导致FISH组的获卵数、平均活检胚胎数和正常胚胎率均多于array-CGH组和NGS组。比较3组技术的胚胎活检成功率可显示array-CGH组的活检成功率最高,其次为NGS技术,且array-CGH组与FISH组和NGS组相比,差异均有统计学意义。从临床结局比较上来看,尽管FISH组的患者年龄最小,但其胚胎种植率仍低于array-CGH组和NGS组,且FISH组的临床妊娠低于NGS组,差异均有统计学意义。分析原因,FISH技术采用的是卵裂球活检,仅选取1~2个细胞进行分析,而且卵裂期的胚胎存在较高的嵌合现象,影响PGD诊断的准确度。而随着囊胚培养技术的提高,array-CGH法和NGS法均采用囊胚滋养层细胞活检,可以取出5~10个细胞进行分析,既不侵入内细胞团,也降低了因嵌合体、扩增失败等误诊的风险,可以提高诊断的效率。现如今已有文献[6]表明卵裂期活检可能会降低胚胎的生育种植潜能,这与本研究的种植率比较结果一致。在移植方式选择上,本研究FISH组为两种移植方式均有,array-CGH组和NGS组均采取冻融胚胎移植,已有的研究[7-8]表明冻融胚胎移植可以降低卵巢过度刺激的风险,避免促排卵药物对子宫内膜容受性的影响,从而提高临床妊娠率。这可能是得到本研究临床妊娠率比较结果的原因。值得一提的是,本中心的4例基因病,除1例是性连锁性基因病行性别选择外,另外3例均采用NGS法通过建单体型进行诊断,NGS技术弥补了FISH和array-CGH技术不能诊断性连锁性以外基因病的缺点。
本研究结果表明患者因女性染色体异常、男性染色体异常、反复流产或不良妊娠史及反复种植失败病因行PGD/PGS治疗的临床妊娠率分别为:48.7%、46.3%、46.2%和25.0%,由于因高龄行PGS的例数很少,临床结果仍待商榷,但PGD对染色体异常的患者的后续发展具有明显的促进作用。Fischer et al[9]学者对192例行PGD助孕的有3次及以上流产史的染色体易位携带者进行研究,发现流产率从行PGD前的88.5%锐减到PGD后的13%,妊娠成功率可达87%,大大改善了患者的临床结局。
随着PGD/PGS技术的普及和发展,有关PGD/PGS子代安全及伦理问题也成为当今的热点问题之一。Nekkebroeck et al[10]纳入了70例经PGD/PGS、70例经ICSI和70例经自然妊娠出生的2岁儿童,比较了3组儿童的心智发展和精神运动能力,发现其差异无统计学意义。之后Winter et al[11]对47例经PGD、49例经ICSI和48例经自然妊娠的5~6岁的儿童进行了认知发育和运动能力的评估,发现PGD组的两项指标和其他两组相比差异均无统计学意义,但ICSI组和自然妊娠组在运动能力的比较中差异有统计学意义。本研究行PGD/PGS出生的新生儿共70例,均无出生缺陷,且通过FISH和array-CGH诊断方法出生的新生儿在性别比、身长及体重上差异均无统计学意义。但探索PGD/PGS的安全问题,仍需要更长久更完善的随访研究。
综上所述,PGD/PGS技术是对遗传病高危患者的有效干预措施。FISH、array-CGH和NGS 3种诊断方法均是有效的胚胎诊断方法,array-CGH法和NGS法的诊断效率较FISH法高。而NGS技术可以同时实现对染色体异常和单基因病的检测,随着该技术的不断发展,NGS技术有望会成为PGD/PGS的主流检测手段。
[1] Handyside A H, Kontogianni E H, Hardy K, et al. Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification [J]. Nature, 1990, 344(6268):768-70.
[2] 张 明, 高久春, 郑贤红,等. 不良孕产史患者467例细胞遗传学分析[J]. 实用医学杂志, 2008, 24(6):998-1000.
[3] Harper J C, Coonen E, Ramaekers F C, et al. Identification of the sex of human preimplantation embryos in two hours using an improved spreading method and fluorescent in-situ hybridization (FISH) using directly labelled probes[J]. Hum Reprod,1994,9(4):721-4.
[4] Simpson J L, Rechitsky S, Kuliev A. Next-generation sequencing for preimplantation genetic diagnosis [J]. Fertil Steril,2013, 99(5):1203-4
[5] Tukaszuk K, Pukszta S, Wells D, et al. Routine use of next-generation sequencing for preimplantation genetic diagnosis of blastomeres obtained from embryos on day 3 in freshinvitrofertilization cycles [J]. Fertil Steril, 2015, 103(4):1031-6.
[6] Scott R T,Upham K M,Forman E J,et al. Cleavage-stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not: a randomized and paired clinical trial[J]. Fertil Steril,2013,100(3):624-30.
[7] Shapiro B S,Daneshmand S T,Garner F C,et al.Evidence of impaired endometrial receptivity after ovarian stimulation forinvitrofertilization: a prospective randomized trial comparing fresh and frozen-thawed embryo transfer in normal responders[J]. Fertil Steril,2011,96(2):344-8.
[8] Evans J,Hannan N J,Edgell T A,et al.Fresh versus frozen embryo transfer: backing clinical decisions with scientific and clinical evidence[J]. Hum Reprod Update, 2014,20(6):808-21.
[9] Fischer J, Colls P, Escudero T, et al. Preimplantation genetic diagnosis (PGD) improves pregnancy outcome for translocation carriers with a history of recurrent losses [J]. Fertil Steril, 2010, 94(1):283-9.
[10] Nekkebroeck J,Bonduelle M,Desmyttere S,et al.Mental and psychomotor development of 2-year-old children born after preimplantation genetic diagnosis or screening[J].Hum Reprod,2008,23(7):1560-6.
[11] Winter C, Van Acker F, Bonduelle M, et al. Cognitive and psychomotor development of 5- to 6-year-old singletons born after PGD: a prospective case-controlled matched study[J]. Hum Reprod,2014,29(9):1968-77.

