还原石墨烯对白腐菌降解脱色染料活性艳红X-3B的影响
杨 桦,马 强,冯世成,杨胜韬
(西南民族大学化学与环境保护工程学院,四川 成都 610041)
随着印染行业的快速发展,人们越来越重视印染废水中的染料对环境的污染问题.上万种不同的染料被应用到印染行业,至少有10%的已用染料通过废物进入环境[1-2].印染废水中的染料毒性大,吸光系数大,同时具有耐光、耐热等特点.其中活性艳红X-3B属于典型的偶氮类染料,其结构中的磺酸基团使得染料在水中溶解性极好,因此很难从水中去除.活性艳红X-3B分子结构式如图1所示.目前偶氮类染料种类最多,产量最大,使用量第一,降解难度大,对偶氮类染料的处理已成为当今国内外工业废水治理中的重要问题.目前染料废水的处理方法主要有物理法、化学法与生物法.但是物理方法无法彻底清除染料污染物,而化学方法容易引起二次污染[3].在国内,生物法是目前染料废水的主要处理手段.
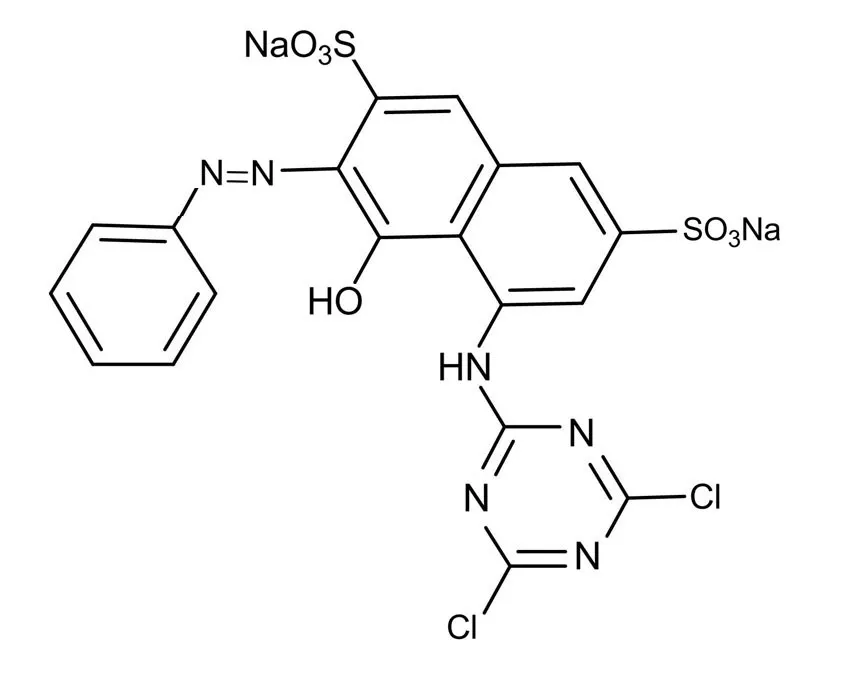
图1 活性艳红X-3B分子结构示意图Fig.1 Molecular structure of reactive brilliant red X-3B
白腐菌是一类白色的丝状真菌,具有彻底分解降解木质素的能力,在碳循环系统中扮演着至关重要的角色,其中黄孢原毛平革菌是白腐菌中分布广泛的典型菌种.许多白腐菌被证实可以用于处理难降解的污染有机物,如木质素香烃、合成染料等[4-6].白腐菌对染料的脱色和降解主要是依靠白腐菌降解木质素过程中分泌的胞外酶破坏染料的发色体系,使染料脱色、降解并最终矿物化,从而达到消除染料污染的目的.因此白腐真菌在污水治理中具有广阔的应用前景.
石墨烯自发现以来一直备受关注,因其独特的物理化学性质,在诸多领域都有着良好的应用前景[7-8].目前,石墨烯已在药物[9]、电荷储存[10]、传感器[11]、复合材料[12]等诸多领域有着广泛的应用.随着石墨烯逐步进入人们的生产生活,人们也越发重视其潜在的危害性.近年来,一些研究人员报道纳米材料可能干扰白腐菌的产酶和分解活性[13-17].而白腐菌的产酶与分解过程与治理印染废水的染料降解过程息息相关,因此,探究纳米材料对白腐菌降解染料过程的影响迫在眉睫.
本文通过测定白腐菌脱色染料过程中白腐菌的质量、培养体系的pH值和染料脱色率等指标,探究RGO对黄孢原毛平革菌降解染料的影响,为探讨RGO的环境生物安全性提供基础数据.
1 实验部分
1.1 还原石墨烯的制备
本工作采用改良的Hummer’s法制备氧化石墨烯(GO)[18],得到单一分散的 GO,再用抗坏血酸(VC)作为还原剂还原所得的GO.VC无毒环保,且反应条件温和[19].VC与GO质量比1:1,在60℃恒温水浴条件下反应4小时,得到黑色的RGO分散液.将得到的RGO超声洗涤至中性,然后过滤、冻干,得到纯净的RGO黑色颗粒.对得到的RGO进行一系列的表征.
1.2 白腐菌的培养
真菌菌株黄孢原毛平革菌(MTCC 787)购买于广东省微生物保藏中心,葡萄糖马铃薯琼脂培养基购买于Solarbio公司.真菌在葡萄糖马铃薯琼脂平板上37℃恒温静置黑暗培养7天后,用10 mL蒸馏水分散,制备得到孢子菌悬液,用血球计数板法计数后,将菌悬液接种到40 mL液体培养基中,接种量为5×105个/mL,37℃恒温黑暗震荡培养,转速为100 rpm.液体培养基配方如下:葡萄糖(10 g/L),KH2PO4(2.56 g/L),MgSO4·7H2O(0.71 g/L),酒石酸铵(0.2 g/L),苯甲醇(0.54 g/L),硫胺素(0.001 g/L),微量元素液(70 mL/L),乙酸(0.9 g/L)和乙酸钠(0.9 g/L).微量元素液配方如下:氨基乙酸(0.6 g/L),Mn-SO4·H2O(0.5 g/L),NaCl(1 g/L),FeSO4·7H2O(0.1 g/L),CoCl2·H2O(0.19 g/L),CaCl2·2H2O(1.56 g/L),ZnSO4·7H2O(0.1 g/L),CuSO4· 5H2O(0.1 g/L),KAl(SO4)2·12H2O(0.01 g/L),HBO3(0.01 g/L),Na2MoO4·2H2O(0.01 g/L).液体培养基用乙酸调节pH至5.0,接种前均已灭菌.
1.3 RGO对白腐菌分解活性的影响
为了探究RGO对白腐菌分解活性的影响,将40 ml液体培养基中分别加入浓度为 0,0.25,0.5,0.75,1.0,2.0,3.0,4.0 mg/mL 的 RGO,并用乙酸调节液体培养基pH值至5.0,高压灭菌后以5×105个/mL接种量接种白腐菌孢子,37℃恒温黑暗震荡培养,转速为100 rpm.培养3天后,向体系中加入1 mL浓度为30 mg/L的活性艳红染液继续培养.每隔12小时从体系中取出2 mL染色培养液,高速离心后取上清液,用紫外分光光度计检测染料在538 nm处的吸光度,分析染料褪色情况.染料褪色完全后分离白腐菌与液体培养基,测定液体培养基pH值变化,并记录白腐菌湿重,然后将白腐菌放入真空干燥箱中60℃恒温干燥48小时,保证水分完全去除,测定白腐菌干重.
1.4 还原石墨烯吸附染料活性艳红X-3B
RGO因其独特的多孔片层结构,其本身就是良好的吸附材料.为了进一步了解RGO对白腐菌褪色染料的影响,设计了无白腐菌降解条件下RGO对染料的吸附作用探究实验.将40 ml液体培养基中分别加入不同浓度的RGO(0~4.0 mg/mL),并用乙酸调节液体培养基pH值至5.0,高压灭菌后向体系中加入1 mL浓度为30 mg/L的活性艳红染液,37℃恒温黑暗震荡培养,转速为100 rpm.每隔12小时从体系中取出2 mL染色培养液,高速离心后取上清液,用紫外分光光度计检测染料在538 nm处的吸光度,分析染料褪色情况.
1.5 统计分析
所有数据均为4个单独数据的平均值,数据统计显著性差异,p<0.05表示有显著性差异.
2 结果与讨论
2.1 还原石墨烯的表征
测试RGO的影响之前,对制备出的RGO做了一系列的详细表征,以确保样品质量.图2为RGO透射电镜图像,从图2可以看出RGO是典型的片层结构,且有轻微的褶皱堆叠现象.

图2 RGO的透射电镜图像Fig.2 TEM image of RGO
通过XPS分析其元素含量,其中碳元素含量大约占73.6%,氮元素大约占0.7%,氧元素大约占25.7%.通过将C1s XPS进行分峰处理如图3所示,碳原子化学键主要有三个成分,即 C-C(56.6%),C-O(39.5%)和C=O(3.9%).其残余氧原子以含氧官能团的形式存在,红外光谱证实了该材料有许多的含氧基团.图4为RGO红外谱图,约3 467 cm-1处的宽峰表明存在-OH/-COOH基团,1 070 cm-1处的峰表明存在C-O基团,在1 616 cm-1处是典型的C =C信号.此外,在红外光谱中没有观察到VC的典型吸收峰,说明VC被清洗去除的很干净.总的来说,表征结果说明,RGO样品制备成功,且不含重金属或抗坏血酸杂质,适用于毒性评价.
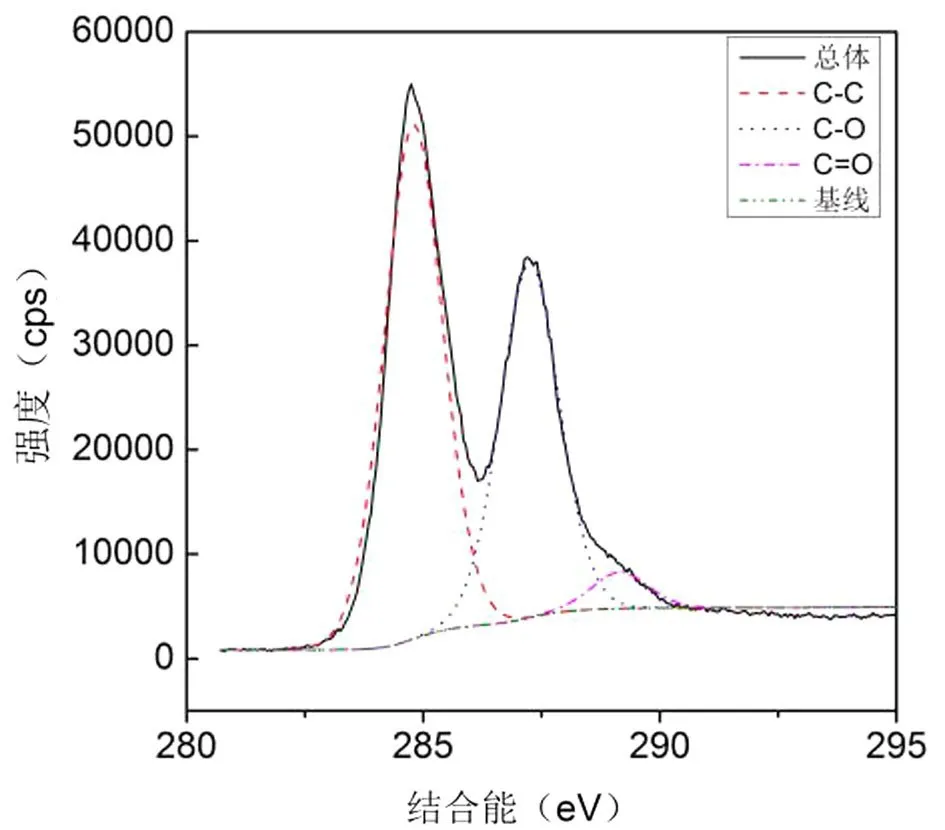
图3 RGO的C1s X射线光电子能谱图Fig.3 C1s XPS spectrum of RGO
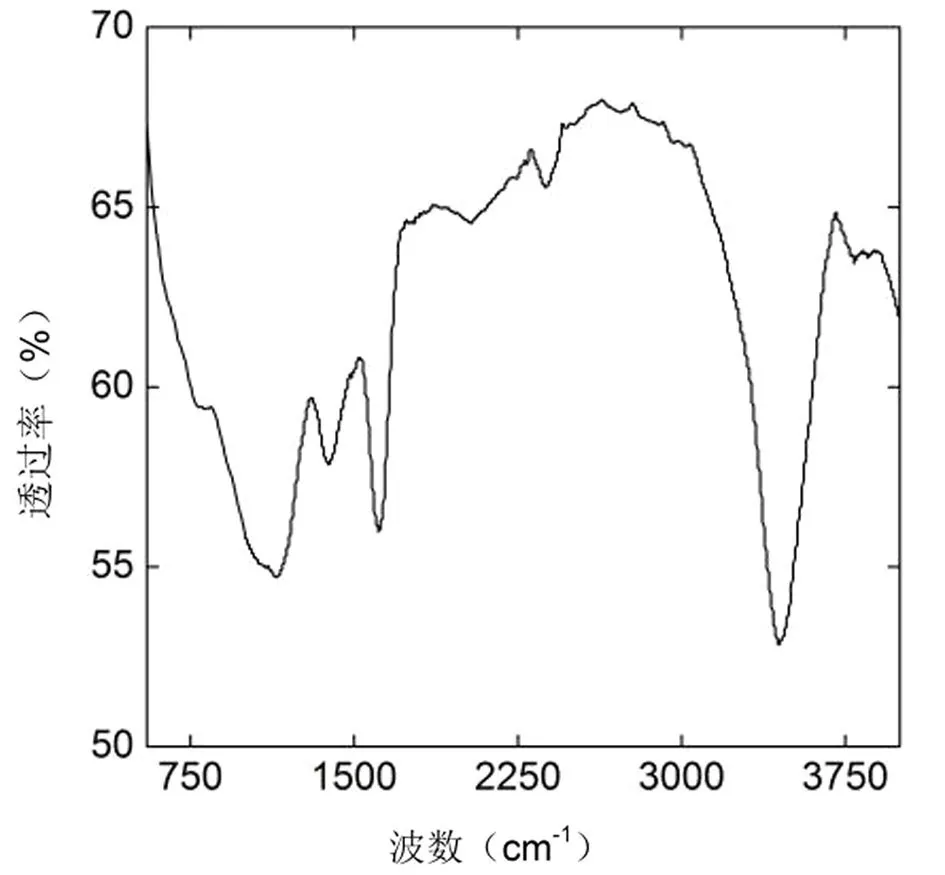
图4 RGO的红外光谱图像Fig.4 IR spectrum of RGO
2.2 还原石墨烯对白腐菌降解活性艳红X-3B的影响
将白腐菌曝露于不同浓度的RGO中培养,观测RGO对白腐菌褪色染料活性艳红的影响.图5为白腐菌褪色染料后的湿重干重图像.由图5a可以看出,在测试浓度范围内,白腐菌湿重随体系中RGO浓度的增加而增加,与没有RGO存在的对照组相比,增加趋势有显著性差异(p<0.05).由图5b可以看出,与湿重趋势不同的是,在测试浓度范围内,白腐菌干重随体系中RGO浓度的增加而减小,当RGO浓度达到4.0 mg/mL时,有显著性差异(p<0.05).RGO浓度的增加导致湿重和干重趋势不同,推测是由于RGO与染料产生的毒性使得白腐菌产生氧化应激,导致白腐菌中毒水肿,因此湿重有增加趋势.数据说明RGO对白腐菌降解染料过程有影响,RGO导致白腐菌在体系中水肿,且抑制白腐菌的生长,高浓度的RGO影响下对其生长的抑制作用更明显.
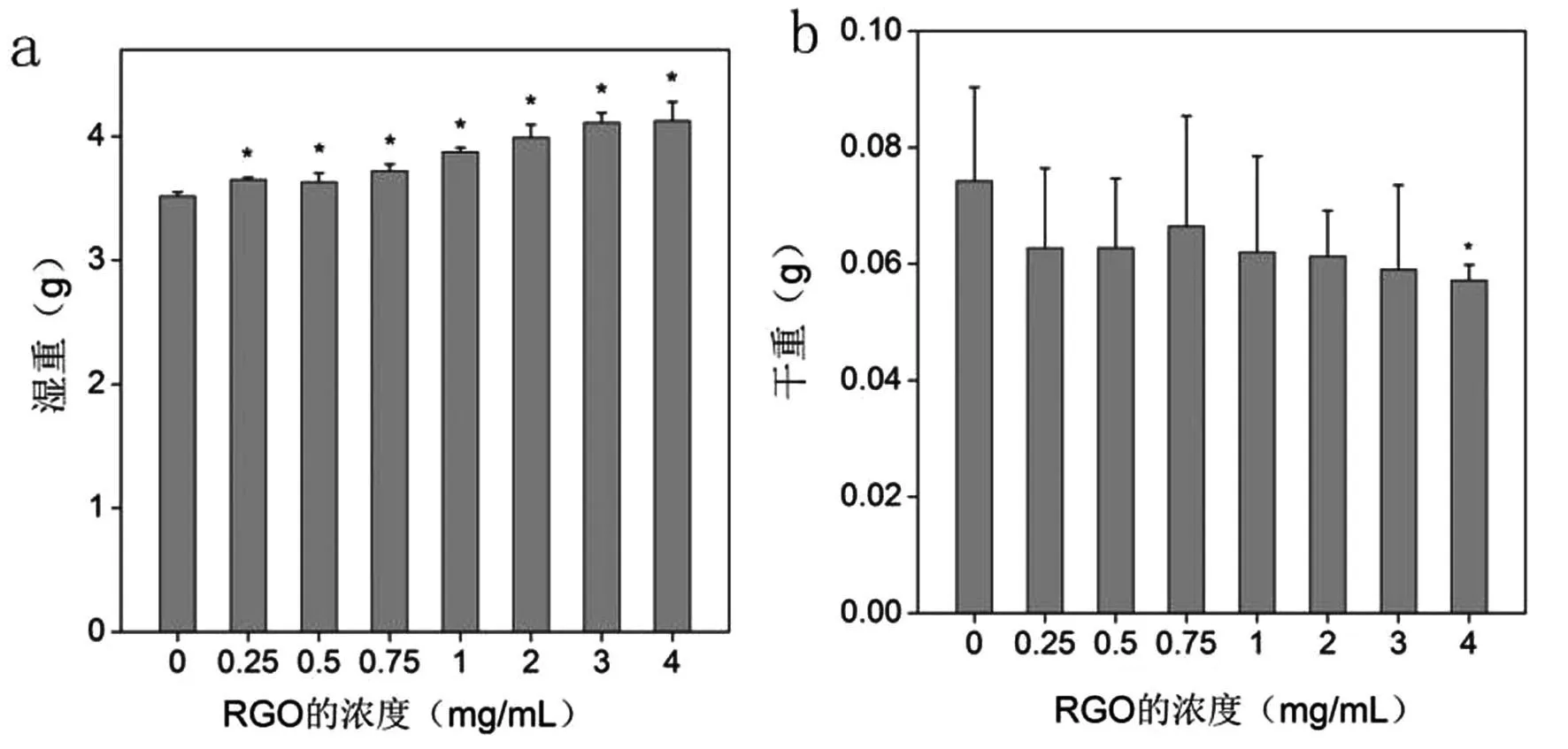
图5 RGO对白腐菌生长的影响Fig.5 Influence of RGO on the weight gain of P.chrysosporium.
对白腐菌褪色染料后的体系pH值进行了测定,发现褪色后的体系pH值较培养前均有显著性增加(p<0.05),但没有超出白腐菌培养的最适宜pH值范围(4.5~5.5).这是由于白腐菌自身的调节作用,没有RGO存在的对照组pH值增加,说明白腐菌生长和降解染料的过程对体系pH值有影响,其分泌代谢产物调节了环境pH值.同时有RGO存在的实验组中,体系pH值变化与对照组相当,说明RGO对体系pH值影响不大(图6).
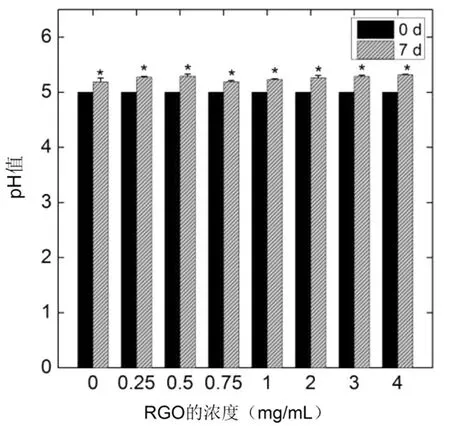
图6 RGO对体系pH值的影响Fig.6 Influence of RGO on the pH value of culture system
对白腐菌降解染料的脱色情况进行定时测定,每12 h测定一次染液吸光度变化,并绘制脱色曲线如图7所示.数据显示,对照组和实验组在72 h左右都基本脱色完全.无RGO的对照组脱色速率比有RGO的体系慢,且体系中的RGO浓度越高,脱色速率越快,脱色完全所需时间越短.当RGO浓度为4.0 mg/mL时,体系在12 h就已经基本脱色完全.数据说明无RGO影响下白腐菌可以彻底降解染料,体系基本褪色完全,而RGO的引入有利于白腐菌脱色染料,RGO浓度越高,染料脱色速率越快.
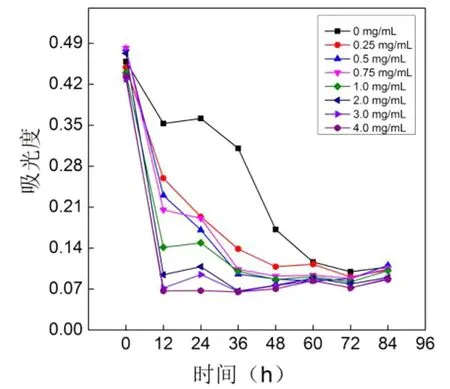
图7 RGO对白腐菌降解活性艳红X-3B的影响Fig.7 Influence of RGO on the decomposition activity of P.chrysosporium for reactive brilliant red X-3B
由于RGO是多孔的片层结构,其本身就是良好的吸附性材料,因此上述实验中对照组对染料的脱色完全依靠于白腐菌的降解作用,而实验组对染料的脱色则来自于两部分贡献,一部分是白腐菌的降解,而另一部分来自于RGO的吸附作用.为了进一步了解RGO在白腐菌降解染料过程中的影响,设计了在无白腐菌降解的情况下测定RGO对染料的吸附作用实验,并绘制了脱色曲线如图8所示.
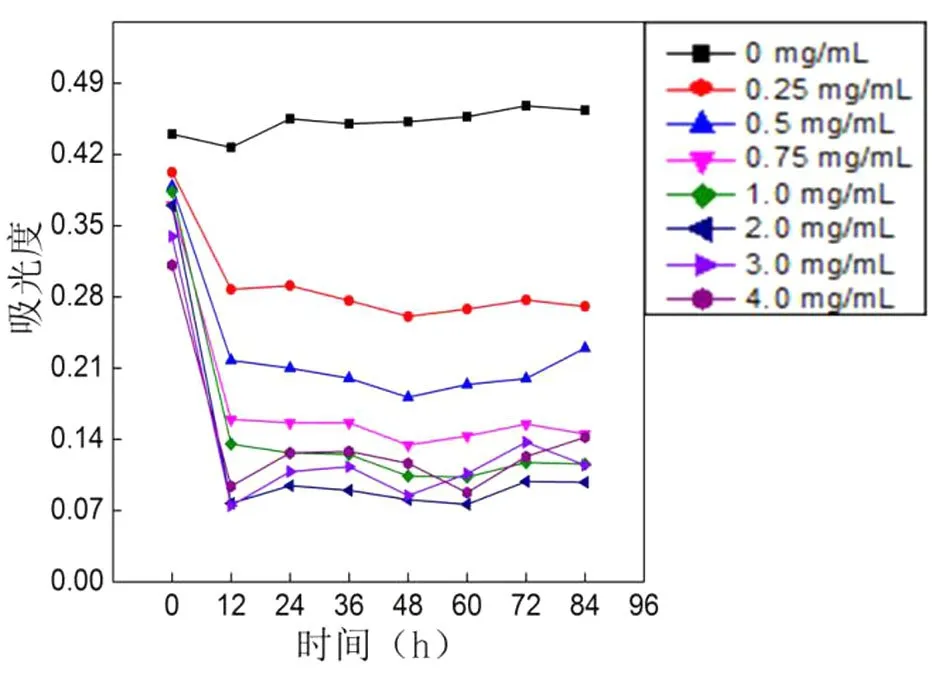
图8 RGO对活性艳红X-3B的吸附作用影响Fig.8 Influence of RGO on sorption for reactive brilliant red X-3B
对照组为无白腐菌和RGO作用的染液吸光度,相同培养条件下染液吸光度基本不变,染液无褪色现象.随着体系RGO浓度的增加,染液脱色速率增加,脱色率也增加.RGO的吸附主要集中在0~12 h,所以0~12 h脱色速率最快,随着RGO的吸附位点逐渐被填满,脱色速率也逐渐减慢,最终达到吸附平衡.与图7相比较,相同条件下脱色等量染料,降解作用比吸附作用耗时更长.只有吸附作用影响时,高浓度RGO能使得染料完全褪色,而低浓度RGO只能褪色部分染料.
本实验通过探究RGO对白腐菌降解活性艳红X-3B的影响过程,发现RGO对白腐菌的生长有影响.RGO的引入导致白腐菌中毒水肿,湿重呈显著性增加.RGO浓度越大,白腐菌水肿程度也越大.同时白腐菌干重呈明显的下降趋势,说明RGO在白腐菌降解染料过程中抑制了其生长,当RGO浓度增大到4.0 mg/mL时,白腐菌干重减少有显著性差异.对褪色前后体系pH值进行了测定,褪色后的体系pH值均有显著性的增加,但仍在白腐菌培养的最适pH范围内,这是由于白腐菌生长及脱色染料过程中自身分泌的代谢产物对环境pH值进行了调节.有或无RGO影响下的体系pH值变化相当,说明RGO对白腐菌降解染料过程的pH值影响不大.因此在使用白腐菌生物降解法治理污水中的染料时,应尽量避免高浓度RGO的存在,减少RGO对白腐菌生长的影响,同时需要注意调节体系pH值在白腐菌生长的适宜pH范围内.
对染液吸光度变化进行测定,发现白腐菌能够充分彻底的降解染料,但耗时较长,而加入RGO可以加快染料褪色,RGO浓度越大,褪色效率越高.而RGO因其独特的多孔片层结构,本身对染料具有一定的吸附作用,RGO浓度越高,其对染料的吸附量越大,吸附作用时间也比降解作用耗时更短.低浓度RGO只能部分吸附染料,若要彻底脱色染料需要加大RGO浓度,或者引入白腐菌进行降解作用.在污水治理中,可以用RGO吸附染料,但需要大量RGO才能保证脱色完全,不如生物降解法环保经济.而使用白腐菌生物降解法虽可以彻底降解染料,但耗时长、效率低.综上所述,在生物治理污水中的染料时,可以适量引入低浓度的RGO,在确保白腐菌生长的条件下,加快染料脱色速率.
3 结论
在染料脱色过程中,RGO对白腐菌的毒性主要体现在白腐菌鲜重增加、干重减少,但是对环境pH几乎无影响.白腐菌降解染料的过程可以受到RGO刺激而加速,其贡献包括白腐菌的降解作用和石墨烯的吸附作用.还原态的石墨烯对白腐菌处理污水的影响较小,具有较高的环境生物安全性.
[1]LEVIN L,PAPINUTTI L,FORCHIASSIN F.Evaluation of Argentinean white rot fungi for their ability to produce lignin-modifying enzymes and decolorize industrial dyes[J].Bioresource Technology,2004,94(2):169-176.
[2]PALMIERI G,CENNAMO G,SANNIA G.Remazol Brilliant Blue R decolourisation by the fungusPleurotus ostreatus and its oxidative enzymatic system[J].Enzyme and Microbial Technology,2005,36(1):17-24.
[3]闫松林,周从直.白腐菌处理废水的影响因素及发展趋势水处理技术[J].水处理技术,2002,28(5):306-307.
[4]WANG F,GUO C,LIU H Z,et al.Immobilization of Pycnoporus sanguineus laccase by metal affinity adsorption on magnetic chelator particles[J].Journal of chemical technology and biotechnology,2008,83(1):97-104.
[5]YAO W,NOKES S E.Phanerochaete chrysosporium pretreatment of biomass to enhance solvent production in subsequent bacterial solid-substrate cultivation[J].Biomass & Bioenergy,2014,62:100-107.
[6]应惠芳,黄民生,林巍.5种自腐真菌对染料脱色降解的实验研究[J].上海环境科学,2001,20(4):171-174.
[7]NOVOSELOV K S,GEIM A K,MOROZOV S V,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306(5696):666-669.
[8]GEIM A K.Graphene:status and prospects[J].Science,2009,324(5934):1530-1534.
[9]LIU J,CUI L,LOSIC D.Graphene and graphene oxide as new nanocarriers for drug delivery applications[J].Acta biomaterialia,2013,9(12):9243-9257.
[10]DAI L.Functionalization of graphene for efficient energy conversion and storage[J].Accounts of chemical research,2012,46(1):31-42.
[11]BASU S,BHATTACHARYYA P.Recent developments on graphene and graphene oxide based solid state gas sensors[J].Sensors and Actuators B:Chemical,2012,173:1-21.
[12]YU B,ZHANG X,XIE J,et al.Magnetic graphene sponge for the removal of methylene blue[J].Applied Surface Science,2015,351:765-771.
[13]GUO Z,CHEN G,LIU L,et al.Activity variation of Phanerochaete chrysosporium under nanosilver exposure by controlling of different sulfide sources[J].Scientific reports,2016,6:20813.
[14]GUO Z,CHEN G,ZENG G,et al.Determination of inequable fate and toxicity of Ag nanoparticles in a Phanerochaete chrysosporium biofilm system through different sulfide sources[J].Environmental Science:Nano,2016,3(5):1027-1035.
[15]ZUO Y,CHEN G,ZENG G,et al.Transport,fate,and stimulating impact of silver nanoparticles on the removal of Cd(II)by Phanerochaete chrysosporium in aqueous solutions[J].Journal of hazardous materials,2015,285:236-244.
[16]DE FILPO G,PALERMO A M,RACHIELE F,et al.Preventing fungal growth in wood by titanium dioxide nanoparticles[J].International Biodeterioration & Biodegradation,2013,85:217-222.
[17]TAGHIYARI H R,MORADI-MALEK B,KOOKANDEH M G,et al.Effects of silver and copper nanoparticles in particleboard to control Trametes versicolor fungus[J].International Biodeterioration&Biodegradation,2014,94:69-72.
[18]ZHAO L,YU B,XUE F,et al.Facile hydrothermal preparation of recyclable S-doped graphene sponge for Cu2+adsorption[J].Journal of hazardous materials,2015,286:449-456.
[19]FERNÁNDEZ-MERINO M J,GUARDIA L,PAREDES J I,et al.Vitamin C is an ideal substitute for hydrazine in the reduction of graphene oxide suspensions[J].The Journal of Physical Chemistry C,2010,114(14):6426-6432.

