宰前管理对小尾寒羊应激及肉质的影响
唐善虎,郑渝川,李思宁,陈 驰,张 振
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.新疆疆南牧业有限公司,新疆 图木舒克 843900)
动物宰前应激会减少屠宰时肌糖原的供给,导致肌肉最终pH偏高,容易形成深色、坚硬、干燥的DFD肉[1].一般情况下,屠宰场不为动物提供食物,仅提供饮水,宰前休息就能恢复动物运输过程中的应激和疲劳,恢复肌糖原储备.但是,禁食时间过长会对羊的活重、胴体重及肌肉糖原含量产生负面影响[2],产生DFD肉.因此,确定合理的宰前休息时间对宰后羊肉品质改善有重要意义.
新疆的绵羊养殖量居全国第二,但屠宰方法对羊产生了较大的应激.在实际生产中,羔羊一般在早上运送至屠宰场,并立即宰杀,羔羊面临了较大的宰前应激.同时,新疆部分羔羊采用放牧饲养的形式,在宰前可能有较大的运动量或人为长距离的驱赶行为,这些情况都可能会影响宰后肌肉的质量.在新疆广泛饲养的小尾寒羊是我国肉裘兼用型绵羊品种,因生长发育快、早熟、繁殖力强、性能遗传稳定、适应性强,被人们誉为中国“国宝”.
不同品种羊的应激水平、糖酵解潜力、极限pH值、肉质有较大差异[3],中国国家标准 GB 18393—2001建议牛羊宰前应进入待宰圈禁食静养12~24 h,这个标准是否适合小尾寒羊屠宰尚需要进一步的研究;国外有些研究表明,宰前休息12~24 h会使牛肉品质明显下降[4],小尾寒羊最佳宰前休息时间需试验确定.因此,本研究目的在于评价运动驱赶应激和不同宰前休息时间对绵羊肉质的影响,为小尾寒羊宰前管理提供依据.
1 材料与方法
1.1 动物
在新疆疆南牧羊养殖场随机挑选出50头130~160日龄雄性小尾寒羊,进行编号称重,体重为(30±4)kg,所有试验用小尾寒羊在相同的饲养管理下进行.
1.2 主要试剂
葡萄糖试剂盒、乳酸试剂盒,购自南京建成生物科技有限公司;淀粉葡萄糖酸苷酶(10万U/mL),购自上海阿拉丁公司;1,1,3,3-四乙氧基丙烷,购自比利时ACRO公司;高氯酸、氢氧化钾、醋酸钠、硫代巴比妥酸、三氯乙酸(分析纯),购自成都科龙有限公司.
1.3 主要仪器
Lab pH Meter(型号为 MP511),购自意大利HANNA公司;质构仪(型号为TA-XT Plus),购自英国Stable Micro Systems公司;便携式色差仪(型号为CR-400),购自日本Konica Minolta公司;紫外可见分光光度计(型号为UV2100),购自上海尤尼柯仪器有限公司.
1.4 试验设计
50头绵羊经30 min的运输到达屠宰场,分为2组进入不同的待宰休息室,每组25头,提供充足的饮水,在当日21:00对羊饲喂精料补充料.第2天,两组绵羊分别在屠宰场经过0 min和20 min的运动,随后将绵羊赶回待宰栏休息0,2,6,12,24 小时(n =5),休息结束后立即宰杀.待宰栏是铁栅栏圈围的,四面透风的,地面铺设的是塑料漏板.羊在待宰栏的初始密度为1 m2/只羔羊,随着羔羊分时间段宰杀其密度减少;羊只运动是在屠宰场空旷的沙地进行,工作人员使用声音及其跑动促使羊只运动20 min,在这个过程中,没有明显与羔羊发生肢体接触,运动结束后能明显看到羊强烈喘气,行动速度减慢.宰前休息过程中禁食但供绵羊自由饮水.将休息完毕的羊只悬挂于屠宰线,使用清真的屠宰方法进行屠宰;按屠宰规程剥皮摘掉内脏头蹄,完成宰后检疫;将冲洗干净的胴体推入1~4℃的排酸间成熟.
1.5 采样程序
采取羊胴体背最长肌.取羊第11肋骨和12肋骨之间背最长肌测定pH值、肉色;取羊第10肋骨和11肋骨之间背最长肌测定滴水损失、蒸煮损失、解冻损失、剪切力;取羊第8肋骨和9肋骨之间背最长肌,快速冻结,用于测定糖酵解潜力、TBARS值.
1.6 指标测定
1.6.1 pH值
测定宰后胴体 45 min,1,1.5,2,2.5,3,3.5,4,4.5,5,5.5,6,10,16,24 小时的 pH 值.计算宰后 45 min~6 h和45 min~24 h的曲线斜率用于评估pH值下降速度[5].
1.6.2 糖酵解潜力
糖酵解潜力的测定参考Zhang等报道的方法进行[5].葡糖糖和乳酸含量使用试剂盒测定.糖酵解潜力的公式为:糖酵解潜力=2×糖原+乳酸.
1.6.3 肉色
测定宰后45 min和24小时的肉色.在羊背最长肌第11肋骨和12肋骨处取厚度不小于1.5 cm的背最长肌用便携式色度仪测定L∗值、a∗值和b∗值.色差计进行白板校正后,将色差计探头垂直放在样品横断面上测量,每个肉样重复测定3次,取均值作为该肉样的色差值.
1.6.4 保水性
参考Christensen的方法测定宰后24小时的滴水损失[6].参考Li的方法略作修改测定解冻损失[7].
1.6.5 剪切力
用质构分析仪(TA-XT2i英国Stable Micro System)的HDP/BS W探头测定肉柱的剪切力值:测前速度1.0 mm/s,测中速度 1.0 mm/s,测后速度 5.0 mm/s,时间间隔5 s[8].
1.6.6 TBARS值
TBARS的测定按照Salih的方法进行[9].TBARS值通过 1,1,3,3-四乙氧基丙烷(ACROS,产品编号156730050,比利时)标准曲线定量,结果表示为 mg(MDA)/kg样品.
1.6.7 数据的统计学分析
数据以“平均值 ±标准误”的形式表达,采用SPSS 19进行单因素方差分析、Duncan差异显著性分析和Pearson相关性分析,P<0.05表示差异显著,P<0.01表示差异极显著.
2 结果与讨论
2.1 pH值
宰后6个时间点羊胴体的pH值见表2.两组羔羊经0 h、2 h、6 h、12 h、24 h 宰前休息,宰后 45 min,3,6,10,16,24 小时的胴体 pH 差异极显著(P <0.0001).羔羊随着宰前休息时间的延长,pH45min值分别由休息0 h的7.54和7.52降至休息24 h的6.78和6.77,pH45min值明显降低;pH24h值分别由休息0 h的6.05和6.21降至休息24 h的5.58和5.65,pH24h明显降低.运动0 min和运动20 min休息0 d的羔羊宰后pH45min没有显著差异,而 pH24h差异显著(P<0.05),分别为6.05和6.21.经过6 h休息的羔羊宰后pH24h值都能降至6以下,经24 h休息的羔羊pH24h值最低.
不同运动时间和休息时间羔羊宰后pH值下降斜率见表1.斜率的绝对值越大,说明羔羊的成熟的过程中pH值下降越快.不休息的两组羔羊在宰后45 min~6 h pH值下降斜率绝对值最高,休息6 h的两组羔羊在宰后45 min~6 h pH值下降斜率绝对值最低;不同的休息时间对羔羊宰后pH值下降斜率影响差异极显著(P<0.01),运动时间对羔羊宰后休息0,6,12 h的pH值下降斜率差异显著(P<0.05).运动后休息0 h的羔羊斜率绝对值显著低于不运动的羔羊,运动能降低后熟过程中羊肉的pH值下降速度,宰前休息能改善这一现象.
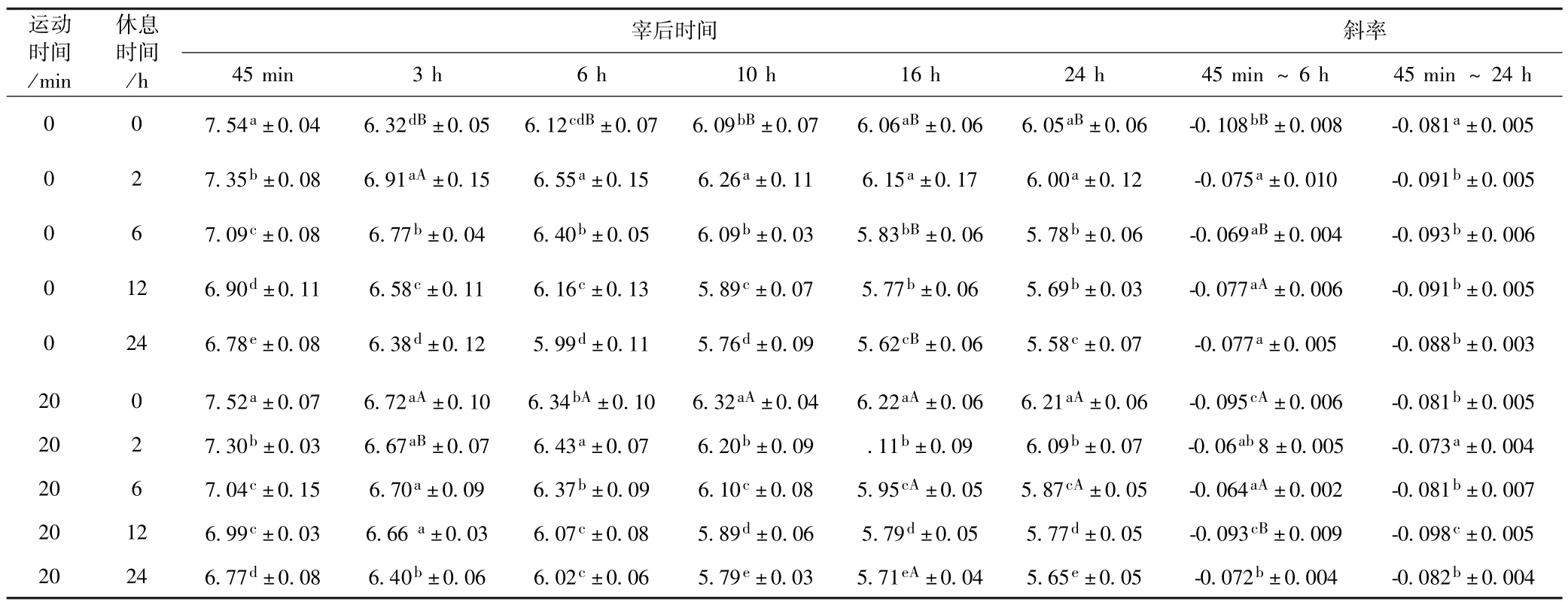
表1 宰后各时间点羊胴体的pH值和pH值下降斜率Table 1 pH value and pH fall slope of lamb carcass at various times of postmortem
2.2 糖酵解潜力
不同运动时间和休息时间羔羊宰后45 min羊肉的糖酵解潜力见图1.经过20 min运动的羔羊背肌的糖酵解潜力值明显低于运动0 min的羔羊.运动0 min的羔羊休息2 h后糖酵解潜力显著上升,休息6 h后,糖酵解潜力显著下降(P<0.05).运动20 min的羔羊糖酵解潜力在休息0,2,6 h阶段持续下降,在休息6,12,24 h阶段背肌中糖酵解潜力保持稳定 (47.77~49.64 μmol/g),差异不显著(P >0.05).
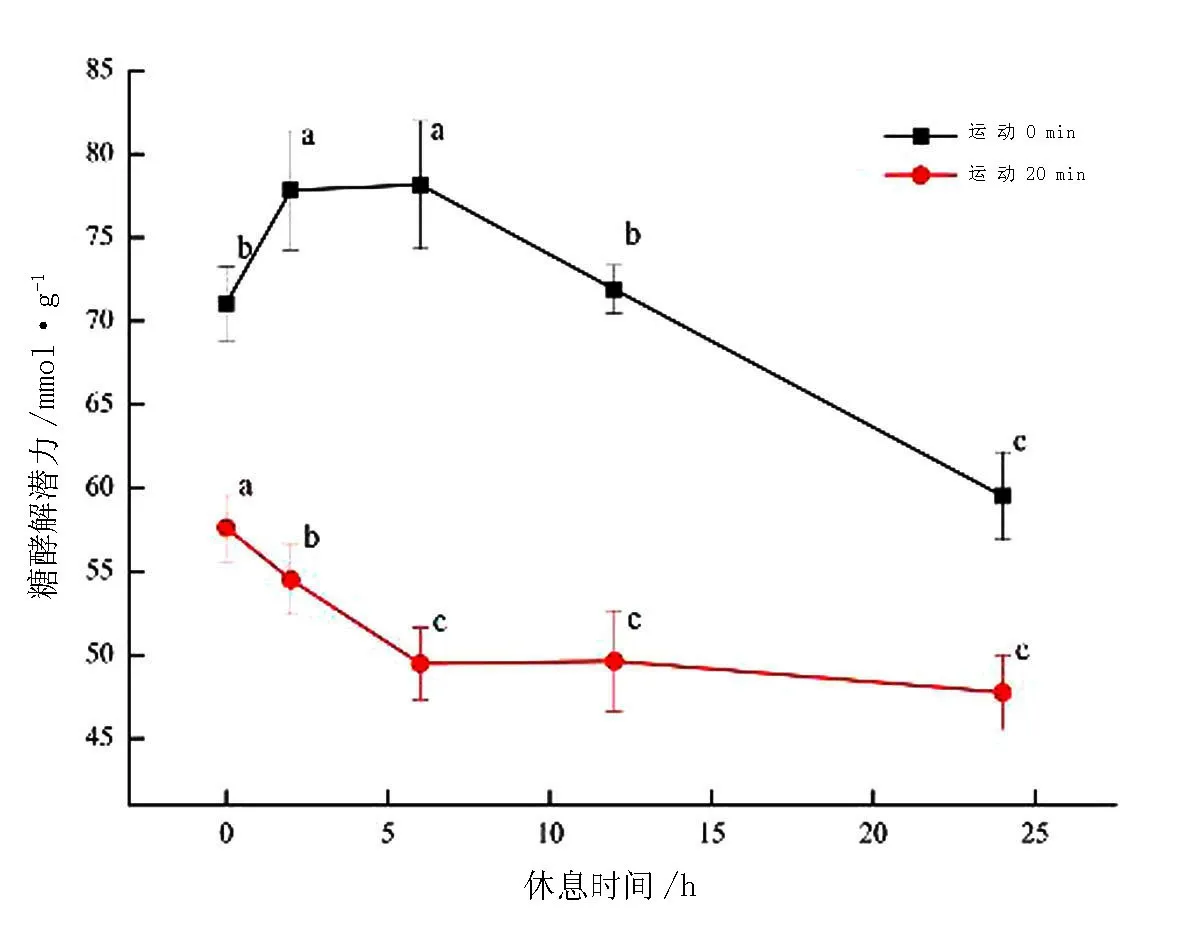
图1 不同运动时间和休息时间羔羊宰后45 min羊肉的糖酵解潜力Fig.1 Postmortem glycolytic potential of the lamb at 45 min treated with different exercise time and rest time
2.3 肉色
宰后45 min和24 h羊胴体的色差值见表2.羔羊宰前休息时间与宰后45 min背最长肌的L∗值、a∗值、b∗值呈反比;宰后24 h背最长肌的L∗和b∗值随休息时间延长呈先降低后上升的趋势,a∗值差异不显著.宰后45 min,休息0 h的两组羔羊其肌肉表现出了较高的L∗值,休息24 h的两组羔羊a∗值显著低于其他处理组(P<0.05);宰后24 h,运动0 min休息0 h的羔羊背肌L∗值显著高于其他处理组(P<0.05).
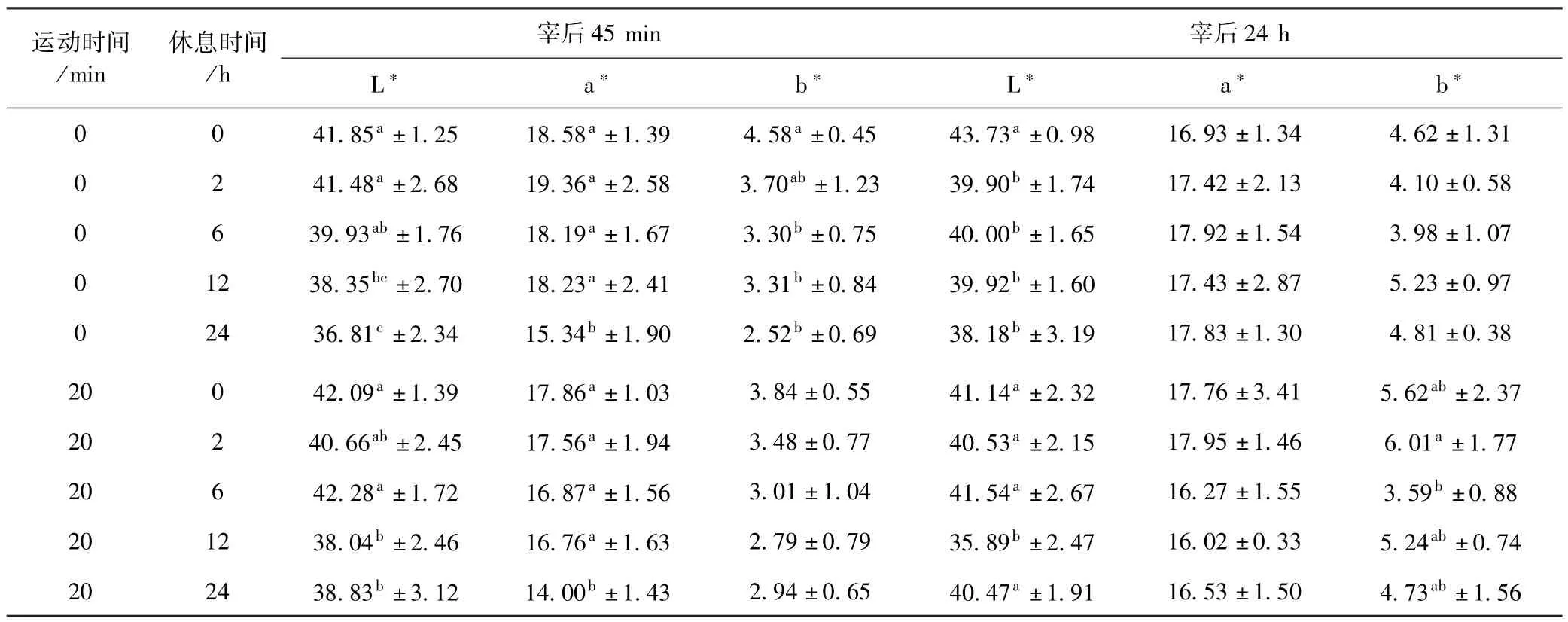
表2 不同运动时间和休息时间的羔羊宰后45 min和24 h羊肉的色差值Table 2 Postmortem color parameters at 45 min and 24 h of the lamb treated with different exercise time and rest time
2.4 保水性
宰后24 h羊肉的系水力参数见表3.系水力参数的差异主要表现在不同的休息时间,而运动时间对其影响差异不显著(P<0.05).休息0 h和休息24 h的羔羊均表现出了较高的滴水损失、解冻损失和蒸煮损失,但不同休息时间仅对不运动羔羊的滴水损失差异极显著(P=0.008).系水力是肉重要的经济指标,运动0 min休息2,6,12 h相比不休息的羔羊滴水损失平均值降低了0.37% ~0.55%、解冻损失平均值降低了0.47% ~0.81%、蒸煮损失平均值降低了0.16%~0.93%;不运动休息24 h背肌系水力均高于休息2、6、12 h的羔羊.运动20 min相比运动0 min的羔羊背肌系水力有相似的变化趋势,休息0 h和休息24 h的羔羊背肌均有较高的滴水损失、解冻损失和蒸煮损失.宰前对羔羊系水力影响不显著(P<0.05).
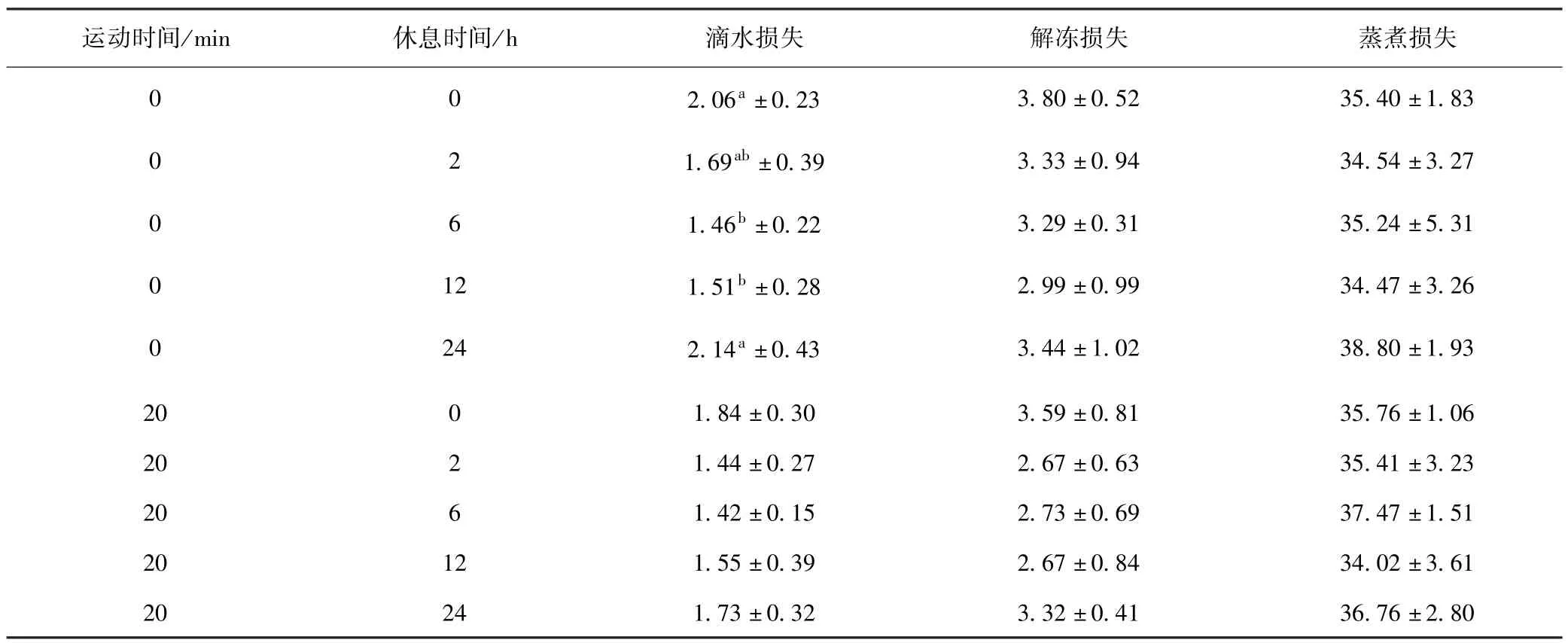
表3 不同运动时间和休息时间的羔羊宰后24 h羊肉的保水性(%)Table 3 Postmortem water-holding capacity of the lamb at 24 h treated with different exercise time and rest time(%)
2.5 剪切力
不同运动时间和休息时间对羔羊宰后24 h羊肉的剪切力见图2.结果显示,无论是否运动,宰前休息均能显著的影响肌肉的嫩度(P<0.05).运动20 min不休息的羔羊的背肌的剪切力最低,为63.11 N;无论是否运动,休息了24 h的羔羊背肌表现出了最高的剪切力,运动0 min的羔羊休息24 h背肌剪切力相比休息0,2,6,12 h的羔羊显著升高(P <0.05).
2.6 TBARS值
不同运动时间和休息时间羔羊宰后24 h羊肉的TBARS值见图3.经过运动休息了0,2,6,12 h的羔羊背肌TBARS值高于不运动的羔羊.虽然经过不同休息时间的两组羔羊TBARS值差异显著(P<0.05),但是它们的TBARS值都处于一个较低的水平,并不会影响肉品的质量.
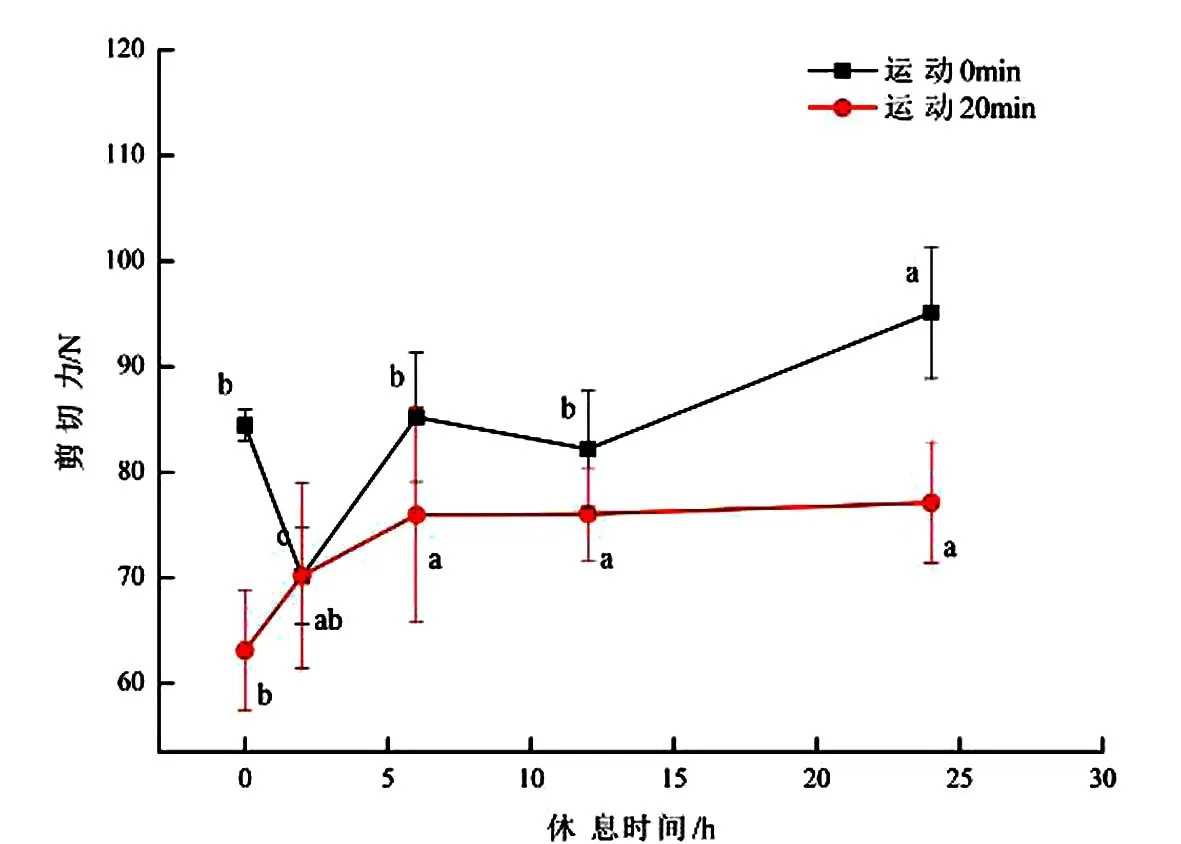
图2 不同运动时间和休息时间羔羊宰后24h羊肉的剪切力Fig.2 Shear force of the lamb at 24h postmortem with different exercise time and rest time
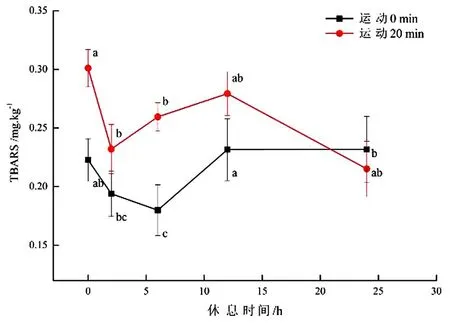
图3 不同运动时间和休息时间羔羊宰后24 h羊肉的TBARS值Fig.3 TBARS value of the lamb at 24h with different exercise time and rest
一般认为,肌肉 pH45min值 <6时为 PSE肉[10],pH24h值>6时为DFD肉.两组羔羊宰后休息0 h和2 h的羔羊pH24h值≥6,可以被定义为DFD肉,但是肌肉外观并没有明显的DFD肉特征.此外,羔羊胴体不易产生PSE肉.休息0,2,6 h的羊有较高的初始pH值(7以上),有可能是因为宰前短时应激和陌生的环境加快了羔羊能量消耗,导致pH值升高.Zimerman等[11]将山羊禁食休息18 h,狗吠和驱赶运动的羔羊的极限pH值与无应激源处理的对照组差异不显著,而经过狗吠恐吓的羔羊初始pH值显著高于对照组.Bond等[12]研究发现,不经运动的羔羊pH值有更快的下降速度,运动过后的羔羊有更高的pHu,这些结果与本研究一致.
禁食和休息在一定程度上帮助家畜恢复体内肌糖原的储备,不运动休息0 h的羔羊糖酵解潜力显著低于休息2 h和6 h的羔羊;而经过运动的羔羊,休息2和6 h糖酵解潜力呈下降趋势,是由于运动使肌肉乳酸水平快速升高,休息使乳酸含量降低.长时间的禁食会导致猪肌肉乳酸和糖原含量的下降,极限pH值增高[13],但是反刍动物牛和48 d幼羊对24 h和12 h的休息禁食时间并不敏感[4,14],随着禁食休息时间的延长,极限pH值越低,肝糖原含量显著降低.Bond等[12]研究发现,经运动的羔羊宰后30 min肌糖原相比不运动的羔羊显著降低,并在宰后24 h肌肉中的糖原耗尽.
休息24 h的羔羊背肌有最低的pH45min和pH24h,Ledward等[15]认为低的pH值可以降低氧气消耗酶的活性,而增加高铁肌红蛋白还原酶活性,并在一定时间范围内肉色稳定性较高,但低pHu肉的a∗值处于一个较低的水平,影响肉色的鲜艳程度.不同宰前休息时间对肉色参数有较明显的影响,而运动时间对其影响不大;Zimerman等[11]将山羊禁食休息18 h,狗吠和驱赶运动的羔羊肉色与无应激源处理的对照组差异不显著.Bond等[12]的研究表明经运动后的羔羊肌肉a∗值小于不运动的羔羊,与本研究结果一致.
宰后肌肉快速冷却能降低pH值的下降速率可以明显降低汁液损失[16].蒸煮损失的变化趋势与肌肉的pHu值呈负相关,蒸煮损失随着pH值的上升而降低[17].肌肉的汁液损失与僵直过程中肌纤维的收缩程度有关[18],pHu越接近等点电5.4,肌肉收缩越大,其系水力越差.Zimerman等[11]将山羊禁食休息18 h,狗吠和驱赶运动的羔羊系水力与无应激源处理的照组差异不显著.Bond和Warner等[5,12]以往的研究表明运动应激能增加羔羊肌肉滴水损失和蒸煮损失,Bond等[19]进一步研究发现:运动能改变羔羊肌肉的离子分布和蛋白质水解从而减少了肌肉结合或保持水分的能力.
我们的研究结果表明,运动后的羔羊有更高pH24h.经过20 min运动的羔羊相比不运动的羔羊有较低的剪切力,这与 Zimerman、Warner等[5,11]的研究结果一致.Bond[12]等研究发现,经运动的羔羊宰后24 h的剪切力比不运动的羔羊略低,但宰后3 d不运动的羔羊剪切力更低,但Bond[19]进一步的研究数据显示,羔羊运动对肉的嫩度影响没有统计学差异.Daly等[20]的报道发现,宰前运动20 min的羔羊其肌肉韧性增强.运动对肉嫩度的影响可能是因为改变了最终pH值(pHu),肌肉的pHu对肉的嫩度存在一定的影响,尤其是DFD肉的嫩度相对较好[21-22].肌肉的pHu越低,越接近蛋白质等电点,肌肉组织越容易发生不可逆的收缩,导致肉嫩度变差.有研究报道当pHu处于5.4~6之间,嫩度随着pHu的增大而降低,当pHu大于6时,嫩度又开始提高[23-24],也有研究发现宰后肉的嫩度与pHu呈正相关[25];本试验的结果更接近于后者的报道.
TBARS一般表示脂肪氧化的二级产物或终极产物,最主要的是丙二醛.张强的研究结果表明,肌肉运动损伤家兔的丙二醛含量较对照组显著升高,丙二醛与自由基的改变有一定的相关性[26].
本研究将小尾寒羊宰前运动0 min和20 min并圈养休息0,2,6,12,24 h.观察到运动会对羔羊产生应激,休息0,24 h的羔羊有较高的应激水平;羔羊背肌pH45min值和pH24h值随着休息时间的延长而降低,休息0 h和2 h的羊背肌pH24h值>6,但无明显的DFD肉特征;糖酵解潜力随着休息时间的延长而降低;不同休息时间对宰后肉色参数L∗有显著影响,而运动对肉色影响不大;宰前休息对运动0 min的羔羊背肌滴水损失有显著的影响(P<0.05),休息0 h和24 h的羔羊背肌系水力较差;运动能提高羊肉嫩度.综合试验结果,我们认为在实际生产中,小尾寒羊宰前休息6~12 h较合适.
[1]张林.运输应激对肉仔鸡肌肉品质的影响及其机理[D].陕西:西北农林科技大学,2009.
[2]夏安琪.宰前管理对宰后羊肉品质的影响[D].北京:中国农业科学院,2014.
[3]马晓冰,苏琳,林在琼,等.不同品种肉羊肌肉的糖酵解潜力及其与肉品质的相关性[J].食品科学,2015,36(15):1-4.
[4]FERREIRA G B,ANDRADE C L,COSTA F,et al.Effects of transport time and rest period on the quality of electrically stimulated male cattle carcasses[J].Meat Science,2006,74(3):459-466.
[5]ZHANG L,YUE H Y,ZHANG H J,et al.Transport stress in broilers:I.Blood metabolism,glycolytic potential,and meat quality[J].Poultry Science,2009,88(10):2033-2041.
[6]CHRISTENSEN L B.Drip loss sampling in porcine m.longissimus dorsi[J].Meat Science,2003,63(4):469-477.
[7]LI C B,LIU D Y,ZHOU G H,XIA T L.Meat quality and cooking attributes of thawed pork with different low field NMR T21[J].Meat Science,2012,92(2):79-83.
[8]李桂霞,李欣,李铮,等.宰后僵直及成熟过程中羊背最长肌理化品质的变化[J].食品科学,2016,38(21):112-118.
[9]WARNER R D,FERGUSON D M,MCDONAGH M B,et al.Acute exercise stress and electrical stimulation influence the consumer perception of sheep meat eating quality and objective quality traits[J].Animal Production Science,2005,45(5):553-560.
[10]BENDALL J R,SWATLAND H J.A review of the relationships of pH with physical aspects of pork quality[J].Meat Science,1988,24(2):85-126.
[11]ZIMERMAN M,GRIGIONI G,TADDEO H,et al.Physiological stress responses and meat quality traits of kids subjected to different preslaughter stressors[J].Small Ruminant Research,2011,100(23):137-142.
[12]BOND J J,CAN L A,WARNER R D.The effect of exercise stress,adrenaline injection and electrical stimulation on changes in quality attributes and proteins in Semimembranosus muscle of lamb[J].Meat Science,2004,68(3):469-477.
[13]ZHEN S,LIU Y,LI X,et al.Effects of lairage time on welfare indicators,energy metabolism and meat quality of pigs in Beijing[J].Meat Science,2013,93(2):287-291.
[14]DÍAZ MT,VIEIRA C,PÉREZ C,et al.Effect of lairage time(0h,3h,6h or 12h)on glycogen content and meat quality parameters in suckling lambs[J].Meat Science,2014,96(2):653-660.
[15]LEDWARD D A.Post-slaughter influences on the formation metmyoglobin in beef muscles[J].Meat Science,1985,15(3):149-171.
[16]SPRINGER M P,CARR M A,RAMSEY C B,et al.Accelerated chilling of carcasses to improve pork quality[J].J Animal Science,2003,81(6):1464-1472.
[17]NOLLET L M L,TOLDRÁ F.Handbook of muscle foods analysis[M].New York:CRC Press,2008.
[18]MARSH B B,CASSENS R G,KAUFFMAN R G,et al.Hot boning and pork tenderness[J].Journal of Food Science,1972,37(1):179-180.
[19]BOND J J,WARNER R D.Ion distribution and protein proteolysis affect water holding capacity of Longissimus thoracis et lumborum in meat of lamb subjected to antemortem exercise[J].Meat Science,2007,75(3):406-414.
[20]DALY C C,SIMMONS N J,DEVINE C E.Proceedings of the 48th annual reciprocal meat conference[C].America:Reciprocal Meat Conference of the American Meat Science Association,1995.
[21]YU L.P,LEE Y B.Effects of Postmortem pH and Temperature Muscle Structure and Meat Tenderness[J].Journal of Food Science,1986,51(3):774-780.
[22]FJELKNERMODIG S,RUDÉRUS H.The influence of exhaustion and electrical stimulation on the meat quality of young bulls:Part 2-Physical and sensory properties.[J].Meat Science,1983,8(3):203-220.
[23]PURCHAS R W,AUNGSUPAKORN R.Further investigations into the relationship between ultimate pH and tenderness for beef samples from bulls and steers.[J].Meat Science,1993,34(2):163-178.
[24]SIMMONS N J,AULD M M,THOMSON B,et al.Proceedings of the New Zealand Society of Animal Production[C].New Zealand:Editorial Services,Limited,2000.
[25]HOWARD R D,JUDGE M D.Comparison of Sarcomere Length to Other Predictors of Beef Tenderness[J].Journal of Food Science,1968,33(5):456-460.
[26]张强,韩长磊.静态负荷致肌肉损伤的生物标志物探讨[J].中国工业医学杂志,2008,21(3):176-177.

