多发性骨髓瘤患者外周血Tc17细胞、髓系来源的抑制性细胞比例和IL-17水平变化及其意义
沈婵娟,钟永,袁朝晖,胡国瑜
(1株洲市中心医院,湖南株洲412000;2中南大学湘雅医院)
多发性骨髓瘤是一种好发于中老年的血液系统常见恶性肿瘤,其发病率约占所有恶性肿瘤的1%,占血液系统肿瘤的10%~15%,近年发病率逐渐增高且发病年龄有年轻化趋势[1]。多发性骨髓瘤自然病程为6~12个月,接受传统药物化疗后中位生存期为3~5年。新的靶向药物如蛋白酶体抑制剂硼替佐米、雷利度胺的出现提高了多发性骨髓瘤的临床疗效,但总体疗效仍不尽人意[2]。因此迫切需要研究更有效的治疗手段,如免疫治疗等[3]。细胞毒性T细胞17(Tc17)是近年发现的一类可分泌IL-17的CD8+T细胞亚群[4]。近年研究表明Tc17细胞在小鼠体内具有抗肿瘤效应[5,6],但也有文献报道Tc17细胞在肿瘤免疫逃逸机制中发挥重要作用[7,8]。髓系来源的抑制性细胞(MDSCs)是近年研究发现的一类具有免疫调节功能的免疫细胞亚群,它可以通过多种途径抑制机体的免疫应答反应,在炎症、自身免疫和移植免疫中发挥重要作用[9]。对于MDSCs与Tc17细胞比例在多发性骨髓瘤中是否有相关性尚待进一步研究。为此,我们观察了多发性骨髓瘤患者外周血Tc17细胞、MDSCs比例和血浆IL-17水平的变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 2012年1月~2015年12月株洲市中心医院血液科收治的新发多发性骨髓瘤患者41例(病例组);男25例、女16例;年龄31~78岁、中位年龄61岁;按国际分期体系(ISS)进行分期,ISSⅠ期10例、ISSⅡ期16例、ISSⅢ期15例;不合并幽门螺杆菌、乙型肝炎病毒、丙型肝炎病毒、HIV、梅毒等细菌病毒感染,无伴发自身免疫性疾病。选择健康体检志愿者19例为正常对照(对照组),其中男12例、女7例,年龄25~60岁、中位年龄47岁。
1.2 主要试剂 PE-Cy5标记的CD3抗体,APC标记的鼠抗人CD3抗体,FITC标记的CD8抗体,FITC标记的鼠抗人CD4、CD14抗体,PE-Cy5标记的鼠抗人CD25抗体,PE标记的鼠抗人CD127、HLA-DR抗体,PE标记的IL-17抗体,同型对照APC、PE、FITC、PE-Cy5标记的鼠IgG1免疫球蛋白均购自eBioscience公司;细胞因子刺激剂佛波酯(PMA)和离子霉素(Ionomycin)购于Sigma公司;细胞固定-透膜试剂盒、高尔基阻断剂Golgistop购自BD公司。
1.3 外周血Tc17细胞比例测算 将两组肝素抗凝血以PBS稀释后,用Ficoll密度梯度离心法获取外周血单个核细胞(PBMC),调整细胞密度为106/mL,铺于平底48孔板,加入50 ng/mL的PMA、1 μg/mL的Ionomycin及Golgistop即用型高尔基体阻断剂。于37 ℃、5% CO2培养箱中刺激培养5 h,然后取出细胞测算Tc17细胞比例。
1.4 外周血MDSCs比例测算 取刺激培养后的PBMC,加入CD3、CD8抗体及同型对照抗体,4 ℃避光孵育20 min,流式洗液洗涤2次,加入Fix固定液,4 ℃避光固定30 min,然后Perm/wash通透洗液洗涤2次,再加入胞内分子IL-17A抗体及同型对照抗体,4 ℃避光孵育30 min,Perm/wash通透洗液洗涤2次后流式细胞仪测算CD3+CD8+IL-17A+细胞占CD8+T细胞比例。采用Ficoll-Hypaque密度梯度离心法分离PBMC,调整细胞密度为107/mL,吸取100 μL细胞悬液加入流式管中,采用CD14、HLA-DR抗体标记,同时标记同型对照,4 ℃避光孵育30 min,PBS洗涤2次,用BD公司生产的Aria流式细胞仪检测CD14+HLA-DR-/low细胞,此即MDSCs细胞。计算MDSCs占PBMC的比例。
1.5 血浆IL-17检测 采用ELISA法检测血浆IL-17。试剂盒购自eBioscience公司。各项操作严格按说明书进行。
1.6 统计学方法 采用SPSS24.0软件进行数据处理。计量资料两样本间均数比较采用t检验。相关性分析采用Spearman相关分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血Tc17细胞、MDSCs比例和血浆IL-17水平比较 病例组、对照组外周血Tc17细胞比例分别为3.06%±1.77%、0.75%±0.45%,MDSCs比例分别为6.60%±3.38%、2.53%±0.85%,血浆IL-17水平分别为(45.64±16.93)、(13.10±4.50)pg/mL,病例组外周血Tc17细胞、MDSCs比例和血浆IL-17水平均高于对照组(P均<0.01)。
2.2 多发性骨髓瘤患者外周血Tc17细胞比例与MDSCs比例、血浆IL-17水平的相关性 41例多发性骨髓瘤患者外周血Tc17细胞比例与血浆IL-17水平无相关性(R=0.30,P>0.05);Tc17细胞比例与MDSCs比例无相关性(R=0.160,P>0.05)。
2.3 外周血Tc17细胞比例与多发性骨髓瘤临床病理参数的关系 多发性骨髓瘤患者外周血Tc17细胞比例与患者性别、年龄、ISS分期、LDH水平、血肌酐水平均无明显相关性(P均>0.05)。详见表1。
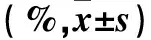
表1 外周血Tc17细胞比例与多发性骨髓瘤临床病理参数的关系
3 讨论
2009年,Hamada等[4]在感染流感病毒的小鼠模型中发现了产生IL-17的CD8+T细胞亚群,这群细胞在细胞分化和细胞毒性功能上与经典细胞毒T细胞存在差异,因此将其定义为Tc17细胞。近年有许多研究报道Tc17细胞在感染和自身免疫性疾病中发挥作用[10]。有关Tc17细胞的分化调控和可塑性研究多来源于自身免疫性疾病模型,但近年也有研究报道Tc17细胞在人和小鼠肿瘤免疫中发挥作用。有学者[5]报道Tc17细胞在小鼠黑色素瘤模型中具有抗肿瘤效应,可能和Th17细胞类似,IFN-γ可能是Tc17细胞介导抗肿瘤效应的关键细胞因子。有学者[6]将体外诱导产生的肿瘤抗原特异性的Tc17细胞回输至黑色素瘤小鼠模型体内,发现它们可以通过募集中性粒细胞和巨噬细胞富集至肿瘤局部,诱导肿瘤细胞凋亡,和Tc1细胞一样具有抗肿瘤作用。在人体肿瘤相关研究中也发现了Tc17细胞可能具有抗肿瘤效应。有学者[11]报道在肺腺癌患者外周血中Tc17细胞比例较正常人降低,手术后患者外周血Tc17细胞比例较术前明显增加。研究[12]报道胃癌患者外周血中Tc17细胞比例较正常对照明显降低,且Tc17细胞比例与Th17细胞比例呈负相关。Jiang等[13]发现甲状腺癌患者外周血中Tc17细胞比例和绝对数较正常对照均显著降低,同时Tc17细胞比例与肿瘤大小呈负相关。
然而,与以上结论不同,也有研究者发现Tc17细胞可能具有促瘤作用:Tsai等[8]发现头颈鳞癌患者外周血Tc17细胞比例显著高于健康对照,同时随疾病进展、Tc17细胞比例增加,Tc17细胞与调节性T细胞比例呈正相关。Zhuang等[7]发现胃癌组织中的Tc17细胞比例高于外周血、癌旁组织及正常组织,且与患者预后呈负相关,Tc17细胞能促进MDSC细胞的趋化,从而促进肿瘤进展。
早在20多年前已有学者在小鼠肺癌肿瘤模型发现了MDSC[14]。近年越来越多的文献报道显示,MDSC在肿瘤及多种其他疾病中参与免疫反应的负性调节。研究[15]报道CD11b+CD14-HLA-DR-CD33+在多发性骨髓瘤患者中可分离鉴定MDSC。肿瘤细胞和宿主细胞分泌至肿瘤微环境中的各种细胞因子(如TGF-β、IL-1β、IL-6、IL-10、IL-12、IL-13)、趋化因子(如CCL2、CXCL-2、CXCL12)或生长因子(如GM-CSF、G-CSF、M-CSF、SCF)都能诱导MDSCs的产生[16]。文献报道[17]多发性骨髓瘤细胞可表达IL-17R,而Tc17细胞可分泌IL-17,因此我们推测在多发性骨髓瘤微环境中Tc17细胞可通过分泌IL-17使多发性骨髓瘤细胞分泌某些趋化因子,进而募集MDSC细胞发挥抑制肿瘤免疫的功能,进而实现免疫逃逸。
本研究结果显示,病例组外周血Tc17细胞、MDSCs比例和血浆IL-17水平均高于对照组,然而多发性骨髓瘤患者外周血Tc17细胞比例与血浆IL-17水平和MDSCs比例无相关性,提示在多发性骨髓瘤患者体内,Tc17细胞可能通过分泌产生其他细胞因子间接参与多发性骨髓瘤的发生、发展。进一步分析Tc17细胞比例与多发性骨髓瘤临床病理参数的关系发现,多发性骨髓瘤患者外周血Tc17细胞比例与患者性别、年龄、ISS分期、LDH水平、血肌酐水平均无明显相关性,这可能与本研究临床样本偏少有关,我们将进一步扩大样本量验证上述结果。
综上所述,本研究发现多发性骨髓瘤患者外周血Tc17细胞比例、MDSCs比例及血浆IL-17水平均升高,Tc17细胞比例变化可能与多发性骨髓瘤的发病有关,对其相关机制进行研究有可能为抗肿瘤免疫治疗方案的制订提供新的理论依据。
参考文献:
[1] Siegel RL, Miller KD, Jemal A. Cancer Statistics,2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[2] Smith D, Yong K. Advances in understanding prognosis in myeloma[J]. Br J Haematol, 2016,175(3):367-380.
[3] Rasche L, Weinhold N, Morgan GJ, et al. Immunologic approaches for the treatment of multiple myeloma[J]. Cancer Treat Rev, 2017,55:190-199.
[4] Hamada H, Garcia-Hernandez Mde L, Reome JB, et al. Tc17, a unique subset of CD8 T cells that can protect against lethal influenza challenge[J]. J Immunol, 2009,182(6):3469-3481.
[5] Hinrichs CS, Kaiser A, Paulos CM, et al. Type 17 CD8+ T cells display enhanced antitumor immunity[J]. Blood, 2009,114(3):596-599.
[6] Garcia-Hernandez Mde L, Hamada H, Reome JB, et al. Adoptive transfer of tumor-specific Tc17 effector T cells controls the growth of B16 melanoma in mice[J]. J Immunol, 2010,184(8):4215-4227.
[7] Zhuang Y, Peng LS, Zhao YL, et al. CD8(+) T cells that produce interleukin-17 regulate myeloid-derived suppressor cells and are associated with survival time of patients with gastric cancer[J]. Gastroenterology, 2012,143(4):951-962.
[8] Tsai JP, Lee MH, Hsu SC, et al. CD4+ T cells disarm or delete cytotoxic T lymphocytes under IL-17-polarizing conditions[J]. J Immunol, 2012,189(4):1671-1679.
[9] Diaz-Montero CM, Finke J, Montero AJ. Myeloid-derived suppressor cells in cancer:therapeutic,predictive,and prognostic implication[J]. Semin Oncol, 2014,41(2):174-184.
[10] Liang Y, Pan HF, Ye DQ. Tc17 Cells in immunity and systemic autoimmunity[J]. Int Rev Immunol, 2015,34(4):318-331.
[11] Bao Z, Lu G, Cui D, et al. IL-17A-producing T cells are associated with the progression of lung adenocarcinoma[J]. Oncol Rep, 2016,36(2):641-650.
[12] Zhong F, Cui D, Tao H, et al. IL-17A-producing T cells and associated cytokines are involved in the progression of gastric cancer[J]. Oncol Rep, 2015,34(5):2365-2374.
[13] Jiang G, Ma S, Wei Y, et al. The prevalence and distribution of Th17 and Tc17 cells in patients with thyroid tumor[J]. Immunol Lett, 2014,162(1 Pt A):68-73.
[14] Young MR, Newby M, Wepsic HT. Hematopoiesis and suppressor bone marrow cells in mice bearing large metastatic Lewis lung carcinoma tumors[J]. Cancer Res, 1987,47(1):100-105.
[15] Gorgun GT, Whitehill G, Anderson JL, et al. Tumor-promoting myeloid-derived suppressor cells in themultiplemyeloma microenvironment in humans[J]. Blood, 2013,121(15):2975-2987.
[16] Ugel S, Delpozzo F, Desantis G, et al. Therapeutic targeting of myeloid-derived suppressor cells[J]. Curr Opin Pharmacol, 2009,9(4):470-481.
[17] Prabhala RH, Pelluru D, Fulciniti M, et al. Elevated IL-17 produced by TH17 cells promotes myeloma cell growth and inhibits immune function in multiple myeloma[J]. Blood, 2010,115:5385-5392.

