秦王川湿地不同密度柽柳枝-叶性状及其光合特性
赵连春, 赵成章 , 陈 静, 王继伟, 李 群
西北师范大学地理与环境科学学院,甘肃省湿地资源保护与产业发展工程研究中心, 兰州 730070
植物的功能性状与生存环境存在相互适应和协同进化的关系[1],在面对环境与资源压力时,植物会通过功能性状的调整等生态策略来维持种群或群落的稳定性[2- 3]。功能性状之间具有一定的相关性和权衡关系[4- 5],是植物提高自身空间资源利用能力的一种生态策略[6]。各功能器官中,当年生小枝在植物分枝系统中最具活力[7],有导水功能和机械支撑作用,其大小与植物的空间拓展策略有关,对叶片的物质投资方式具决定作用;叶片是植物进行光合作用的主要器官[8],影响着植物对光的截取和对碳的获取能力以及植株的发育模式[9- 10],通过枝-叶等功能性状的可塑性调整,把资源最佳地分配到不同的器官,以提高植物资源利用和竞争能力,规避环境风险,达到光合收益平衡[11- 12]。
密度是植物种群的一种重要选择压力[13],随着密度的增加,植物邻体干扰增强,光照、水分和土壤养分等环境资源受到制约[14],促使植物权衡枝-叶性状,改变光合策略,实现叶片生理特性和环境异质性的协调,体现了植物风险规避对策和生境适应性[15]。因此,研究密度制约条件下湿地植物枝叶性状的权衡关系及其光合适应策略,对于理解干旱区湿地这一特殊生境中植物功能性状的生态适应机制具有重要意义。
柽柳(Tamarixgansuensis)是柽柳科(Tamaricaceae)柽柳属(Tamarix)植物,在我国主要分布于沙荒地、干旱盐碱地及盐碱湿地。柽柳根部潜水较深、叶呈鳞片状、茎叶愈合、具发达的泌盐腺,耐盐碱,是典型的泌盐植物,可通过种子、营养两种方式繁殖,生态位较宽,具有较高的生态价值、药用价值[16],是秦王川湿地上的优势种群,在维系该处湿地生态系统方面发挥了重要作用。近年来,学术界对植物功能性状从功能性状对外界干扰的响应[17- 18]、不同生境的构型特征[19- 20]、根系构型特征[21- 22]、植物性状间的关系[12,23]等方面做了大量研究,而对柽柳的研究多集中在柽柳根冠构型[24- 25]、水分利用策略[26- 27]、生理特征[28- 29]、分布特征[30-31]、资源价值[32]等方面,对湿地环境密度制约下柽柳的枝、叶性状及生长规律的研究不够深入,尤其是湿地环境密度制约条件下的湿地植物枝、叶性状的生长关系及其光合响应机制尚不明晰。本文选取柽柳当年生小枝长度、叶数量、叶面积3个枝、叶性状指标,研究了秦王川湿地不同密度下柽柳的枝、叶性状及其光合特性,旨在理解密度制约下植物枝、叶的构建方式和光合适应策略,有助于揭示干旱地区湿地环境下植物表型可塑的生态生理机制。
1 材料和方法
1.1 研究区域概况
研究区位于甘肃省兰州市秦王川国家湿地公园内的保育区内,地理位置为103°35′38″—108°38′37″E,36°23′59″—36°27′56″N,海拔1872—1928m,属大陆性季风气候,年平均气温6.9℃,年均降水量220mm,主要集中在6—9月,年均蒸发量为1879.0mm,年日照时间2700h,平均无霜期126d。土壤以淡灰钙土、次生盐渍土为主,含水层为砂碎石及中细砂层。常年受季节性水淹的影响,发育有水生和湿生植物群落,保育区内自然分布着大片柽柳(TamarixgansuensisH. Z. Zhang)林,保育区内主要植物有:芦苇(Phragmitesaustralis(Cav.) Trin. ex Steud.)、枸杞(LyciumchinenseMiller)、柽柳、香蒲(TyphaorientalisPresl)、灰绿藜(ChenopodiumglaucumLinn.)、紫菀(AstertataricusLinn. f.)、假苇拂子茅(Calamagrostispseudophragmites(Hall. F.) Koel.)、猪毛菜(SalsolacollinaPall.)、苦苣菜(SonchusoleraceusLinn.)、盐角草(SalicorniaeuropaeaLinn.)、早熟禾(PoaannuaLinn.)等。
1.2 实验设置
2016年8月中旬,在秦王川国家湿地公园保育区内选择一片自然生长的柽柳群落,设置长200m、宽50m的样带1条,划分为100个10m×10m的样方。根据柽柳密度情况,按照等距原则将柽柳种群分为低密度Ⅰ(0.1—0.35棵/m2)、中密度Ⅱ(0.35—0.6棵/m2)和高密度Ⅲ(0.6—0.85棵/m2)3个密度梯度。每个梯度上取10个10m×10m样方(共30个样方),对样方内的所有基径大于1cm的柽柳进行编号,并记录株高、基径、冠幅,测定郁闭度和叶面积指数,然后在每个样方内选取有代表性的植株3棵,供植物采样。
1.2.1 植物采样
(1)植物光合参数测定
2016年8月13—18日(柽柳生长旺盛期期),选择晴朗天气的9:00—12:00,用GFS- 3000便携式光合测量仪(Heinz Walz GmbH, Bavaria, Germany)测定。测量使用人工红蓝光源,光合有效辐射(PAR)为1200μmol m-2s-1,CO2浓度为430μmol/mol,外界温度为(27±2)℃,相对湿度(RH)保持在40%—50%,流速设定为750μmol/s,叶室面积为8cm2。具体操作如下:首先用高枝剪在柽柳冠层的相同部位取样(冠层南侧中上部的枝条),从枝条上摘取叶片(从上往下数的第5—7片)后立即用光合仪测定气体交换参数,每个叶片重复测3次,未能充满叶室的叶片,则用便携式激光叶面积仪(CI- 202, Walz, Camas,USA)测定叶面积,进而计算净光合速率(Pn)和蒸腾速率(Tr)等参数[23]。
(2)枝叶构型测量
在代表性植株东、西、南、北4个方位的冠层中上部,各选择1个枝条(枝条数量≤4则全部选择),定义最外层的当年生枝为第1级枝条,向内第2级为支撑枝,记录支撑枝上着生的第1级枝条数量,标记1个无明显损失的当年生小枝,用量角器测量并记录1、2级枝条间的夹角,然后将小枝(标记的)贴母枝表皮剪取并放入塑料袋,编码后带回实验室测量。样品带回实验室后,在6h内完成以下测量:首先清点记录叶片数量并摘除,测量当年生小枝上每个叶片的叶面积(先用便携式激光叶面积仪(CI- 202, Walz, Camas,USA)测定每一个小枝上的所有叶片叶面积,取平均值);再用直尺测量小枝长度[33](本文中枝长度即当年生小枝的长度)。
1.2.2 土壤取样与理化性质测量
(1)土壤含水量
2016年8月下旬,选择近期无明显降水的时间进行土壤取样,每个样方内随机选取3个取样点,挖掘0.5m深的土壤剖面,用环刀间隔10cm采取土样,土样编号、称鲜质量后带回实验室在105℃的烘箱内烘至恒重后称干重,计算出各样地0—50cm土层土壤含水量。
(2)土壤盐分
电导法测定。室温下土样风干后过2mm筛,取10g加50mL去CO2蒸馏水(水土比为5∶1),取浸出液,置振荡机上振荡5min,抽滤后滤液倒入三角瓶[34],用便携式电导仪(DDS- 11C)测滤液的电导率,重复3次,取平均值。
1.3 数据分析
对柽柳枝长度、叶大小和叶数量的实验数据进行对数转换(以10为底),使之符合正态分布,然后采用标准化主轴估计(SMA)方法[35]进行分析,以斜率、截距数值来表征枝、叶异速生长关系。其他的实验数据进行方差齐性检验和正态分布检验后,用SPSS 16.0统计分析软件对实验数据进行相关分析和方差分析,显著性水平设为0.05,用Excel软件作图。
2 结果分析
2.1 湿地柽柳主要功能性状分析
不同密度柽柳种群的植物功能性状存在显著差异(P< 0.05)(表1),随着柽柳种群自低密度Ⅰ到高密度Ⅲ,柽柳株高和群落郁闭度呈增加趋势,其中株高增加了20.66%,群落郁闭度增加了41.89%;而冠幅、基径则逐渐减小,冠幅减少了21.51%,基径减少了28.37%。叶面积指数则随着I、Ⅱ、Ⅲ密度梯度先增加后减少,中密度Ⅱ叶面积指数最大,较低密度I增加了2.01倍,较样地Ⅲ高2.07倍。表明密度可显著改变湿地柽柳的冠层构型,并影响柽柳的郁闭度等环境条件。
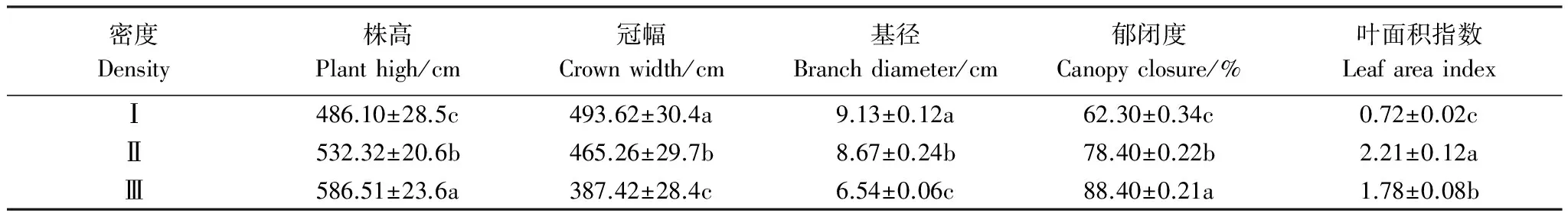
表1 不同密度柽柳主要功能性状(平均值±标准误差)
同一列数据后不同小写字母表示不同密度梯度间差异显著(P< 0.05);Ⅰ:低密度 low density(Ⅰ);Ⅱ:中密度 medium density(Ⅱ);Ⅲ:高密度 high density(Ⅲ)
2.2 湿地柽柳土壤理化性质分析
密度影响下,柽柳种群的土壤理化性质存在差异显著(P< 0.05)(表2)。随着柽柳种群密度的增加,土壤含水量逐渐递增,从低密度Ⅰ到高密度Ⅲ增加了34.49%,土壤容重则逐渐递减,从低密度Ⅰ到高密度Ⅲ减少了12.23%,土壤pH值和导电率逐渐递减,从低密度Ⅰ到高密度Ⅲ分别减少了14.97%和76.47%。表明柽柳种群通过密度制约亦可显著改变群落土壤的理化性质。
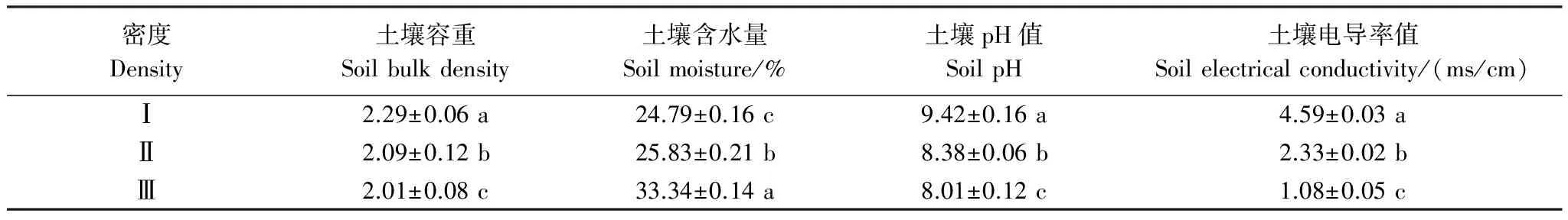
表2 不同密度柽柳土壤理化性质 (平均值±标准误差)
同一列数据后不同小写字母表示不同密度梯度间差异显著(P< 0.05)
2.3 湿地柽柳主要枝叶性状分析
随着柽柳种群密度的增加,柽柳枝长度和单位枝条上叶面积、叶数量在不同密度梯度下存在差异显著(P< 0.05),枝长度和叶面积依次递增,从低密度Ⅰ到高密度Ⅲ分别增加了1.08倍和56.12%;枝条分枝角度、分枝数、叶数量呈依次递减(表3),从低密度Ⅰ到高密度Ⅲ分别减少了37.61%、64.39%和23.61%。表明低密度下柽柳种群选择较小枝长度、叶面积和较大分枝角度、叶数量的枝叶构建模式,高密度下则选择较大枝长度、叶面积和较小分枝角度和叶数量的垂直空间拓展模式,以适应干旱区湿地不同的竞争环境。
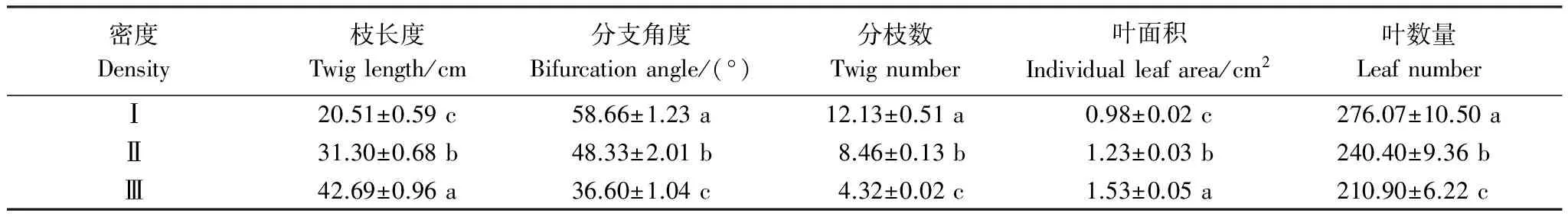
表3 不同密度柽柳枝叶性状(平均值±标准误差)
同一列数据后不同小写字母表示不同密度梯度间差异显著(P< 0.05)
2.4 湿地柽柳光合特性变化分析
随着柽柳种群密度的增大,柽柳种群内光合有效辐射呈递减趋势,高密度Ⅲ较低密度Ⅰ减少了46.4%,水分利用效率也逐渐减小,高密度Ⅲ较低密度Ⅰ减少了35.39%,较中密度样地减少了14.88%。净光合速率、蒸腾速率和气孔导度自低密度Ⅰ、高密度Ⅲ、中密度Ⅱ顺序递增,中密度Ⅱ较高密度Ⅲ分别增加了19.55%、44.21%和17.48%,较低密度Ⅰ分别增加了54.12%、1.14倍和54.77%。而表明低密度条件下,光合有效辐射最高,柽柳水分利用效率最高、光合速率和蒸腾速率则最低。
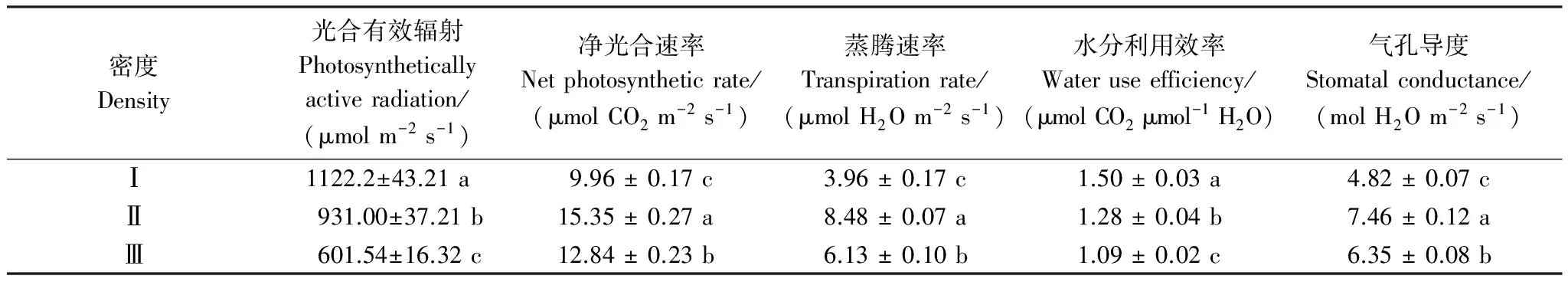
表4 不同密度柽柳光合特征 (平均值±标准误差)
同一列数据后不同小写字母表示不同密度梯度间差异显著(P< 0.05)
2.5 不同密度下枝长度和叶面积的关系分析
不同密度梯度下柽柳的枝长度与叶面积皆具有正相关关系(P< 0.05, 图1),各密度梯度间的斜率差异显著(P< 0.05)。低密度柽柳的枝长度与叶面积间的关系斜率为0.98,与斜率1差异不显著(P> 0.05),表明低密度下柽柳枝长度与叶面积间存在等速关系。中密度梯度斜率为0.84,大于高密度斜率0.65,均显著小于1.0(P< 0.001) (图1),表明中高密度下柽柳枝长度与叶面积间存在异速关系。各密度梯度下,随着枝长度的变大叶面积也变大,但枝长度增长速率大于叶面积增长速率;随着柽柳密度自低密度到高密度,枝长度和叶面积间的斜率逐渐减小,表明高密度柽柳较中、低密度柽柳的单位长度枝上具有更大的枝长度与叶面积比值。
2.6 不同密度下枝长度和叶数量的关系分析
不同密度梯度下柽柳枝长度和叶数量间均具有正相关关系(P< 0.05, 图2),回归斜率均为0.90(P<0.01,图2),小于1.0(P< 0.05),表明不同密度梯度柽柳的枝长度和叶数量具有异速生长关系。随着密度增大,中密度和高密度SMA的截距沿着y轴出现了显著的负向移动(P< 0.05),表明低密度、中密度柽柳的单位长度枝条上拥有更多的叶数量,高密度柽柳单位枝条上的叶数量最少。
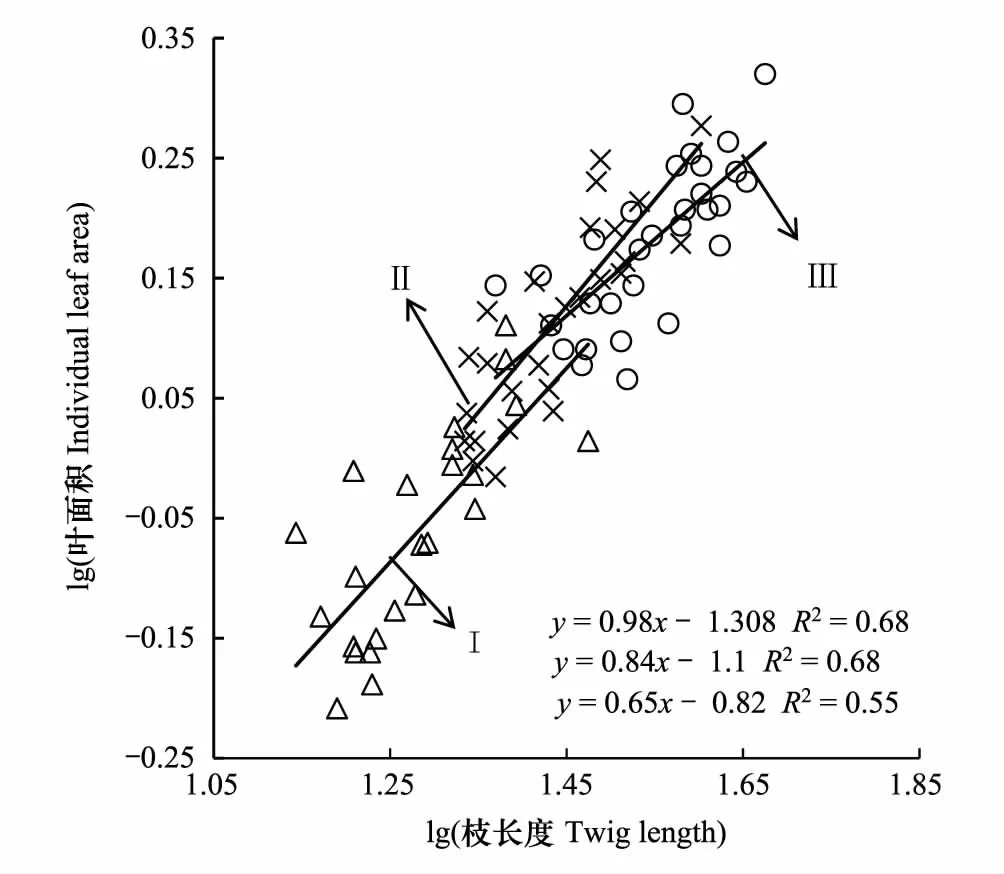
图1 多枝柽柳枝长度与叶面积的关系Fig.1 Relationship between twig length and leaf area of Tamarix gansuensis Ⅰ:低密度,low density;Ⅱ:中密度,medium density;Ⅲ:高密度,high density
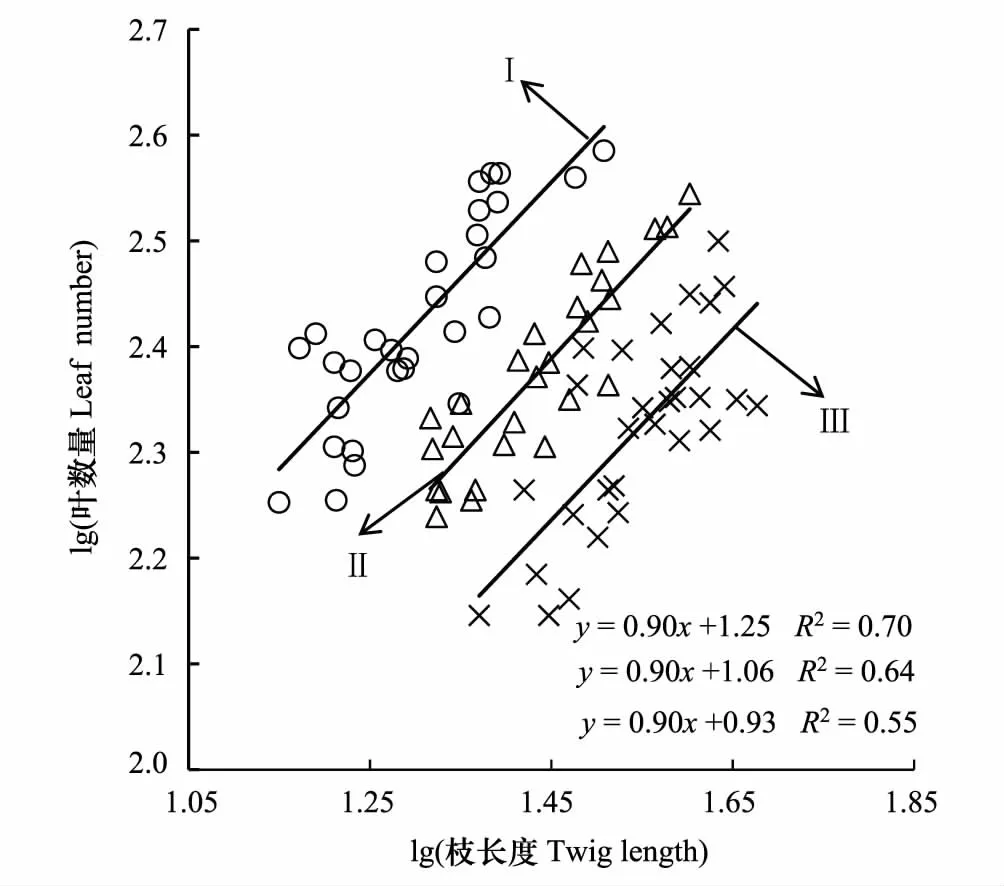
图2 多枝柽柳枝长度与叶数量的关系Fig.2 Relationship between twig length and leaf number of Tamarix gansuensis
3 讨论
3.1 低密度下柽柳枝-叶性状的关系
植物功能性状之间的关系是其提高自身空间资源利用能力的一种生态策略,植物通过调节枝条长度等构型特征参数,有效利用光照、水分、养分等资源[36],是特定环境下植物生存策略的重要表现[6]。在低密度梯度下,柽柳群落郁闭度较小(表1),邻体干扰小,光资源充足(表4),土壤水、盐胁迫是主要资源限制因子(表2),柽柳采取降低株高、枝长度、叶面积,增加冠幅、基径、分枝数、分枝角度、叶数量的水平拓展策略(表1,表3),降低光合速率、提高水分利用效率,保持植株整体光合收益(表4)。究其原因应是:(1)低密度柽柳林郁闭度低(表1)、地表植被少、土壤裸露多,土壤水分大量通过地表蒸发并将地下盐分携至地表,造成该密度样地土壤水分含量最低、盐分含量最高(表2),形成盐胁迫。盐胁迫条件下,有效水资源供应不足,导致光合速率下降[37],为防止体内水分过度蒸发,柽柳减小气孔导度和叶面积来降低蒸腾速率[38],提高水分利用效率(表4)以适应该生境,同时增加了木质部等水分运输器官的建设,减小枝长度、株高(表1,表3),以缩短根系水分运输到叶部的有效运输距离[39],增强水分运输能力,保持植物体内水分运输畅通,这比较符合管道模型理论[40],也与Wang等人“水胁迫会明显限制植株纵向生长,对径向生长影响小,利于增加水分利用效率”的研究结果基本一致[41]。(2)低密度样地中柽柳相互遮蔽较小(表1),植株冠层接收的光辐射较大(表4),光辐射过强会成光胁迫,造成光抑制[42],导致光合速率降低(表4)。为减少光胁迫的影响,柽柳适应性的减少枝长度、叶面积,并增加枝条数和叶数量,以提高植株综合光合收益。该结果与“强光环境下树木会适应性的着生大量高重叠率短枝叶片,形成体积小、紧密型树冠”[43]的结论一致。
3.2 高密度下柽柳枝-叶性状的关系
植物形态与生存环境之间是一种相互适应与协同进化的关系,植物通过生长率变化、生物量分配及光合器官构件调整等长期的表型可塑性来增加对光照和养分资源的利用效率,同时也为自身提供了一种有效的保护机制[44- 45]。高密度梯度下,柽柳群落郁闭度大(表1),邻体干扰强,土壤水分含量高、盐分含量较低(表2),PAR最低(表4),光照成为主要制约因子,柽柳采取增加株高、枝长度、叶面积,减少冠幅、基径、分枝角度、分枝数和叶数量的垂直空间拓展策略(表1,表3),来提高光能捕获效率,保证空间竞争下光合收益的最大化。原因应是:(1)高密度梯度样地,柽柳产生大量的枯落物,枯落物产生大量营养元素返回到土壤中,提高了土壤肥力,为地被植物生长提供养分条件,地面裸露少,地表蒸发量减少,所以土壤水分含量高、盐分含量较低(表2),水分充足时植物将生物量较多地分配到地上叶和枝的生长上(表3),以提高光合产量,满足植物生长的需要[46]。(2)高密度柽柳群落邻体干扰较强,枝叶交错重叠,形成叶量、密度过大的郁闭层,降低了叶片截获光资源的能力[47],不利于光资源的充分利用,光资源成为制约柽柳生长的重要因子,因此,柽柳减小冠幅、基径、分枝角度、分枝数和叶数量,增大株高、枝长度、叶面积等获取光资源的竞争性器官分配(表1,表3),同时提高光合速率(表4)以保证自身能够最大化地利用受限资源,这也较、符合胁迫中植物生长最受限制的那部分资源获得增加的功能或器官应得到最优先配置和增加的最优分配理论和功能平衡假说[48],也同“冷凉、湿润或者荫蔽的环境下大叶由于能够使光合收益最大化会占有优势”[49]、地上竞争时植物通过增加光合产物向叶片的分配以获得更多的光照的研究结果[50]一致。
3.3 中密度下柽柳枝-叶性状的关系
植物通过调节自身的资源配置来保持在群落中的最大适合度,具体来说,生活在资源相对丰富环境中的植物体具有较高的扩散和定植能力,以快速抢夺生存所必需的资源,因而植物体会将更多的能量分配给繁殖和生长,从而形成一系列经济型的器官结构[51]。中密度样地,柽柳种群邻体干扰适中、光照条件、土壤水盐状况等环境条件较为适宜,柽柳叶面积指数最高,气孔导度、净光合速率和蒸腾速率最大。原因如下:(1)中密度梯度下,土壤水盐状况良好(表2),已经不是资源获取限制因子,柽柳通过增大叶面积指数、提高气孔导度(表1,表4),来增强叶片截获光的能力,提高光利用效率和光合速率[52],并将更多的投资分配到使光合收益最大化的构建上来,形成最佳经济结构。(2)中密度梯度下,群落郁闭度适中,光不再是限制性因子,柽柳会平衡枝叶投资(表3),形成最佳构型,达到光合收益最大化。(3)中密度梯度下,柽柳邻体干扰较高密度梯度小,植株间的地上、地下竞争减小,柽柳可最大程度的利用地上、地下资源,拓展生存空间,以实现群落的整体扩张。这也符合最优分配理论的植物通过对光合产物的分配来获取光照、养分、水分和CO2等资源以达到最大的生长速率[48]的结论。
4 结论
密度制约改变了种群内每个植株可获得性资源的数量,资源的不足引起邻株植物的相同功能部分对有限资源的竞争,致使植物生物量分配格局发生可塑性调整[53],干旱区湿地群落中,柽柳在低密度样地为避免土壤水盐胁迫和光过饱和胁迫,采取降低枝长度、叶面积、增加分枝数、分枝角度、叶数量的性状权衡策略,并从生理上提高水分利用效率,以保证稳定的光合收益。中密度样地,柽柳种群邻体干扰适中、环境条件较为适宜,柽柳叶面积指数最高,气孔导度、净光合速率和蒸腾速率最大。在高密度样地,邻体干扰较强,光资源成为主要限制性因子,为有效利用光资源,柽柳采取增加枝长度、叶面积,降低分枝数、分枝角度、叶数量的性状权衡策略,并提高气孔导度,增强光资源利用效率,提高光合速率,最大限度的利用受限资源,达到光合收益的最大化。随着柽柳种群密度自低密度、中密度到高密度,植株株高变高、冠幅变小、基径变小、分枝角度和分枝数变小,同时枝长度逐渐增加、叶数量逐渐减少、叶面积逐渐增大、水分利用效率逐渐降低,体现了干旱区湿地环境下,柽柳应对资源竞争的可塑性调整策略。本文仅对密度制约下湿地植物柽柳的枝叶性状和光合特性进行了分析,而密度制约下湿地植物的地下根系构型、地上地下生物量分配以及湿地植物本身的生理、生化特征也会发生适应性的变化,还需深入研究。
参考文献(References):
[1] Bernard-Verdier M, Navas M L, Vellend M, Violle C, Fayolle A, Garnier E. Community assembly along a soil depth gradient: contrasting patterns of plant trait convergence and divergence in a Mediterranean rangeland. Journal of Ecology, 2012, 100(6): 1422- 1433.
[2] Kimball S, Funk J L, Spasojevic M J, Suding K N, Parker S, Goulden M L. Can functional traits predict plant community response to global change? Ecosphere, 2016, 7(12): e01602.
[3] Zhao N, Wang Z W, Shao X Q, Wang K. Diversity components and assembly patterns of plant functional traits determine community spatial stability under resource gradients in a desert steppe. The Rangeland Journal, 2016, 38(5): 511- 521.
[4] Reich P B, Wright I J, Cavender-Bares J, Craine J M, Oleksyn J, Westoby M, Walters M B. The evolution of plant functional variation: traits, spectra, and strategies. International Journal of Plant Sciences, 2003, 164(S3): S143-S164.
[5] Swenson N G, Enquist B J. Ecological and evolutionary determinants of a key plant functional trait: wood density and its community-wide variation across latitude and elevation. American Journal of Botany, 2007, 94(3): 451- 459.
[6] Mooney K A, Halitschke R, Kessler A, Agrawal A A. Evolutionary trade-offs in plants mediate the strength of trophic cascades. Science, 2010, 327(5973): 1642- 1644.
[7] 李亚男,杨冬梅,孙书存,高贤明. 杜鹃花属植物小枝大小对小枝生物量分配及叶面积支持效率的影响: 异速生长分析. 植物生态学报, 2008, 32(5): 1175- 1183.
[8] 张林, 罗天祥. 植物叶寿命及其相关叶性状的生态学研究进展. 植物生态学报, 2004, 28(6): 844- 852.
[9] Parkhurst D F, Loucks O L. Optimal leaf size in relation to environment. Journal of Ecology, 1972, 60(2): 505- 537.
[10] Givnish T J, Vermeij G J. Sizes and shapes of Liane leaves. The American Naturalist, 1976, 110(975): 743- 778.
[11] 侯兆疆, 赵成章, 李钰, 张茜, 马小丽. 不同坡向高寒退化草地狼毒株高和枝条数的权衡关系. 植物生态学报, 2014, 38(3): 281- 288.
[12] Mensah S, Kakaï R G, Seifert T. Patterns of biomass allocation between foliage and woody structure: the effects of tree size and specific functional traits. Annals of Forest Research, 2016, 59(1): 49- 60.
[13] Japhet W, Zhou D W, Zhang H X, Zhang H X, Yu T. Evidence of phenotypic plasticity in the response ofFagopyrumesculentumto population density and sowing date. Journal of Plant Biology, 2009, 52(4): 303- 311.
[14] 张明娟, 刘茂松, 徐驰, 池婷, 洪超. 不同密度条件下芨芨草空间格局对环境胁迫的响应. 生态学报, 2012, 32(2): 595- 604.
[15] 史元春, 赵成章, 宋清华, 杜晶, 陈静, 王继伟. 兰州北山刺槐枝叶性状的坡向差异性. 植物生态学报, 2015, 39(4): 362- 370.
[16] 孙丽坤, 刘万秋, 陈拓, 刘光琇. 柽柳属(Tamarix)植物生境适应机制与资源价值研究进展. 中国沙漠, 2016, 36(2): 349- 356.
[17] Abakumova M, Zobel K, Lepik A, Semchenko M. Plasticity in plant functional traits is shaped by variability in neighbourhood species composition. New Phytologist, 2016, 211(2): 455- 463.
[18] Reese A T, Ames G M, Wright J P. Variation in plant response to herbivory underscored by functional traits. PLoS One, 2016, 11(12): e0166714.
[19] 史元春, 赵成章, 宋清华, 杜晶, 王继伟. 兰州北山侧柏株高与冠幅、胸径异速生长关系的坡向差异性. 生态学杂志, 2015, 34(7): 1879- 1885.
[20] Mahdavi P, Bergmeier E. Plant functional traits and diversity in sand dune ecosystems across different biogeographic regions. Acta Oecologica, 2016, 74: 37- 45.
[21] 郭京衡, 曾凡江, 李尝君, 张波. 塔克拉玛干沙漠南缘三种防护林植物根系构型及其生态适应策略. 植物生态学报, 2014, 38(1): 36- 44.
[22] 杨小林, 张希明, 李义玲, 张永领. 基于分形理论的塔克拉玛干沙漠腹地自然植物根系构型特征分析. 干旱区资源与环境, 2015, 29(8): 145- 150.
[23] 韩玲, 赵成章, 徐婷, 冯威, 段贝贝, 郑慧玲. 张掖湿地芨芨草叶大小和叶脉密度的权衡关系. 植物生态学报, 2016, 40(8): 788- 797.
[24] 李尝君, 郭京衡, 曾凡江, 热甫开提, 郭自春. 多枝柽柳(Tamarixramosissima)根、冠构型的年龄差异及其适应意义. 中国沙漠, 2015, 35(2): 365- 372.
[25] 朱绪超, 袁国富, 邵明安, 杜涛. 塔里木河下游河岸柽柳林冠层导度变化特征及模拟. 生态学报, 2016, 36(17): 5459- 5466.
[26] 吴桂林, 蒋少伟, 周天河, 王丹丹, 李君. 不同地下水埋深胡杨与柽柳幼苗的水分利用策略比较. 干旱区研究, 2016, 33(6): 1209- 1216.
[27] Xia J B, Zhang S Y, Zhao X M, Liu J H, Chen Y P. Effects of different groundwater depths on the distribution characteristics of soil-Tamarixwater contents and salinity under saline mineralization conditions. Catena, 2016, 142: 166- 176.
[28] 郭自春, 曾凡江, 刘波, 李尝君, 张波. 疏叶骆驼刺和多枝柽柳不同时期光合特性日变化及其与环境因子的关系. 西北植物学报, 2015, 35(1): 189- 198.
[29] 孔庆仙, 夏江宝, 赵自国, 屈凡柱. 不同地下水矿化度对柽柳光合特征及树干液流的影响. 植物生态学报, 2016, 40(12): 1298- 1309.
[30] 冯威, 赵成章, 韩玲, 徐婷, 郑慧玲, 段贝贝. 张掖湿地宽苞水柏枝和多枝柽柳种群的空间分布格局与关联性分析. 生态学杂志, 2016, 35(10): 2583- 2591.
[31] Lu Q Q, Bai J H, Gao Z Q, Zhao Q Q, Wang J J. Spatial and seasonal distribution and risk assessments for metals in aTamarixchinensiswetland, China. Wetlands, 2016, 36(S1): 125- 136.
[32] Gao C Q, Yang G Y, Guo Y C, Zhao Y L, Yang C P. Overexpression ofThGSTZ1 fromTamarixhispida, improves tolerance to exogenous ABA and methyl viologen. Trees, 2016, 30(6): 1935- 1944.
[33] 杜晶, 赵成章, 宋清华, 史元春, 王继伟, 陈静. 祁连山北坡霸王枝-叶性状关系的个体大小差异. 植物生态学报, 2016, 40(3): 212- 220.
[34] 张雅琼, 梁存柱, 王炜, 王立新, 彭江涛, 闫建成, 贾成朕. 芨芨草群落土壤盐分特征. 生态学杂志, 2010, 29(12): 2438- 2443.
[35] Warton D I, Wright I J, Falster D S, Westoby M. Bivariate line-fitting methods for allometry. Biological Reviews, 2006, 81(2): 259- 291.
[36] Steingraeber D A, Waller D M. Non-stationarity of tree branching patterns and bifurcation ratios. Proceedings of the Royal Society B: Biological Sciences, 1986, 228(1251): 187- 194.
[37] Lakshmi A, Ramanjulu S, Veeranjaneyulu K, Sudhakar C. Effect of NaCl on photosynthesis parameters in two cultivars of mulberry. Photosynthetica, 1996, 32(2): 285- 289.
[38] Woodward F I, Lomas M R, Kelly C K. Global climate and the distribution of plant biomes. Philosophical Transactions of the Royal Society B: Biological Sciences, 2004, 359(1450): 1465- 1476.
[39] Tyree M T, Ewers F W. The hydraulic architecture of trees and other woody plants. New Phytologist, 1991, 119(3): 345- 360.
[40] Niklas K J. Plant Biomechanics: An Engineering Approach to Plant form and Function. Chicago: University of Chicago press, 1992.
[41] Wang G G, Bauerle W L, Mudder B T. Effects of light acclimation on the photosynthesis, growth, and biomass allocation in American chestnut (Castaneadentata) seedlings. Forest Ecology and Management, 2006, 226(1/3): 173- 180.
[42] 胡文海, 张斯斯, 肖宜安, 闫小红. 两种杜鹃花属植物对长期遮阴后全光照环境的生理响应及其光保护机制. 植物生态学报, 2015, 39(11): 1093- 1100.
[43] Cornelissen J H C. Aboveground morphology of shade-tolerant castanopsis fargesii saplings in response to light environment. International Journal of Plant Sciences, 1993, 154(4): 481- 495.
[44] Sultan S E. What has survived of Darwin′s theory? Phenotypic plasticity and the neo-Darwinian legacy. Evolutionary Trends in Plants Science, 1992, 6(2): 61- 71.
[45] 武高林, 陈敏, 杜国祯. 营养和光照对不同生态幅风毛菊属植物幼苗形态可塑性的影响. 应用生态学报, 2008, 19(8): 1708- 1713.
[46] Guo W, Li B, Zhang X, Wang R. Architectural plasticity and growth responses ofHippophaerhamnoidesandCaraganaintermediaseedlings to simulated water stress. Journal of Arid Environments, 2007, 69(3): 385- 399.
[47] Maliakal, S K, McDonnell K, Dudley S A, Schmitt J. Effects of red to far-red ratio and plant density on biomass allocation and gas exchange inImpatienscapensis. International Journal of Plant Sciences, 1999, 160(4): 723- 733.
[48] Bloom A J, Chapin F S III, Mooney H A. Resource limitation in plants-an economic analogy. Annual Review of Ecology and Systematics, 1985, 16: 363- 392.
[49] Givnish T. On the adaptive significance of leaf form // Solbrig O T, Jain S, Johnson G B, Raven P H, eds. Topics in Plant Population Biology. New York: Columbia University Press, 1979: 375- 407.
[50] Bloor J M G, Leadley P W, Barthes L. Responses ofFraxinusexcelsiorseedlings to grass-induced above- and below-ground competition. Plant Ecology, 2008, 194(2): 293- 304.
[51] Rüger N, Wirth C, Wright S J, Condit R. Functional traits explain light and size response of growth rates in tropical tree species. Ecology, 2012, 93(12): 2626- 2636.
[52] Wright I J, Reich P B, Cornelissen J H C, Falster D S, Garnier E, Hikosaka K, Lamont B B, Lee W, Oleksyn J, Osada N, Poorter H, Villar R, Warton D I, Westoby M. Assessing the generality of global leaf trait relationships. New Phytologist, 2005, 166(2): 485- 496.
[53] 黎磊, 周道玮, 盛连喜. 密度制约决定的植物生物量分配格局. 生态学杂志, 2011, 30(8): 1579- 1589.

