非小细胞肺癌患者血清miR-141及miR-224的表达及其临床意义
林文科,吴吉芳,郑志昂
(海南省第三人民医院检验科,海南三亚 572000)
1 材料和方法
1.1研究对象选取2015年1月~2017年6月海南省第三人民医院经手术病理证实的NSCLC患者128例,其中男性82例,女性46例,年龄43~76岁,平均年龄58.4±9.7岁。纳入标准:①符合国际抗癌联盟(UICC)与2009年制定的最新版肺癌的诊断和分期标准,且经病理确诊为NSCLC者;②术前均未接受放疗、化疗及免疫治疗者;③未并发其他肿瘤者。临床病理分期:I期16例,Ⅱ期50例,Ⅲ期34例,Ⅳ期28例;病理类型:鳞癌68例,腺癌51例,大细胞癌9例;病理分级:G1 28例,G2 47例,G3 53例;有淋巴结转移77例,无淋巴结转移51例。选择同期良性病变(如肺结核、炎性假瘤和各种肺部良性肿瘤等)患者60例作为良性组,其中男性39例,女性21例,年龄45~77岁,平均年龄60.2±10.4岁;60例健康体检者作为对照组,其中男性37例,女性23例,年龄40~75岁,平均年龄56.8±9.3岁。各组性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,并签署患者知情同意书。
1.2主要试剂和仪器RNA提取试剂盒购自美国Ambio公司,在ABI 7500型荧光定量PCR仪(美国ABI公司)上进行实时荧光定量聚合酶链反应(Real-Time PCR)。C1000梯度PCR扩增仪(BIO-RAD公司)和5810R高速冷冻离心机(Eppendorf)。
1.3Real-Time PCR检测空腹取静脉血5 ml于EDTA抗凝管中,3 000 r/min,离心15 min后取上清,收集上清液于无RNA酶的2 ml离心管,所有标本置于-80℃冰箱保存。按照总microRNA快速提取试剂盒(miRNeasy血浆提取试剂盒)说明书从中提取总microRNA。以U6为实验内参,microRNA逆转录反应体系:5 μl RNA模板,3 μl U6及miRNA特异性茎环引物,0.15 μl 100 mmol/L脱氧核糖核苷酸(dNTPs),1.00 μl逆转录酶(50 U/μl),1.50 μl 10×反转录缓冲液,0.19 μl RNase抑制剂(20 U/μl),4.16 μl无菌三蒸水。PCR总反应体系为15 μl,反应条件:16℃30 min,42℃30 min,85℃5 min。以U6为实验内参,反应体系为20 μl:1 μl引物及探针Mix(20×),10 μl TaqMan通用混合物溶液(2×),1.33 μl反转录产物cDNA,7.67 μl 无核酸酶的水。扩增条件为:95℃10 min 1个循环,95℃15 s,60℃60 s进行45个循环,实验重复3次。每个反应体系中荧光信号达到所设定的阈值的经历的循环数即为Ct值,以U6为内参照,采用2-ΔΔCt法计算miR-141及miR-224的相对表达水平,其中ΔCt=Ct目的基因-CtU6。
1.4SCC-Ag检测采用罗氏电化学发光免疫分析仪及配套试剂盒,化学发光法测定SCC-Ag水平,操作过程严格按照说明书进行。
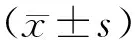
2 结果
2.1各组血清miR-141,miR-224及SCC-Ag表达水平比较见表1。NSCLC组血清miR-141,miR-224及SCC-Ag表达水平均明显高于良性组和对照组,差异有统计学意义(P<0.01);而良性组与对照组血清miR-141,miR-224及SCC-Ag表达水平比较,差异无统计学意义(P>0.05)。
表1
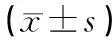
各组血清miR-141,miR-224及SCC-Ag表达水平比较
2.2NSCLC患者血清miR-141及miR-224表达与临床病理特征的关系见表2。血清miR-141及miR-224表达水平与病理分期、病理分级及淋巴结转移相关,差异有统计学意义(P<0.05);而与年龄、性别、吸烟状况、职业暴露、病理类型及肿瘤直径无关,差异无统计学意义(P>0.05)。
表2
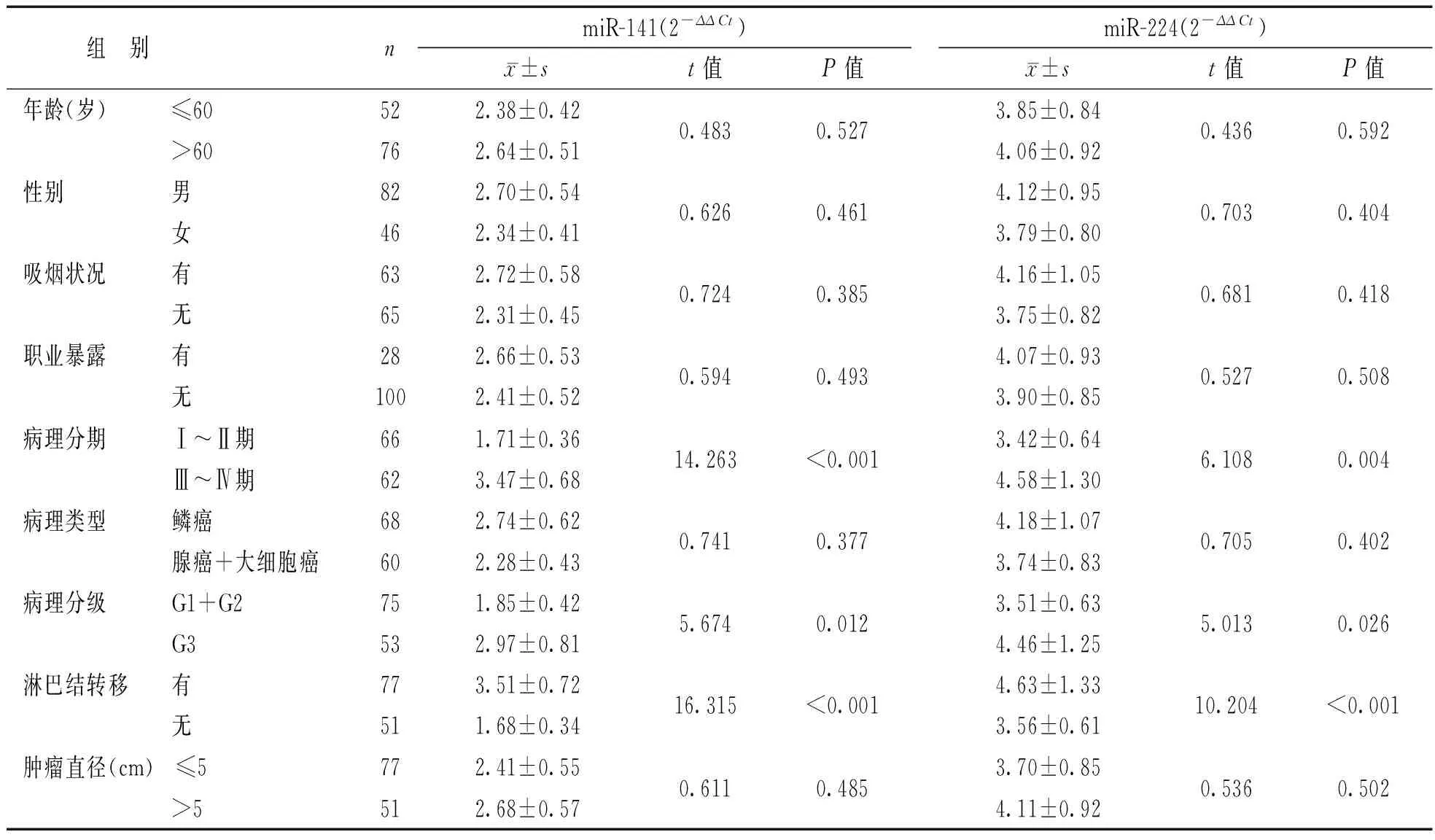
NSCLC患者血清miR-141及miR-224表达与临床病理特征的关系
2.3血清miR-141,miR-224及SCC-Ag对NSCLC的诊断价值见图1和表3。血清miR-141,miR-224,SCC-Ag及三项联合诊断NSCLC的AUC(95%CI)分别为0.892(0.824~0.961),0.864(0.793~0.932),0.785(0.718~0.849)及0.913(0.847~0.981),与对照组(AUC=0.5)比较,差异均有统计学意义(P<0.01)。血清miR-141,miR-224及SCC-Ag诊断NSCLC的最佳截值分别为1.84,2.85,2.03 ng/ml。三项联合诊断NSCLC的敏感度和特异度较好,分别为92.5%和82.7%。
表3
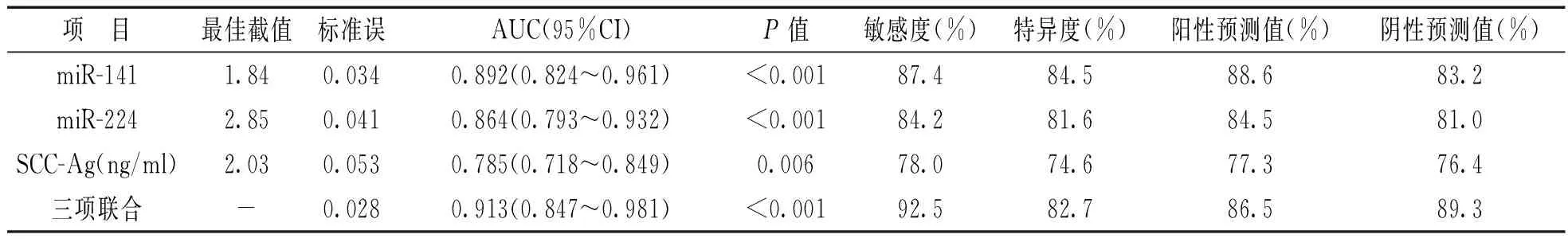
血清miR-141,miR-224及SCC-Ag对NSCLC的诊断价值
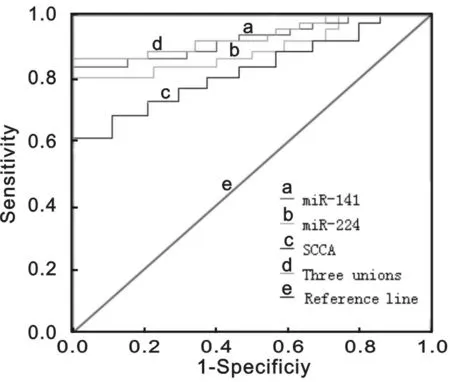
图1 血清miR-141,miR-224及SCC-Ag诊断NSCLC的ROC曲线
2.4NSCLC患者血清miR-141与miR-224,SCC-Ag的相关性见图2。Pearson相关分析显示,NSCLC患者血清miR-141与miR-224,SCC-Ag均呈正相关(r=0.782,=0.637,均P<0.01);血清miR-224与SCC-Ag呈正相关(r=0.594,P<0.01)。
3讨论microRNA是一类由19~22个成熟核苷酸组成的小分子非编码RNA,在肿瘤的发生、发展和转移中起着重要的作用,在晚期肿瘤患者血液中也检测到异常microRNA的表达,有望成为治疗肿瘤患者的重要靶点[7]。已有研究证实,microRNA可以稳定存在于痰液、血清及组织中,同时发现microRNA在恶性肿瘤中的表达谱与健康人存在明显差异,这些特性使得microRNA有望成为新的肿瘤标志物[8]。Li等[9]研究表明,microRNA的异常表达与NSCLC的发生发展相关,检测肺癌组织或外周血microRNA的表达水平对NSCLC的早期诊断、临床分期及预后评估具有重要的意义。Wang等[10]采用Real-Time PCR技术检测70例NSCLC患者和70例健康对照组血清miR-125a-5p,miR-145及miR-146a表达水平,结果提示miR-125a-5p,miR-145及miR-146a可能成为NSCLC临床诊断的非侵入性的生物标志物。近年来研究发现,miR-141及miR-224在多种恶性肿瘤中异常表达,且不同恶性肿瘤组织miR-141及miR-224的表达谱不同,miR-141及miR-224对肿瘤早期诊断、分期和预后评估等方面具有重要的提示作用[11,12]。
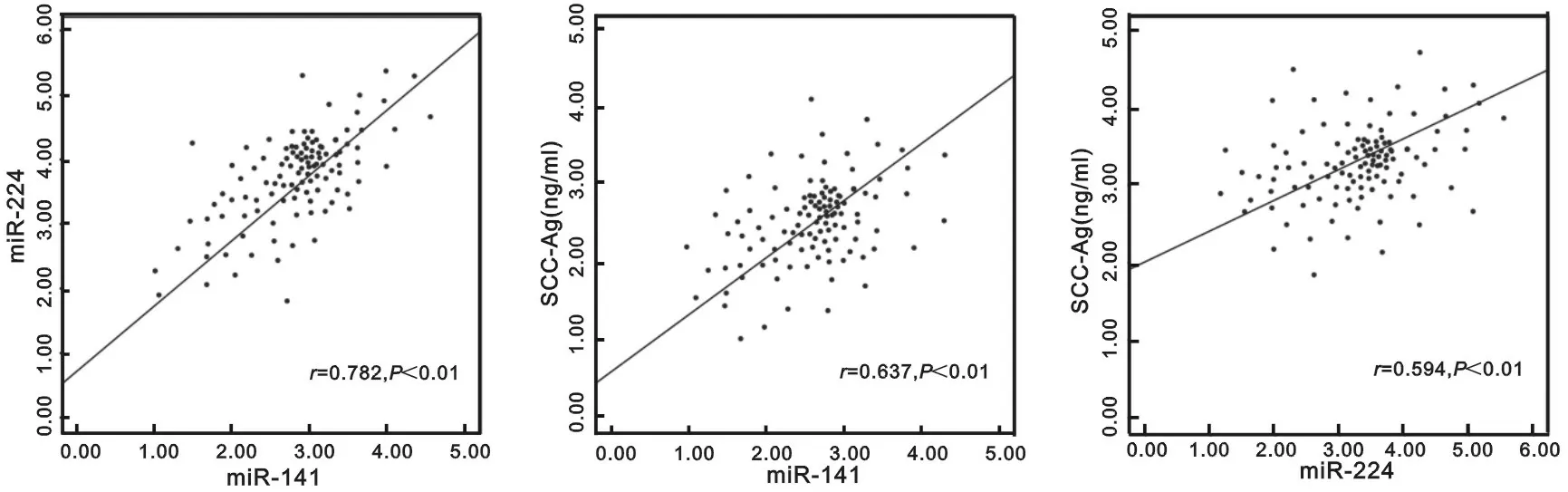
图2 血清miR-141与miR-224,SCC-Ag的相关性
本研究显示,NSCLC组血清miR-141,miR-224及SCC-Ag表达水平均明显高于良性组和对照组,提示血清miR-141及miR-224在NSCLC患者中异常表达,可能通过发挥癌基因的作用来调节NSCLC的发生发展过程。在NSCLC患者临床病理分期中,Ⅲ~Ⅳ期患者血清miR-141及miR-224的表达水平明显高于Ⅰ~Ⅱ期;miR-141及miR-224的表达随着病理分级的增高而降低,高分化患者明显低于低分化患者;有淋巴结转移患者血清miR-141及miR-224的表达水平明显高于无淋巴结转移患者。分析其原因可能是存在淋巴结转移的患者肿瘤负荷往往较大,肿瘤组织可释放更多的具有原癌基因作用的microRNA进入血液,同时可抑制机体原有的具有抑癌作用的microRNA水平表达,进而导致机体microRNA表达水平异常升高。Mei等[13]研究发现,miR-141通过调节pH结构域富含亮氨酸重复序列蛋白磷酸酶-1(PHLPP-1)和(PHLPP-2)表达在NSCLC的发生中发挥着重要的作用,并为NSCLC治疗的潜在治疗靶点。Wang等[14]采用Real-Time PCR技术检测56例NSCLC患者miR-224的表达情况,并分析其与NSCLC的临床病理特征的关系,发现miR-224通过调节RASSF-8表达促进NSCLC细胞的增殖,可能是NSCLC的潜在治疗靶点。因此,miR-141及miR-224在一定程度上参与NSCLC的发生发展,有望作为NSCLC的生物学标志物或治疗靶点。
尽管国外已有报道miR-141及miR-224可作为NSCLC的生物学标志物,但二者联合传统肿瘤标志物诊断NSCLC的研究尚未发现。本研究中miR-141及miR-224联合SCC-Ag诊断NSCLC有较高的诊断价值,其敏感度和特异度为92.5%和82.7%。在单项中miR-141诊断NSCLC的敏感度和特异度较好,为87.4%和84.5%,其最佳截值为1.84。Liu等[15]研究表明,血清miR-141可能成为NSCLC诊断的潜在的新型生物标志物。张洪岩等[16]采用Real-Time PCR技术对31例NSCLC组织及癌旁正常肺组织的miR-224进行定量分析,结果表明miR-224有可能作为NSCLC的重要肿瘤标志物。Yang等[17]研究发现,多种microRNA联合诊断NSCLC的价值较高,其AUC高达0.970,这些microRNA在NSCLC筛查中具有广阔的应用前景。另有研究认为,microRNA的高表达与NSCLC的生存率及致癌作用显著相关,可作为预测NSCLC预后的潜在生物标志物[18]。相关分析显示,NSCLC患者血清miR-141与miR-224呈正相关(r=0.782,P<0.01),提示miR-141和miR-224联合检测有助于提高NSCLC诊断的准确性。Wang等[19]研究也表明,5种血清microRNA联合检测对诊断NSCLC具有较高的价值,其AUC(95%CI)高达0.976(0.939~1.000,P<0.001)。虽然本研究中miR-141及miR-224对NSCLC的诊断效能优于传统的肿瘤标志物(SCC-Ag),但若要应用于临床,仍需要扩大样本量,找到每个分类或者分型的标志物将更有助于NSCLC的诊断。
综上所述,血清miR-141及miR-224相比于传统的肿瘤标志物有较高的特异度和敏感度,且与患者的临床病理特征相关,有望作为诊断NSCLC的新型生物标志物,与SCC-Ag联合应用可提高NSCLC诊断的准确性。
参考文献:
[1]Riquet M,Mordant P,Pricopi C,et al.A review of 250 ten-year survivors after pneumonectomy for non-small-cell lung cancer[J].Eur J Cardiothorac Surg,2014,45(5):876-881.
[2]孙红梅,陈文彰,燕丽香,等.血清肿瘤标志物对老年非小细胞肺癌检测的临床意义[J].中华老年多器官疾病杂志,2013,12(8):619-624.
Sun HM,Chen WZ,Yan LX,et al.Clinical significance of serum tumor markers in elderly patients with non-small cell lung cancer[J].Chinese Journal of Multiple Organ Diseases in the Elderly,2013,12(8):619-624.
[3]Han JG,Jiang YD,Zhang CH,et al.A novel panel of serum miR-21/miR-155/miR-365 as a potential diagnostic biomarker for breast cancer[J].Ann Surg Treat Res,2017,92(2):55-66.
[4]Huang M,Wu L,Qin Y,et al.Anti-proliferative role and prognostic implication of miR-141 in gastric cancer[J].Am J Transl Res,2016,8(8):3549-3557.
[5]Zhu SH,He XC,Wang L.Correlation analysis of miR-200b,miR-200c,and miR-141 with liver metastases in colorectal cancer patients[J].Eur Rev Med Pharmacol Sci,2017,21(10):2357-2363.
[6]Cui R,Kim T,Fassan M,et al.MicroRNA-224 is implicated in lung cancer pathogenesis through targeting caspase-3 and caspase-7[J].Oncotarget,2015,6(26):21802-21815.
[7]Heβ AK,Weichert W,Budach V,et al.The role of microRNAs in head and neck squamous cell carcinoma:Biomarkers for prognosis,therapy selection, and novel therapeutics[J].HNO,2016,64(5):296-302.
[8]Cinpolat O,Unal ZN,Ismi O,et al.Comparison of microRNA profiles between benign and malignant salivary gland tumors in tissue,blood and saliva samples:a prospective,case-control study[J].Braz J Otorhinolaryngol,2017,83(3):276-284.
[9]Li W,Wang Y,Zhang Q,et al.MicroRNA-486 as a biomarker for early diagnosis and recurrence of non-small cell lung cancer[J].PLoS One,2015,10(8):e0134220.
[10]Wang RJ,Zheng YH,Wang P,et al.Serum miR-125a-5p,miR-145 and miR-146a as diagnostic biomarkers in non-small cell lung cancer[J].Int J Clin Exp Pathol,2015,8(1):765-771.
[11]Mahdavinezhad A,Mousavi-Bahar SH,Poorolajal J,et al.Evaluation of miR-141,miR-200c,miR-30b expression and clinicopathological features of bladder cancer[J].Int J Mol Cell Med,2015,4(1):32-39.
[12]Ling H,Pickard K,Ivan C,et al.The clinical and biological significance of MIR-224 expression in colorectal cancer metastasis[J].Gut,2015,65(6):977-989.
[13]Mei Z,He Y,Feng J,et al.MicroRNA-141 promotes the proliferation of non-small cell lung cancer cells by regulating expression of PHLPP1 and PHLPP2[J].FEBS Lett,2014,588(17):3055-3061.
[14]Wang L,Liu W,Zhang YP,et al.The miR-224 promotes non-small cell lung cancer cell proliferation by directly targeting RASSF8[J].Eur Rev Med Pharmacol Sci,2017,21(14):3223-3231.
[15]Liu XG,Zhu WY,Huang YY,et al.High expression of serum miR-21 and tumor miR-200c associated with poor prognosis in patients with lung cancer[J].Med Oncol,2012,29(2):618-626.
[16]张洪岩,鲁继斌,杨伟,等.miR-224,miR-135a在非小细胞肺癌中的表达及与临床病理的关系[J].现代肿瘤医学,2012,20(10):2057-2059.
Zhang HY,Lu JB,Yang W,et al.Expression of miR-224 and miR-135a in non-small cell lung cancer and the relation with clinical pathology[J].Modern Oncology,2012,20(10):2057-2059.
[17]Yang JS,Li BJ,Lu HW,et al.Serum miR-152,miR-148a,miR-148b,and miR-21 as novel biomarkers in non-small cell lung cancer screening[J].Tumour Biol,2015,36(4):3035-3042.
[18]Si L,Tian H,Yue W,et al.Potential use of microRNA-200c as a prognostic marker in non-small cell lung cancer[J].Oncol Lett,2017,14(4):4325-4330.
[19]Wang C,Ding M,Xia M,et al.A Five-miRNA panel identified from a multicentric case-control study serves as a novel diagnostic tool for ethnically diverse non-small-cell lung cancer patients[J].EBio Medicine,2015,2(10):1377-1385.

