全国566家临床实验室血清降钙素原室内质量控制不精密度调查与分析
刘佳丽,王 薇,何法霖,钟 堃,袁 帅,张志新,杜雨轩,王治国
(北京医院 国家老年医学中心 卫生部临床检验中心/北京市临床检验工程技术研究中心,北京 100730)
血清降钙素原(procalcitonin,PCT)是降钙素(calcitonin,CT)的前体蛋白,其生成受到细菌毒素及多种炎性细胞因子的调节[1]。在非感染状态下,甲状腺C细胞主要分泌PCT,调节体液中的钙浓度[2]。正常情况下,PCT在健康人血液中浓度非常低,通常小于0.05 ng/ml。在发生细菌感染尤其是重症感染时,不仅甲状腺能合成PCT,肝脏单核细胞、巨噬细胞、肠道、肺组织的内分泌细胞、淋巴组织都能合成和分泌PCT,进而导致血清中的PCT水平显著上升[3]。PCT在全身产生并释放入血液循环,是感染和脓毒症的标记蛋白。PCT在多种感染性疾病的早期快速诊断、鉴别诊断、病程监测、指导用药等方面发挥着重要作用[4],PCT与细菌性感染有很好的相关性,其浓度和炎症严重程度正相关,对细菌感染和病毒感染的鉴别能力高于其他生物标记物[5],是一个非常有应用价值的诊断感染状态的生物学指标。
室内质量控制(internal quality control,IQC)和室间质量评价(external quality assessment,EQA)是检测结果可靠性和准确性的基本保证,其中IQC是质量管理的基础,是临床实验室发出每个批次检验报告的客观证据[6]。室内质量控制(IQC)数据的变异系数(coefficient of variation,CV)大小代表着实验室检测系统的不精密度水平,只有测量系统的精密度好才能获得准确可靠的结果。本研究对血清PCT项目的室内质量控制在控数据当月和累积CV进行调查并与相应允许不精密度进行比较分析,以了解我国临床实验室PCT项目IQC现状。
1 材料和方法
1.1材料来源使用基于Web的室间质量评价(external quality assessment,EQA)软件系统,采用参加血清降钙素原(PCT)项目EQA计划的566家临床实验室上报的2017年3月的室内质量控制(internal quality control,IQC)数据。包括2017年3月当月和累积的IQC在控数据CV以及实验室所使用的检测系统。其中当月CV即为2017年3月血PCT的不精密度水平,而累积CV则为该项目的长期不精密度水平。
1.2方法
1.2.1使用卫生部临床检验中心EQA计划可接受限[7]作为总允许误差(total allowable error,TEa,室间质量评价限),依据1/3TEa(10%),1/4 TEa(7.5%)计算血PCT项目两个批号的当月和累积室内质控变异系数的通过率(通过率=当月或累计在控CV满足标准的实验室数/参与调查的实验室总数)。
1.2.2按照血PCT项目参加EQA的实验室上报IQC所使用的检测仪器进行分组统计,按照两个评价标准计算各组的通过率。
1.2.3分析配套与非配套系统变异系数的通过率情况。
2 结果
2.1不精密度通过率2017年3月份实验室回报IQC结果中剔除无效数据和离群值后,批号1共有566家临床实验室上报了结果,批号2上报结果实验室数不足上报实验室总数的一半。批号1中当月在控变异系数满足1/3TEa和1/4TEa的实验室分别有514家和442家,实验室所占比例分别为90.8%和78.1%;累积在控变异系数满足1/3TEa和1/4TEa的实验室分别有504家和433家,实验室所占比例分别为89.0%和76.5%。批号2共有201家实验室上报了结果,其中当月在控变异系数满足1/3TEa和1/4TEa的实验室分别有191家和171家,实验室所占比例分别为95.0%和85.1%;累积在控变异系数满足1/3TEa和1/4TEa的实验室分别有189家和169家,实验室所占比例分别为94.0%和84.1%。两个批号的相同标准下的通过率接近,批号2的通过率相对更高。
批号2中满足两个标准的实验室比例都在80%以上,但是上报实验室数仅为201家,不足上报实验室总数的1/2,说明部分实验室在日常测试中仅做了一个浓度水平质控品的质控。CLSI C24-A3[8]指出至少应该做2个浓度水平的质控,Westgard[9]也指出一般应该做2~3个水平的质控,一个在正常范围,另一个异常低于或者异常高于所在范围。结果表明大多数实验室并未按照相关要求进行操作。
2.2按仪器分组统计不精密度通过率批号1上报PCT室内质控数据的实验室使用的检测仪器主要为:罗氏(273/566)、梅里埃(104/566)、广州万孚(36/566)、深圳新产业(26/566)、北京热景(19/566)、武汉明德(12/566)。批号2上报PCT室内质控数据的实验室使用的检测仪器主要为:罗氏(129/201),梅里埃(41/201),深圳新产业(5/201)、北京热景(5/201)。
整体上看,参加单位所用各仪器比例参差不齐,见表1。两个批号中,上报实验室使用的仪器中罗氏所占比例最高(近半数),且无论在批号1还是批号2中的当月和累积CV满足两个标准的实验室所占比例均大于90%。其次为梅里埃,批号1和批号2中的当月和累积CV满足1/3TEa标准的实验室所占比例均大于90%,满足1/4TEa标准的实验室所占比例在70.7%~80.8%之间。批号1中使用其它检测仪器系统的当月和累积变异系数满足1/3TEa标准的实验室比例均在半数以上,但满足1/4TEa标准的实验室比例不等,在27.8%~91.7%之间。值得注意的是,广州万孚和北京热景的当月和累积变异系数满足1/4TEa标准的实验室比例非常低(不超过半数),批号2中深圳新产业和北京热景的通过率较高,但是总体使用率低(均为5/201),并不能说明整体情况。
表1
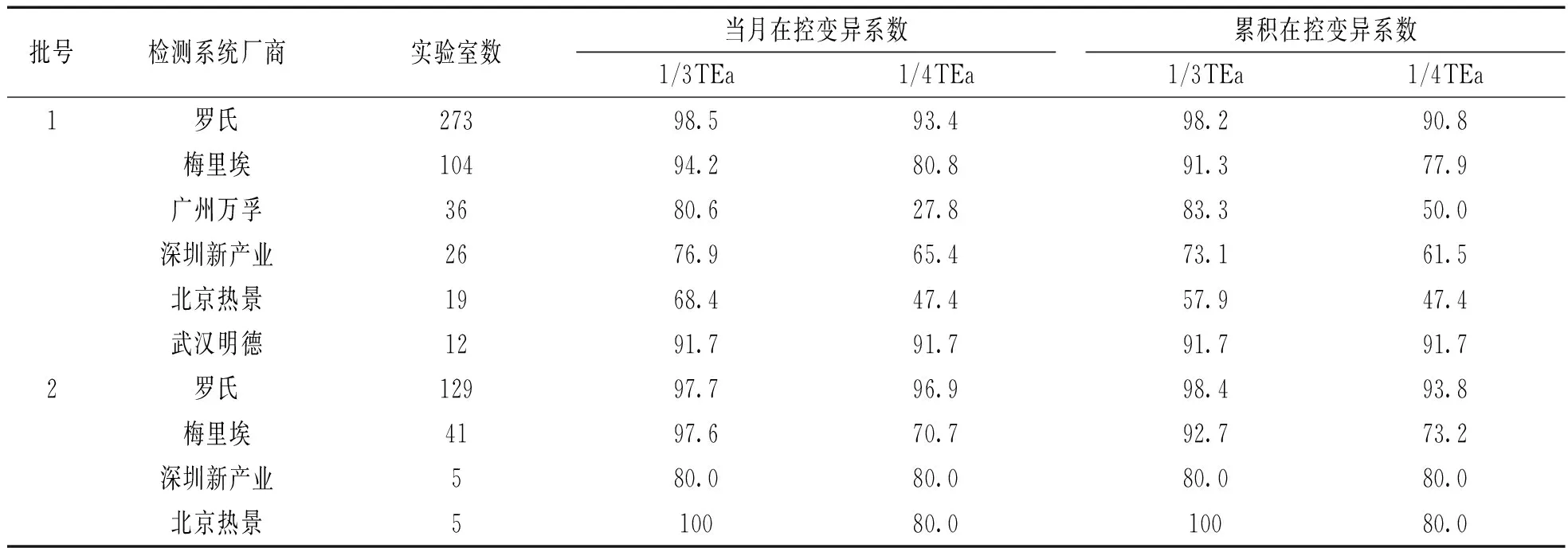
PCT项目批号1,2不同检测系统当月和累积变异系数满足1/3TEa,1/4TEa标准的实验室比例(%)
2.3配套与非配套系统变异系数通过率情况本研究把使用试剂、仪器、校准物一致定义为使用配套系统,相反,不一致的定义为使用非配套系统。统计结果见表2。根据结果可以看出:使用配套系统的实验室数远大于使用非配套系统的实验室数。使用配套系统时,满足两种标准的实验室比例也较高(80%以上),使用非配套系统满足两种标准的实验室所占比例均低于80%(47.4%~76.8%)。通过率明显小于使用配套系统。
表2
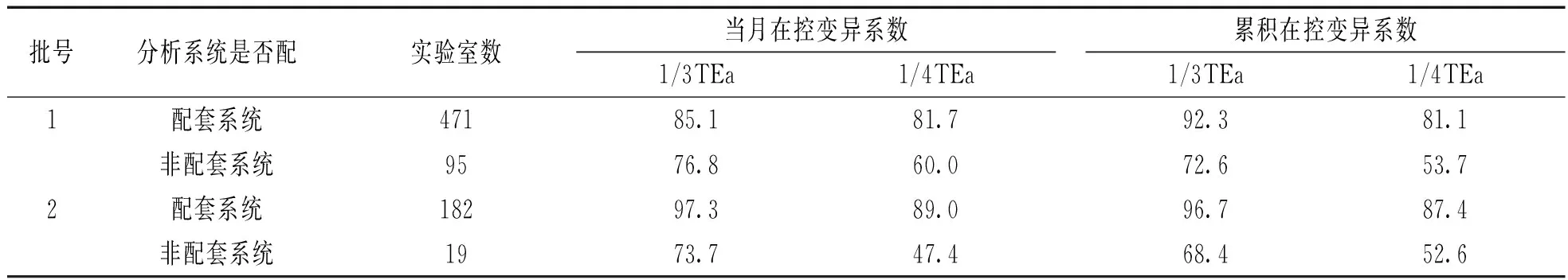
PCT项目批号1,2配套/非配套分析系统当月和累积变异系数满足1/3TEa,1/4TEa标准实验室比例(%)
3讨论本研究中上报实验室中批号1,2当月和累积变异系数满足1/3TEa,1/4TEa标准的实验室比例均较高,但若按照相对较严格的1/4TEa标准来看,批号1的当月和累积在控变异系数分别为81.7%,81.1%和60.0%,53.7%,说明我国目前实验室检测血PCT项目的不精密度水平较好,但仍有待提高。批号2中满足两个标准的实验室比例较高,但是上报实验室数不足总数的1/2,说明部分实验室在日常测试中仅做了一个浓度水平的质控品的质控,所以各实验室应加强和重视对室内质控多浓度(多批号)质控品的测试和上报,以提高我国的实验室检测不精密度,从而得到更加准确的患者的测试报告。
从室内质控检测仪器来看,各实验室使用仪器厂家所占比例不同,国内主流的检测系统厂商为罗氏,其次为梅里埃,且使用这两种检测仪器的实验室的满足两种标准的实验室比例较高,精密度水平较好。使用其他检测仪器系统的当月和累积变异系数满足1/3TEa标准的实验室比例均在半数以上,但满足1/4TEa标准的实验室比例不等,在27.8%~93.4%之间,其中广州万孚和北京热景的实验室比例非常低(不超过半数),批号2中深圳新产业和北京热景的通过率较高,但是总体使用率低,所得结果并不能实际反映使用该仪器的实验室检测的不精密度现状。由于目前各规范性文件中尚未明确提及血PCT的生物学变异导出的质量规范(质量规范层级模型第2级),而1/3TEa,1/4TEa标准仅仅位于层级模型的第4级,可能本研究所讨论到的不精密度评价还不够客观。
本研究考虑到系统是否配套对实验室变异系数的影响。在实际应用中实验室人员的操作、试剂的保存、校准品和质控品的保存及使用、仪器的校准,都会影响到室内质控的变异系数。
综上所述,临床实验室室内精密度与检验结果水平密切相关。室内质控的变异系数代表着实验室检测系统的不精密度水平,良好的实验室精密度水平是准确可靠结果的基础[10]。通过本次对全国降钙素原项目的室内质控数据的分析。所得结果可指导该实验室所测结果是否满足规定的质量要求,为实验室间结果的可比性检验提供精密度的信息。实验室工作人员通过室内质控数据分析可发现在日常测试过程的问题所在,若未满足要求,则应从“人、机、料、法、环”等多方面查找原因,及时分析处理失控数据并改进,不断提高检测质量。
参考文献:
[1]Becker KL,Snider R,Nylen ES,et al.Procalcitonin assay in systemic inflammation,infection,and sepsis:clinical utility and limitations[J].Critical Care Medicine,2008,36(3):941-952.
[2]李沛然,苑文雯,王晗,等.两种降钙素原定量检测试剂盒的比较研究[J].检验医学与临床,2015,12(19):2873-2874,2877.
Li PR,Yuan WW,Wang H,et al.Comparative study of two kinds of procalcitonin quantitative detection kit[J].Laboratory Medicine and Clinic,2015,12(19):2873-2874,2877.
[3]张凤.血清降钙素原与高敏C反应蛋白早期诊断新生儿脓毒血症价值[J].中华实用诊断与治疗杂志,2014,28(1):85-86.
Zhang F.Value of serum procalcitonin and high sensitivity C-reactive protein to the diagnosis of early neonatal sepsis[J].Journal of Chinese Practical Diagnosis and Therapy,2014,28(1):85-86.
[4]徐爱蕾,王为.降钙素原检测方法学和临床意义的研究进展[J].临床军医杂志,2012,40(1):242-244.
Xu AL,Wang W.Progress in the study of methodology and clinical significance on procalcitonin detection[J].Clinical Journal of Medical Officer,2012,40(1):242-244.
[5]刘振国,王婷,王顺达,等.重型肝炎并发脓毒症患者血清降钙素原、血乳酸及肉毒素水平的相关研究[J].现代检验医学杂志,2017,32(2):95-97,164.
Liu ZG,Wang T,Wang SD,et al.Crelational rea-search of the level of plasma procalcitonin,blood lactic acid and endotoxin in patients of severe pneumonia complicated with sepsis[J].Journal of Modern Laboratory Medicine,2017,32(2):95-97,164.
[6]张路,王薇,何法霖,等.B型钠尿肽和N末端B型钠尿肽原室内质量控制变异系数调查与分析[J].临床检验杂志,2015,33(8):635-637.
Zhang L,Wang W,He FL,et al.Analysis of the coefficients of variation for the internal quality control of BNP/NT-pro BNP[J].Chinese Journal of Clinical Laboratory Science,2015,33(8):635-637.
[7]卫生部临床检中心.卫生部临床检验中心室间质量评价标准[EB/OL].2017,2(4).http://www.clinet.com.cn/plan/?type=list&classid=1384&years=2017&labcenterid=11
National Center for Clinical Laboratoies.National Center for Clinical Laboratoies External Quality Assessment Standards[EB/OL].2017.2.4.http://www.clinet.com.cn/plan/?type=list&classid=1384&years=2017&labcenterid=11
[8]Clinical and Laboratory Standards Institute.Statistical Quality Control for Quantitative Measurement Procedures.principles and definitions ;approved guideline-third edition[S].Wayne:PA.CLSI C24-A3,2006.
[9]Westgard JO.Basic QC Practices,3rd edition[M].WI:Westgard QC,Inc,2010.
[10]叶圆圆,王薇,何法霖,等.我国新生儿遗传代谢病串联质谱筛查室内质控变异系数分析[J].临床检验杂志,2016,34(12):901-903.
Ye YY,Wang W,He FL,et al.Analysis of the coefficients of variation for the internal quality control of newborn inherited metabolic diseases screening with tandem mass spectrometry[J].Chinese Journal of Clinical Laboratory Science,2016,34(12):901-903.

