异嗜性抗体干扰化学发光方法检测cTnI的处理和分析
鲁 军,程歆琦,禹松林,侯立安,金 成,由婷婷
(中国医学科学院 北京协和医学院 北京协和医院检验科,北京 100730)
异嗜性抗体是由已知或未知的抗原物质刺激人体产生的一类具有足够滴度、能与多个物种的免疫球蛋白发生相对弱的结合的多重特异性免疫球蛋白[1,2]。它通过非特异性结合捕获抗体和标记抗体,从而干扰测定,出现与临床表现不相符的检测结果。有研究表明,饲养宠物兔是体内形成异嗜性抗体的危险因素,在这些人群中有30%~40%可检测到异嗜性抗体,但仅有0.05%~0.5%在免疫检测中会受到异嗜性抗体的干扰[3],可见异嗜性抗体对样本的干扰几率并不高,但是仍无法保证所有患者标本都能完全免受这种干扰的影响。当出现检测结果和临床特点及病史不相符时,应当慎重判读结果,同时,检验科人员也应该了解怀疑异嗜性抗体干扰时的处理办法。现就我科室出现的一例异嗜性抗体干扰cTnI检测的案例进行分析和处理,报道如下。
1 材料和方法
1.1病例描述患者,男性,65岁。2015年5月无诱因出现持续性中上腹绞痛,就诊当地医院。胃镜示十二指肠炎,补液抑酸、静脉营养等对症治疗,腹痛略好转,每日仍间断发作。2015年11月就诊我院门诊,胃肠镜见十二指肠球腔散在小结节,球后及降段连续弥漫性溃疡性病变,小肠黏膜呈急慢性炎症。病理活检:炎性渗出物、坏死物、肉芽组织。期间给予耐信、吉法酯治疗,症状无明显好转。2016年8月无诱因出现腹泻,每日10余次,外院胃镜见十二指肠球部多发扁平半球状隆起;病理:管状腺瘤。患者近一年来体重持续下降约25kg,于2016年11月3日入住我院消化内科。
入院后查心脏标志物明显升高(cTnI 6.05 ng/ml),多次复查cTnI波动于4~5 ng/ml,无下降趋势,NT-proBNP波动于170~450 pg/ml,CK,CK-MB,BNP均(-),结果见表1。多次心电图均见肢导低电压,未见ST段改变及病理性Q波。超声心动图:左室射血分数(left ventricular ejection fraction,LVEF)74%,节段性室壁运动异常。冠状动脉CTA:右冠优势型,冠状动脉轻度钙化,各分支未见明确狭窄。心脏常规MRI:左室心肌细胞外容积(ECV)弥漫性增高,考虑弥漫性心脏病变,系统性疾病累及心脏可能;左室流出道变窄;房间隔及右房壁略增厚伴高信号,结合CT考虑脂肪沉积。心内科会诊不除外TTR型心脏淀粉样变,cTnI升高原因待查。
表1
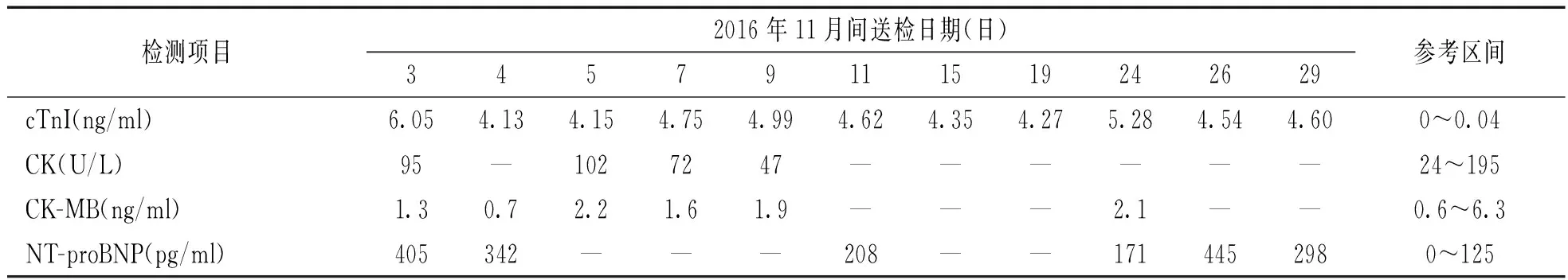
患者生化检测结果
1.2处理方法
1.2.1稀释法处理患者样本:使用Beckman系统厂家提供的样本稀释液:Access Sample Diluent A对患者血浆样本和对照血浆样本分别进行2倍、4倍、8倍稀释处理,处理后的血浆样本使用Beckman系统检测。
1.2.2更换检测系统测定:本实验室检测系统为Beckman Access 2免疫分析仪及配套试剂,检测原理为双位点酶免法(“夹心法”)。现更换为Siemens Dimension Exl化学免疫分析仪和Abbotti2000全自动化学发光免疫分析仪及相应配套试剂,检测原理分别为纯态氧介导化学发光法和化学发光微粒子免疫法。
1.2.3采用异嗜性抗体阻断剂处理患者样本:使用异嗜性抗体阻断剂(美国Scantibodies Laboratory)对样本进行处理。异嗜性抗体阻断剂的种类很多,由于本实验室检测cTnI所用试剂中,捕获抗体和标记抗体均为鼠源性抗人心肌肌钙蛋白I单克隆抗体,故而选择了异嗜性抗体阻断剂I型,该型含有特异性鼠免疫球蛋白。具体操作流程:将145 μl异嗜性抗体阻断剂分别添加到355 μl患者血浆及两例对照血浆中,混匀后放置于37℃水浴箱中孵育30 min,然后使用Beckman系统检测,结果乘以1.41即为原样本中的cTnI值。
2结果该患者最近一次血浆样本以及对照血浆样本使用稀释法处理前后的检测结果见表2。从表2可以看出,患者血浆样本按一定倍数稀释后的结果没有线性变化规律,而对照血浆样本按一定倍数稀释后的结果出现成倍的降低。
表2

患者及对照血浆样本cTnI检测
该患者的最近一次标本在不同检测系统的检测结果见表3。Siemens和Abbott的检测结果均在正常范围内。
表3患者最近一次样本在不同检测系统的结果
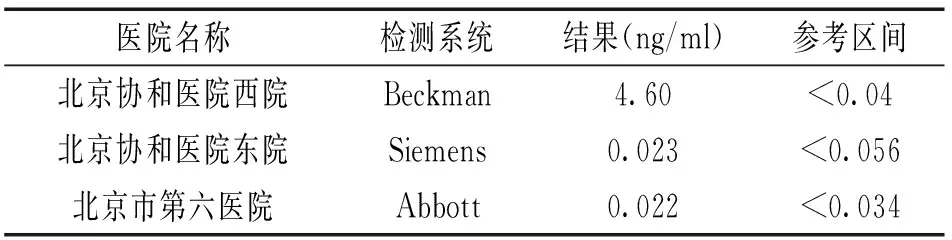
医院名称检测系统结果(ng/ml)参考区间北京协和医院西院北京协和医院东院北京市第六医院BeckmanSiemensAbbott4.600.0230.022<0.04<0.056<0.034
患者最近一次血浆样本以及两例对照血浆样本使用异嗜性抗体阻断剂阻断前后的cTnI检测结果见图1。从图1可以看出,患者最近一次血浆样本阻断后cTnI检测值明显降低,而对照样本阻断前后检测结果无明显变化。
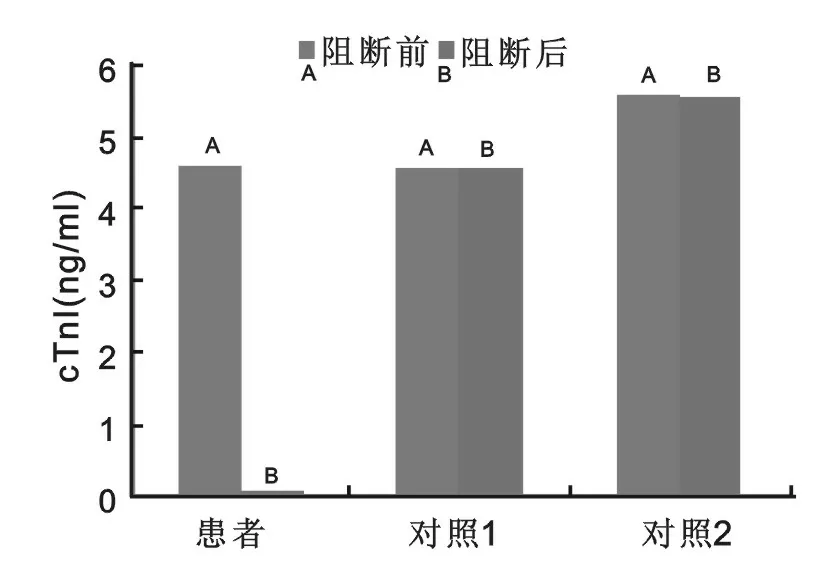
图1 患者、对照1及对照2血浆样本阻断前后cTnI水平
3讨论cTnI的检测基于抗原抗体反应,正常情况下,在夹心法免疫测定中,待测抗原同时结合捕获抗体和标记抗体,形成固相捕获抗体-待测抗原-标记抗体的复合物(见图2中A所示);异嗜性抗体若替代待测抗原,同时结合捕获抗体和标记抗体时,会使结果出现假性增高(见图2中B所示);异嗜性抗体分别与捕获抗体或者标记抗体结合,阻碍待测抗原被试剂抗体识别,使结果出现假性降低(见图2中C所示)[4~6]。本文中患者入院后多次检查cTnI结果均升高,但该患者并无胸痛、胸闷等临床表现,且入院后cTnI虽然升高但是缺乏心肌损伤相应的动态变化(见图3所示)。因此应该怀疑出现如图2中B所示的干扰,造成检测结果出现假性升高。后经稀释法处理以及更换检测系统和异嗜性抗体阻断等处理方法亦证实了笔者的推断,即该患者cTnI在Beckman系统上结果升高为假阳性结果,是由异嗜性抗体干扰引起的。该患者经过我院心内科、血液科、放射科、病理科和检验科的多科会诊后,也排除了心肌损伤的可能性。因此,虽然心脏常规MRI提示有弥漫性心脏病变或系统性疾病累及心脏可能,但是该方法诊断心肌损伤的准确性还有待商榷和验证。

A为夹心法免疫测定正常反应机制;B,C为干扰因素可能产生的反应机制。
图2夹心免疫分析法

图3 2016年11月间患者cTnI检测结果
异嗜性抗体包括天然抗体和一些自身抗体,可能来自于污染的食物、与动物的接触或动物血清类疫苗接种等。目前免疫方法检测中使用的抗体多数源于实验动物,因此患者体内若含有异嗜性抗体,其可干扰待测物质与试剂中的抗体结合,导致结果出现假阳性或假阴性。另外,自然产生或自身免疫源性的类风湿因子(RF)也是免疫检测过程中干扰的主要因素。RF是由于细菌、病毒等引起体内产生的以变性IgG为抗原的一种抗体,可模拟异嗜性抗体的作用而结合免疫检测法中的捕获抗体和标记抗体引起假阳性结果,在日常检测中比较多见[7,8]。
免疫检测过程中重要的干扰因素就是异嗜性抗体,所以需要我们使用一些方法来消除干扰。当怀疑免疫检测中存在干扰时,可用一些方法进行鉴别[6,9,10]:①按一定倍数将标本进行稀释,结果出现成倍的降低,则为线性结果,表明标本未受到异嗜性抗体等的干扰,如果稀释后结果不成线性,则很可能说明检测结果受到了干扰;②更换另一种检测方法,得出的结果与原检测方法对比;③添加阻断剂以及物理化学技术对标本进行预处理后检测;④直接检测标本中异嗜性抗体或自身抗体的浓度。
本文采用了上述前三种方法进行分析研究。按一定倍数稀释患者血浆样本,稀释后的结果不成线性;直接使用不同检测系统(Siemens检测系统和Abbott检测系统)检测,cTnI结果均在正常参考区间内;添加异嗜性抗体阻断剂处理患者血浆,阻断后cTnI结果明显下降。三种处理方法均表明该患者原检测系统(Beckman系统)的cTnI结果受到了干扰。根据第一种方法倍比稀释的患者血浆样本结果不成线性且第三种方法采用异嗜性抗体阻断剂处理后的患者血浆样本结果明显降低,故而考虑异嗜性抗体干扰的可能性大。结合病人的临床表现,考虑更换检测系统后和阻断处理后的检测结果与其更加符合。但是同一种异嗜性抗体对不同检测试剂的干扰程度是不同的,所以没有哪一个方法可以彻底去除异嗜性抗体的干扰[9,11]。在我院东院区使用的Siemens检测平台上也出现过异嗜性抗体干扰cTnI检测的情况。
目前大多数试剂盒的说明书中都有类似检验方法局限性的提示,即患者样本中可能存在异嗜性抗体,造成结果假性升高或假性降低,此测试法的设计将异嗜性抗体的干扰降至最低[12],然而不能保证把来自所有患者标本中的此类干扰全部清除掉。因此,检验结果应根据患者的临床表现和其他辅助检查结果综合判断。
4结论本文中该患者的cTnI检测结果受到了异嗜性抗体的干扰,通过更换检测方法和异嗜性抗体阻断可以有效解决相应的干扰。检验人员不仅要对免疫检测法中的干扰因素和干扰机制有一定的认识,还要了解相关的处理方法。临床医生也应该对检验方法的局限性有所了解,一旦出现临床表现和检验结果不符时,应当及时联系检验医师,进而确定是否存在干扰并设法解除干扰。
参考文献:
[1]Rotmensch S,Cole LA,Rotmensch S,et al.False diagnosis and needless therapy of presumed malignant disease in women with false-positive human chorionic gonadotropin concentrations[J].Lancet,2000,355(9205):712-715.
[2]Jahagirdar VR,Strouhal P,Holder G,et al.Thyrotoxicosis factitia masquerading as recurrent Graves’ disease:endogenous antibody immunoassay interference,a pitfall for the unwary[J].Annals of Clinical Biochemistry,2008,45(Pt 3):325-327.
[3]倪娟,高洪柳,王国洪,等.化学发光法检测促甲状腺激素结果假性增高1例[J].临床检验杂志,2016,34(9):720.
Ni J,Gao HL,Wang GH,et al.Chemiluminescence method for the detection of thyroid stimulating hormone in 1 case[J].Chinese Journal of Clinical Laboratory Science,2016,34(9):720.
[4]蒋利君,黎宇,戴盛明.异嗜性抗体对免疫测定干扰的研究进展[J].分子诊断与治疗杂志,2010,2(1):68-72.
Jiang LJ,Li Y,Dai SM.Heterophil antibody interference in immunoassay[J].Journal of Molecular Diagnosis and Therapy,2010,2(1):68-72.
[5]Bonetti A,Monica C,Bonaguri C,et al.Interference by heterophilic antibodies in immunoassays:wrong increase of myoglobin values[J].Acta Bio-Medica:Atenei Parmensis,2008,79(2):140-143.
[6]韦维,戴盛明.异嗜性抗体在免疫测定中干扰的研究进展[J].国际检验医学杂志,2010,31(10):1123-1126.
Wei W,Dai SM.Research progress of heterophilic antibodies in immunoassay[J].International Journal of Laboratory Medicine,2010,31(10):1123-1126.
[7]王焰,黄晓雪,马莉,等.异嗜性抗体对化学发光检测结果的影响[J].贵阳医学院学报,2013,38(1):94-96.
Wang Y,Huang XX,Ma L,et al.Effect of heterophile antibodies on chemiluminescence detection results[J].Jouranl of Guiyang Medical College,2013,38(1):94-96.
[8]张娟,韦清,刘君君.EP14-A3文件在试剂内源性抗体干扰研究中的应用[J].国际检验医学杂志,2015,36(17):2533-2535.
Zhang J,Wei Q,Liu JJ.The application of EP14-A3 in the evaluation of ednogenous antibodies interference in immunoassay reagent[J].International Journal of Laboratory Medicine,2015,36(17):2533-2535.
[9]唐古生,吴豫,沈茜.免疫检测干扰因素的分析、识别和对策[J].中华检验医学杂志,2009,32(7):725-729.
Tang GS,Wu Y,Shen Q.Analysis,identification and strategies on interference in immunoassay[J].Chinese Journal of Laboratory Medicine,2009,32(7):725-729.
[10]Emerson JF,Lai KKY.Endogenous antibody interferences in immunoassays[J].Lab Medicine,2013,44(1):69-73.
[11]Grouzmann E,Dayer NC,Bain C,et al.Eliminating heterophilic antibody interference for ferritin detection using Olympus F(ab’)2 based reagent[J].Clinical Laboratory,2008,54(9/10):355-357.
[12]张保平,刘珊,韩艳秋.使用化学发光法检测26 707例血清抗梅毒螺旋体特异性抗体以及结果假阳性率分析[J].现代检验医学杂志,2015,30(2):70-73.
Zhang BP,Liu S,Han YQ.Analyze of the false positive rate of serum anti treponema pallidum specific antibody of 26 707 cases detected chemiluminescence method[J].Journal of Modern Laboratory Medicine,2015,30(2):70-73.

