HPV阳性宫颈癌和CIN患者血浆miR-150,SCCA及CA125的表达及临床意义
林丽慧,唐 梅,于春玲,林万妹
(海南西部中心医院妇产科,海南那大 571799)
宫颈癌是最常见的妇科恶性肿瘤之一,其发生、发展和转归是一个极其复杂的多阶段、多基因调控异常的过程[1]。人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌及宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)发生的高危因素,而CIN是宫颈癌的癌前病变,早期诊断和治疗CIN对于预防宫颈癌有着重要的意义。研究表明,鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)及糖类抗原125(carbohydrate antigen 125,CA125)对宫颈癌患者辅助诊断、病情监测、预后评估具有一定的临床价值[2]。近期的研究发现,miR-150与多种恶性肿瘤的发生有关,可能在肿瘤发生过程中发挥癌基因的作用[3,4]。本研究通过检测血浆miR-150,SCCA及CA125在HPV阳性宫颈癌患者中的表达情况,分析miR-150表达与宫颈癌临床病理特征间的关系,旨在为宫颈癌的早期诊断及靶向治疗提供依据。
1 材料和方法
1.1研究对象选取2015年1月~2017年9月海南西部中心医院妇产科收治的HPV阳性宫颈癌患者108例(宫颈癌组),年龄31~75(48.16±10.52)岁。纳入标准:①符合国际妇产科联合会(FIGO)分类标准和WHO分级标准,且经病理确诊为宫颈癌者;②选取高危型HPV(HR-HPV)阳性者,如HPV16,18,31,33,35,39,45;③术前均未接受放射治疗、化疗及生物免疫治疗者。宫颈癌临床分期:Ⅰ期39例,Ⅱ期51例,Ⅲ期13例,Ⅳ期5例;病理类型:鳞状细胞癌98例,腺癌10例;病理分级:G1 16例,G2 39例,G3 53例;有淋巴结转移19例,无淋巴结转移89例。另取同期与宫颈癌患者年龄匹配的HPV阳性宫颈上皮内瘤样病变患者40例(CIN Ⅱ 13例,CIN Ⅲ 27例)作为CIN组和HPV单纯阳性或HPV阳性子宫良性病变者40例作为对照组。所有研究对象均于清晨空腹抽取静脉血5 ml,离心分离血浆后保存于-80℃冰箱待检。
1.2仪器和试剂RNA提取试剂盒购自德国Qiagen公司,在ABI 7500型荧光定量PCR仪上进行实时荧光定量聚合酶链反应(RT-PCR)。贝克曼和罗氏电化学发光免疫分析仪及配套试剂盒,化学发光法测定SCCA和CA125水平。
1.3miRNA逆转录及RT-PCR检测取300 μl血浆样本,加入1 ml总miRNA提取液,按照血液总miRNA快速提取试剂盒(miRNeasy血浆提取试剂盒)说明书从血浆中提取总RNA。以U6为实验内参,miRNA逆转录反应体系:5 μl RNA模板,3 μl U6及miRNA特异性茎环引物,0.15 μl 100 mmol/L dNTPs(with dTTP),1.00 μl逆转录酶(50U/μl),1.50 μl 10×反转录缓冲液,0.19 μl RNase抑制剂(20 U/μl),4.16 μl无菌三蒸水。反应条件:16℃ 30 min,42℃30 min,85℃5 min,4℃保存,进行逆转录反应。以U6为实验内参,反应体系为20 μl:1.00 μl TaqMan Small RNA Assay(20×)溶液,10.00μl TaqMan⑧Universal PCR Master MixⅡ(2×)溶液,1.33 μl反转录产物cDNA,7.67μl DEPC水。扩增条件为:95℃10 min 1个循环,95℃ 15 s,60℃60 s进行40个循环,实验重复3次。每个反应体系中荧光信号达到所设定的阈值的经历的循环数即为Ct值,以U6为内参照,采用2-△△Ct法计算miR-150的相对表达水平,其中△Ct=Ct目的基因-CtU6。
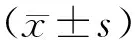
2 结果
2.1各组血浆miR-150,SCCA及CA125表达水平比较见表1。宫颈癌组血浆miR-150,SCCA及CA125表达水平均明显高于CIN组和对照组,差异均有统计学意义(P<0.01);CIN组血浆miR-150表达水平明显高于对照组,差异有统计学意义(P<0.01)。
表1
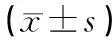
各组血浆miR-150,SCCA及CA125表达水平比较
2.2HPV阳性宫颈癌患者血浆miR-150表达与临床病理特征的关系见表2。随着宫颈癌临床分期的进展,miR-150表达水平逐渐升高,Ⅲ~Ⅳ期HPV阳性宫颈癌患者中miR-150表达水平明显高于Ⅰ~Ⅱ期,差异有统计学意义(P<0.01)。血浆miR-150表达水平与淋巴结转移、浸润深度也相关(P<0.05),而与年龄、病理类型、病理分级、肿瘤大小及绝经状态无关(P>0.05)。
表2
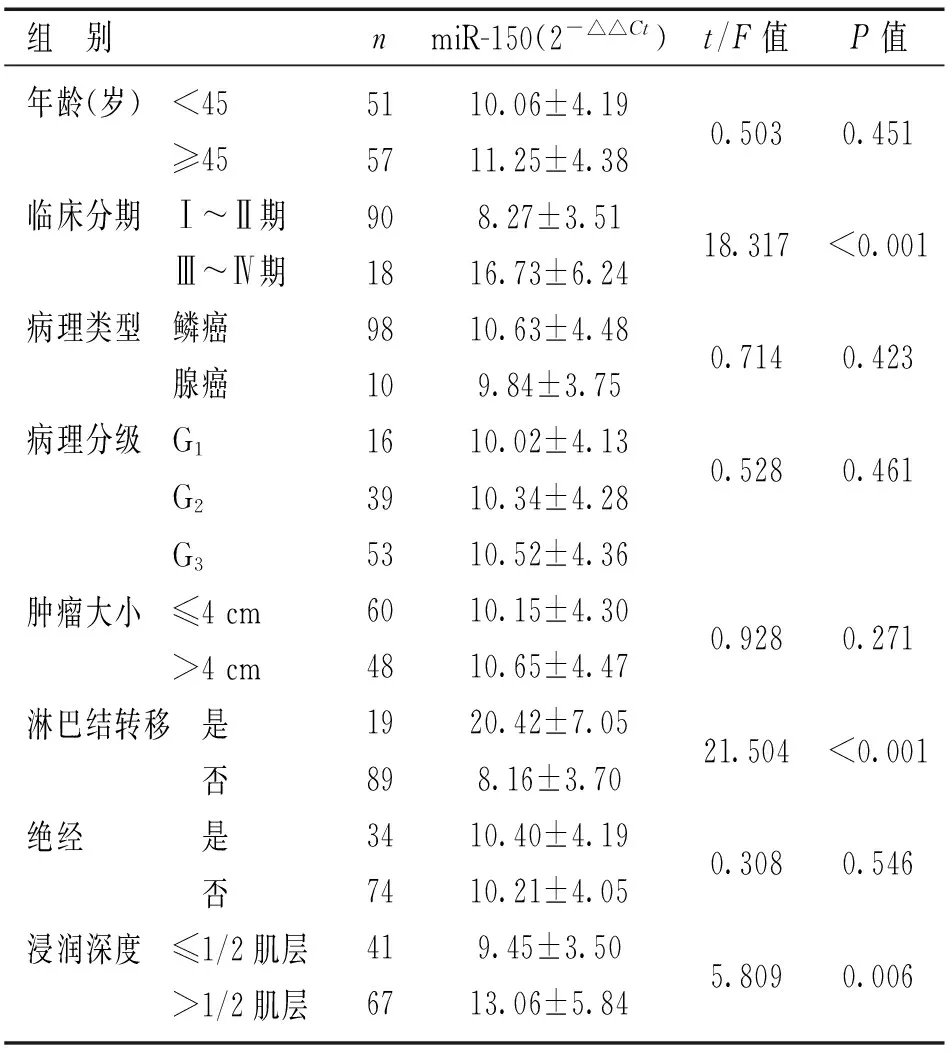
HPV阳性宫颈癌患者血浆
2.3血浆miR-150,SCCA及CA125对HPV阳性CIN的诊断价值见图1和表3。血浆miR-150,SCCA及CA125诊断HPV阳性CIN的曲线下面积(AUC)及95%CI分别为0.830(0.750~0.906),0.703(0.625~0.781),0.624(0.547~0.698),与对照组(AUC=0.5)比较,差异均有统计学意义(P<0.01)。血浆miR-150诊断HPV阳性CIN的最佳截值为3.46,敏感度和特异度为81.0%和80.2%。

图1 血浆miR-150,SCCA及CA125诊断HPV阳性CIN的ROC曲线
表3

血浆miR-150,SCCA及CA125对HPV阳性CIN的诊断价值
2.4血浆miR-150,SCCA及CA125对HPV阳性宫颈癌的诊断价值见图2和表4。

图2 血浆miR-150,SCCA及CA125诊断HPV阳性宫颈癌的ROC曲线
血浆miR-150,SCCA及CA125诊断HPV阳性宫颈癌的曲线下面积(AUC)及95%CI分别为0.881(0.801~0.964),0.780(0.712~0.863),0.679(0.602~0.754),与对照组(AUC=0.5)比较,差异均有统计学意义(P<0.01)。血浆miR-150诊断HPV阳性宫颈癌的最佳截值为8.25,敏感度和特异度为87.0%和84.3%。
2.5多元Logistic回归分析血浆miR-150,SCCA,CA125与HPV阳性宫颈癌的关系见表5。把宫颈癌组与对照组作为二分变量,以miR-150,SCCA及CA125作为自变量,应用多元Logistic回归模型对两组数据进行分析。结果显示,血浆miR-150和SCCA水平升高是HPV阳性宫颈癌发生的独立危险因素[OR(95%CI)=2.107(1.915~2.814),OR(95%CI)=1.583(1.327~2.036)]。
表4

血浆miR-150,SCCA及CA125对HPV阳性宫颈癌的诊断价值
3讨论微小核糖核酸(microRNA,miR)是一类由18~25个核苷酸小分子组成的非编码单链小RNA,在肿瘤生理病理过程中发挥着重要的调控作用,有望成为一种新的疾病诊断、分类和预后判断的工具[5]。HPV检测是临床上筛查宫颈癌的常用方法,而HR-HPV与宫颈癌的发生发展密切相关[6]。HR-HPV主要通过早期表达的调节蛋白作用于宿主细胞的microRNA,引起宿主细胞生物学行为改变,进而导致宿主细胞发生癌变。有研究证实,血浆miR-150在多种恶性肿瘤中异常表达,是诊断恶性肿瘤患者的特异性标记物[7]。然而,血浆miR-150能否作为宫颈癌早期诊断的分子标志物,目前尚未明确。
表5

多元Logistic回归分析血浆miR-150,
本研究结果显示,宫颈癌组血浆miR-150,SCCA及CA125表达水平均明显高于CIN组和对照组,CIN组血浆miR-150表达水平明显高于对照组,Ⅲ~Ⅳ期患者血浆miR-150的表达水平明显高于Ⅰ~Ⅱ期。提示miR-150水平与宫颈癌的病情进展密切相关,可能参与宫颈癌的发生发展。Yin等[8]研究表明,miR-150对肿瘤细胞的增殖、分化、迁移、凋亡及机体肿瘤免疫应答等方面发挥着重要的作用,并与恶性肿瘤的预后判断、临床病理分期及转移情况有关。Ghose等[9]研究认为,宫颈癌患者miR-150表达水平异常升高,miR-150通过调节基因表达水平促进宫颈癌细胞的增殖。另有研究表明,miR-150表达水平上调与宫颈癌组织中临床病理分期、淋巴结转移、血管侵犯、HPV感染和生存情况相关,它可以作为宫颈癌潜在的预后标志物和治疗靶点[10]。此外,进一步分析miR-150表达与宫颈癌临床病理特征的关系,发现有淋巴结转移及浸润深度>1/2肌层的宫颈癌患者miR-150表达水平明显升高,提示miR-150与HPV阳性宫颈癌患者的病情进展有关,分析其原因可能是存在淋巴结转移的患者肿瘤负荷往往较大,肿瘤组织可释放更多的具有原癌基因作用的microRNA进入血液,同时可抑制机体原有的具有抑癌作用的microRNA水平表达,进而导致机体microRNA表达水平异常升高;浸润越深的患者病情进展越快,肿瘤组织microRNA表达水平升高越明显。Li等[11]研究也证实,miR-150是宫颈癌病理过程的重要调节因子,miR-150上调可促进宫颈癌细胞的增殖,miR-150下调可抑制宫颈癌细胞的生长。
笔者应用ROC曲线分析,结果显示血浆miR-150对HPV阳性宫颈癌和CIN的诊断效能明显优于传统肿瘤标志物SCCA和CA125,其敏感度和特异度均较高。说明血浆miR-150在HPV阳性宫颈癌的早期诊断和CIN鉴别诊断方面具有一定的临床价值。Wang等[12]研究表明,microRNA作为一种新的生物标志物,可用于监测宫颈癌的进展和诊断HPV感染导致的宫颈癌。Liu等[13]研究发现,microRNA异常高表达与CIN分级和宫颈癌相关,是宫颈癌早期诊断和预后判断的可靠生物学标志物。本研究中,血浆miR-150和SCCA水平升高是HPV阳性宫颈癌发生的独立危险因素,而与年龄、病理类型、病理分级、肿瘤大小及绝经状态无关。提示miR-150可独立作为宫颈癌早期诊断的分子标志物。Liang等[14]研究认为,microRNA的异常表达与宫颈癌的淋巴结转移情况、化疗耐药性以及整体生存情况明显相关,它可以作为宫颈癌预后的重要评判指标。He等[15]研究也发现,miR-150在宫颈癌的发生、发展中发挥了一定的促进作用,有望成为宫颈癌早期诊断的潜在标志物。另有研究表明,血浆miR-150高表达对恶性肿瘤的总生存率有显著影响,它可作为恶性肿瘤诊断和预后评估的一种新型肿瘤标志物[16]。由此可见,血浆miR-150检测可作为宫颈癌筛查和辅助诊断方法,在HPV阳性宫颈癌中具有一定临床应用价值。
综上所述,血浆miR-150在HPV阳性宫颈癌患者中明显上调,与SCCA和CA125传统肿瘤标志物相比,其诊断HPV阳性宫颈癌的敏感度和特异度均较高,有望作为HPV阳性宫颈癌早期诊断和CIN鉴别诊断的新型分子标志物。但miR-150在宫颈癌的研究尚处于早期阶段, 有关miR-150表达异常在宫颈癌发生、发展中的作用机制及其调控机制仍有待进一步深入研究。
参考文献:
[1]Mi Y,Wang L,Zong L,et al.Genetic variants in microRNA target sites of 37 selected cancer-related genes and the risk of cervical cancer[J].PLoS One,2014,9(1):e86061.
[2]杨辉,郑君.联合检测血清SCCA,CA19-9及CA125对宫颈癌诊断及预后判断的临床意义[J].中国妇幼保健,2013,28(5):772-774.
Yang H,Zheng J.Clinical significance of joint detection of serum SCCA,CA19-9 and CA125 for diagnosis and prognosis evaluation of cervical cancer[J].Matern Child Health Care of China,2013,28(5):772-774.
[3]Liu DZ,Zhang HY,Long XL,et al.MIR-150 promotes prostate cancer stem cell development via suppressing p27Kip1[J].Eur Rev Med Pharmacol Sci,2015,19(22):4344-4352.
[4]Sarlinova M,Halasa M,Mistuna D,et al.MiR-21,miR-221 and miR-150 are deregulated in peripheral blood of patients with colorectal cancer[J].Anticancer Res,2016,36(10):5449-5454.
[5]Li JH,Sun SS,Li N,et al.MiR-205 as a promising biomarker in the diagnosis and prognosis of lung cancer[J].Oncotarget,2017,8(54):91938-91949.
[6]Zhao XL,Hu SY,Zhang Q,et al.High-risk human papillomavirus genotype distribution and attribution to cervical cancer and precancerous lesions in a rural Chinese population[J].J Gynecol Oncol,2017,28(4):e30.
[7]Yan J,Li X,Peng L,et al.MicroRNA-150 as a potential biomarker in diagnosis of cancer:a meta-analysis[J].Clin Lab,2017,63(7):1187-1197.
[8]Yin QW,Sun XF,Yang GT,et al.Increased expression of microRNA-150 is associated with poor prognosis in non-small cell lung cancer[J].Int J Clin Exp Pathol,2015,8(1):842-846.
[9]Ghose J,Bhattacharyya NP.Transcriptional regulation of microRNA-100,-146a,and -150 genes by p53 and NFκB p65/RelA in mouse striatal STHdh(Q7)/Hdh(Q7) cells and human cervical carcinoma HeLa cells[J].RNA Biol,2015,12(4):457-477.
[10]李均,冯露,徐凡,等.miR-150在宫颈癌组织中的表达及临床意义[J].现代肿瘤医学,2017,25(21):3487-3490.
Li J,Feng L,Xu F,et al.The expression and clinical significance of miR-150 in cervical cancer tissue[J].Modern Oncology,2017,25(21):3487-3490.
[11]Li J,Hu L,Tian C,et al.MicroRNA-150 promotes cervical cancer cell growth and survival by targeting FOXO4[J].BMC Mol Biol,2015,16(12):24.
[12]Wang X,Wang HK,Li Y,et al.MicroRNAs are biomarkers of oncogenic human papillomavirus infections[J].Proc Natl Acad Sci USA,2014,111(11):4262-4267.
[13]Liu P,Xin F,Ma CF.Clinical significance of serum miR-196a in cervical intraepithelial neoplasia and cervical cancer[J].Genet Mol Res,2015,14(4):17995-18002.
[14]Liang H,Li Y,Luo RY,et al.MicroRNA-215 is a potential prognostic marker for cervical cancer[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(2):207-212.
[15]He Y,Lin J,Ding Y,et al.A systematic study on dysregulated microRNAs in cervical cancer development[J].Int J Cancer,2016,138(6):1312-1327.
[16]Ma Y,Zhang P,Wang F,et al.MiR-150 as a potential biomarker associated with prognosis and therapeutic outcome in colorectal cancer[J].Gut,2012,61(10):1447-1453.

