自身免疫性胰腺炎患者血清外泌体中CD69表达升高及意义
李腾达,龙曙萍,黄元兰,刘 鹏,张薇薇,郭 杰,刘 云,谷明莉,邓安梅
(1.第二军医大学长海医院,上海 200433;2.解放军455医院,上海 200052)
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种新的胰腺疾病类型,被分为1型与2型,由于其生物学检测的低灵敏性及标志物的非特异性,使AIP的早期诊断及鉴别诊断成为难点[1]。目前关于AIP的病理机制研究发现,CD4+T细胞是参与病理过程的重要细胞:Th2型细胞因子IL-4和Treg分泌的调节性细胞因子IL-10,TGF-β在病人病理组织中上调,参与了疾病形成过程[2];Th1型细胞及其细胞因子IFN-γ在外周血中上升,影响了疾病的发生发展[3]。
外泌体(exosomes)是一种稳定的细胞外囊泡,大小为50~150 nm,表面有丰富的蛋白CD63,CD9和CD81,包含了细胞内全面的生物信息,被视为母细胞的“指纹印迹”[4]。目前有研究报道外泌体可能与急性胰腺炎相关的肺部损伤[5]、胰腺癌肿瘤转移相关[6],但外泌体在AIP中的研究尚未进行。CD69是一种T细胞激活早期表达的表面分子,其在CD4+T细胞中表达[7],与自身免疫性疾病如自免性糖尿病、自免性肝炎等密切相关[8,9],研究表明在AIP的小鼠模型MRL/MpJ中,CD4+/CD69+Th细胞与疾病严重程度相关,CD69可能通过影响CD4+T细胞参与了AIP的致病过程[10]。基于此,本实验拟比较CD69在AIP病人和健康人血清外泌体中的表达量,并进一步探讨其与CD4+T细胞所分泌的细胞因子的相关性,旨在为AIP疾病提供新的诊治靶点和思路。
1 材料和方法
1.1研究对象收集2012年10月~2016年12月来第二军医大学长海医院就诊的35例AIP病人血清作为实验组,收集同期就诊的35例健康个体血清作为对照组,所有血清冻存于-80℃待用。AIP诊断标准参见国际胰腺疾病学会关于自身免疫性胰腺炎的国际统一诊断标准指南,实验组年龄为66.36±7.78岁,男女比例为19∶6。健康对照组年龄为64.24±8.67岁,男女比例为3∶1。两组年龄、性别差异无统计学意义(P<0.05)。本研究经第二军医大学长海医院医学科研伦理委员会批准,所有受试对象均签署知情同意书。
1.2试剂与仪器ELISA试剂盒(美国eBioscience公司),酶标仪(Thermo Scientific公司),生物分光光度计(德国Eppendorf公司),离心机(美国Beckman),流式细胞仪(美国Beckman),透射电镜(日本电子),抗体(美国Abcam公司),磁珠(上海秉宏生物科技公司)。
1.3方法
1.3.1血清收集:采集无抗凝剂全血后在1~2 h内进行分离,离心条件为2 500 g×10 min,或室温搁置待血清形成直接收集。所有样本装EP管,-80℃长期保存。
1.3.2血清外泌体的分离:将血清于冰上溶解,取200 μl,加入10 ml左右PBS稀释后经0.2 μm过滤器过滤,按照下列程序进行超高速离心:2 000 g,10 min,去除沉渣,140 000 g,4℃,3 h,保留沉淀,PBS洗涤沉淀并重悬,再次离心140 000 g,4℃,3 h,得到的沉淀用200 μl PBS重悬。取10 μl外泌体溶液滴入300目铜碳网上,干燥后进行电镜下形态学观察。
1.3.2磁珠结合流式进行外泌体表面抗原的鉴定:取200 μl磁珠用500 μl MEST溶液洗2次后,用200 μl 5 mg/ml EDC和NHS溶液进行活化,37℃,30 min。加入约10 μl抗体,37℃,摇3 h。磁性分离移除上清,加1 ml PBST重悬,37℃,温育30 min后,用PBST洗3次。加入约100 μl外泌体溶液,37℃摇1 h,移除上清,PBS洗3次。各管加入1 ml 30 μmol/L的Dio染料,37℃,30 min,磁性分离移除上清,用无水乙醇洗3次,PBS重悬,待测。
1.3.3ELISA法检测血清中细胞因子的表达水平:按照ELISA试剂盒操作说明进行相关因子的检测。
1.4统计学分析两组间计量资料的比较采用两独立样本t检验,检验水准α为0.05,相关性分析以Pearson相关系数表示,统计软件为SPSS21.0与GraphPad Prism 6.0。
2 结果
2.1实验组与对照组血清中外泌体表面分子的流式分析见表1。CD9,CD63,CD81在实验组与对照组分离出的外泌体中均有表达,实验组高于对照组,差异均有统计学意义(P<0.05)。与CD9,CD63,CD81等非特异性分子相比,CD69在实验组外泌体中明显增高,约为对照组的5倍,差异有统计学意义(P<0.000 1)。
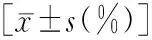
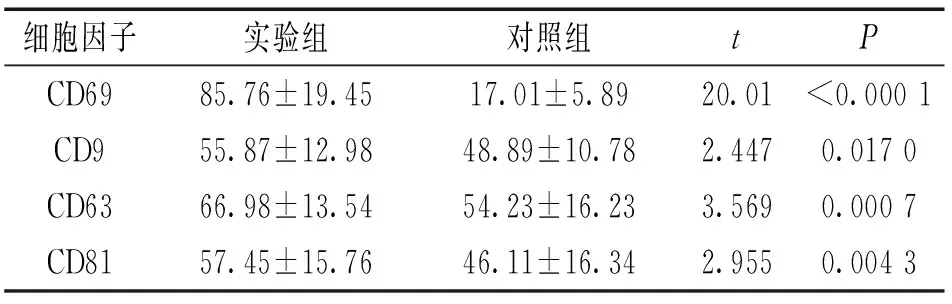
细胞因子实验组对照组tPCD69CD9CD63CD8185.76±19.4555.87±12.9866.98±13.5457.45±15.7617.01±5.8948.89±10.7854.23±16.2346.11±16.3420.012.4473.5692.955<0.00010.01700.00070.0043
2.2实验组与对照组血清中细胞因子的表达水平见表2。与对照组相比,实验组血清中IL-4,IFN-γ,TGF-β增高,差异均具有统计学意义(P<0.05)。IL-10在两组之间的表达无统计学差异。

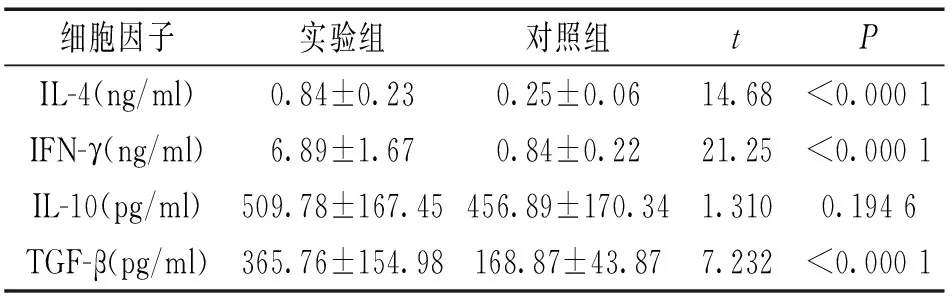
细胞因子实验组对照组tPIL-4(ng/ml)IFN-γ(ng/ml)IL-10(pg/ml)TGF-β(pg/ml)0.84±0.236.89±1.67509.78±167.45365.76±154.980.25±0.060.84±0.22456.89±170.34168.87±43.8714.6821.251.3107.232<0.0001<0.00010.1946<0.0001
2.3实验组外泌体CD69的表达情况与血清细胞因子的相关性分析见表3。实验组CD69+外泌体与IL-4,IFN-γ,TGF-β呈正比(P<0.05),CD69-外泌体与IL-4,IFN-γ,IL-10,TGF-β呈反比(P<0.05),差异具有统计学意义。
表3实验组外泌体CD69的表达情况与血清细胞因子的相关性分析

细胞因子CD69+exosome%rP D69-exosome%rPIL-4IFN-γIL-10TGF-β0.4650.6780.1020.548<0.005<0.001>0.05<0.001 -0.589-0.399-0.784-0.657<0.001<0.05<0.001<0.001
注:r0.05/2,33=0.334,r0.01/2,33=0.430,r0.005/2,33=0.464,r0.001/2,33=0.532。
3讨论AIP是一种新型胰腺疾病,其免疫病理形成机制目前尚不明晰,专家认为CD4+T细胞,可从Th0细胞分化为Th1/Th2及Treg细胞等[11],是参与AIP病理过程的重要细胞:Th2型免疫反应可能参与了AIP疾病的进展,Th1型反应与疾病早期发展相关,而Treg分泌的IL-10与TGF-β可调节IgG4和纤维化过程,同时影响了Th1,Th2细胞分化[3]。但值得注意的是对AIP疾病机理认识的不完整性以及其生物学标志物的非特异性非灵敏性,使得该病存在早诊困难等问题。
外泌体是一种稳定的细胞外囊泡,通过胞内囊泡的内吞途径形成,包含了细胞内蛋白、mRNA,非编码RNA及DNA等生物分子,在人体外周大量存在,相当于其来源细胞的“指纹”[4]。外泌体表面具有鉴定意义的标志物有CD9,CD63,CD81等,不同细胞来源其表面抗原的表达情况有所不同[4]。研究表明胰腺癌细胞来源的外泌体相比较于正常对照组,表面有丰富的GPC-1等标志物,能够将早期胰腺癌变与胰腺良性病变区别开来[12],但值得注意的是AIP来源的外泌体尚未被研究。
CD69也叫做早期激活抗原(EA-1)和激活诱导分子(AIM),一旦T细胞被激活就会表达于其表面。研究表明,CD69在T细胞的表达与Th1型细胞因子IFN-γ相关;在Treg细胞中,仅有表达CD69的Treg能够分泌高水平的TGF-β[7]。在自身免疫性疾病如自身免疫性糖尿病中CD69和疾病严重程度相关[8],自身免疫性肝炎中CD4+CD25-CD69+T细胞扩增的抑制可改善疾病[9],说明CD69在自身免疫性疾病中有重要作用,且可能与CD4+T细胞相关。近来有研究表明,在AIP的小鼠模型MRL/MpJ中,CD4+/CD69+Th细胞亦与疾病呈正相关,说明CD69在AIP中亦有重要作用,可能通过CD4+T细胞影响疾病进程[10]。基于CD69在自身免疫性疾病中的重要性,外泌体的疾病特异性,与AIP疾病监测的不完善性,本课题对AIP中CD69+的外泌体进行了检测以完善AIP的诊治手段,经研究发现CD69+外泌体在AIP病人中明显增高,并与IL-4,IFN-γ,TGF-β呈正比,说明CD69+外泌体可能与CD4+T细胞功能相关,进而参与了疾病的发生发展,但本文标本较少,尚需进一步扩大样本量,并进行更进一步免疫学探究。
参考文献:
[1]Madhani K,Farrell JJ.Autoimmune pancreatitis:An update on diagnosis and management[J].Gastroenterology Clinics of North America,2016,45(1):29-43.
[2]Zen Y.The pathology of IgG4-related disease in the bile duct and pancreas[J].Seminars in Liver Disease,2016,36(3):242-256.
[3]Okazaki K,Sumimoto K,Mitsuyama T,et al.Abnormal immunity in IgG4-related autoimmune pancreatitis[J].Japanese Journal of Clinical Immunology,2014,37(1):11-18.
[4]Nuzhat Z,Kinhal V,Sharma S,et al.Tumour-derived exosomes as a signature of pancreatic cancer-liquid biopsies as indicators of tumour progression[J].Oncotarget,2017,8(10):17279-17291.
[5]Bonjoch L,Casas V,Carrascal M,et al.Involvement of exosomes in lung inflammation associated with experimental acute pancreatitis[J].The Journal of Pathology,2016,240(2):235-245.
[6]Costa-Silva B,Aiello NM,Ocean AJ,et al.Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver[J].Nature Cell Biology,2015,17(6):816-826.
[7]Radulovic K,Rossini V,Manta C,et al.The early activation marker CD69 regulates the expression of chemokines and CD4 T cell accumulation in intestine [J].PLoS One,2013,8(6):e65413.
[8]Radenkovic M,Silver C,Arvastsson J,et al.Altered regulatory T cell phenotype in latent autoimmune diabetes of the adults (LADA)[J].Clinical and Experimental Immunology,2016,186(1):46-56.
[9]Yang Q,Wang J,Liu R,et al.Amelioration of concanavalin A-induced autoimmune hepatitis by magnesium isoglycyrrhizinate through inhibition of CD4(+)CD25(-)CD69(+) subset proliferation[J].Drug Design,Development and Therapy,2016,10:443-453.
[10]Bischof J,Muller S,Borufka L,et al.Quantitative trait locus analysis implicates CD4(+)/CD44high memory T cells in the pathogenesis of murine autoimmune pancreatitis[J].PLoS One,2015,10(9):e0136298.
[11]李腾达,龙曙萍,徐贵霞,等.CD26 /DPP4对隐球菌脑膜炎患者CD4+T细胞及相关细胞因子的影响与临床意义[J].现代检验医学杂志,2016,31(5):38-41.
Li TD,Long SP,Xu GX,et al.Affection of CD26/DPP4 on CD4+T cells and relative cytokines in patients with crytococcal meningitis and its clinical significance[J].Journal of Modern Laboratory Medicine,2016,31(5):38-41.
[12]Melo SA,Luecke LB,Kahlert C,et al.Glypican-1 identifies cancer exosomes and detects early pancreatic cancer[J].Nature,2015,523(7559):177-182.

