下瘀血汤抑制肝癌细胞生长的研究*
张 浩 ,邵建国 ,卞兆连 ,张 玉
(1南京中医药大学,江苏210023;2南京中医药大学附属南通市第三人民医院;3南通市肝病研究所)
原发性肝细胞肝癌是我国高发的恶性肿瘤之一,其发病率在世界范围内逐年上升,我国每年死于肝癌人数占全球50%[1]。目前肝癌患者的5年生存率不到10%,死亡率位于各大恶性肿瘤第3位[2]。导致原发性肝细胞肝癌的主要病因包括病毒性肝炎、酒精性肝病、代谢型等多种因素,其中病毒性肝炎是最常见的因素。近年来,中医药治疗肝癌已显示一定的优势,并积累了丰富的临床经验。下瘀血汤出自《金匮要略》,最初用于治疗妇女产后瘀血内停致少腹疼痛。研究表明,下瘀血汤可干预实验性肝硬化的形成,能抗肝纤维化、防治肝硬化[3]。全国名老中医周岱翰教授[4-5]在运用下瘀血汤治疗消化道肿瘤,尤其肝癌积累了丰富经验。本研究采用肝癌HepG2细胞体外实验的方法,旨在进一步研究下瘀血汤对肝细胞肝癌的治疗作用及其机制,为中医药治疗肝细胞肝癌提供依据,报告如下。
1 材料与方法
1.1材料10只SD级大鼠,雌雄不拘,体重200±20g,实验期间各组大鼠均饲养于南通大学实验动物中心,自由饮水,进食大鼠基础饲料。人肝癌细胞HepG2(南通市肝病研究所),DMEM高糖完全培养基(上海立菲生物有限公司),胎牛血清、胰蛋白酶Trypsin、0.25%EDTA(Invitrogen公司),磷酸盐缓冲液(赛默飞世尔生物化学制品),CCK-8试剂盒(日本同仁化学)。细胞培养箱Thermo、超净工作台BIOBSE、RT-1510酶标仪(赛默飞世尔科技有限公司),流式细胞仪(美国BD FACSCalibur)。下瘀血汤:生大黄6g、桃仁6.7g、蟅虫11.6g,由南通市中医院中药制剂室煎制,浓度为每mL含生药量0.4g。
1.2方法
1.2.1大鼠含药血清制备:SD级大鼠10只随机分为对照组和服药组,服药组给药剂量[6-9]为1mL/100g体重,每天灌胃2次,对照组给予相同剂量的灭菌注射用水,连续3天。最后一次灌胃2h后,以3%戊巴比妥麻醉大鼠,心脏取血,分离血清,-20℃保存备用。使用前置56℃水浴锅灭活30min。
1.2.2CCK-8检测细胞增殖:将HepG2细胞按3 000个/孔种植于96孔细胞培养板中,贴壁后饥饿24h,加入不同浓度(0、10%、20%)含药血清培养,按照CCK-8试剂盒说明书检测各组细胞0h、24h、48h、72h时的 OD450值。
1.2.3凋亡实验:将HepG2接种于96孔板,待细胞贴壁后,加入不同浓度(0、10%、20%)含药血清,培养48h,收集上清死细胞及贴壁细胞,根据试剂盒说明书依次向3组细胞中加入PE Annexin V和7-AAD试剂,流式细胞仪检测细胞凋亡。
1.2.4周期实验:HepG2细胞经各浓度含药血清孵育72h后,收集于4℃预冷的70%乙醇,置入-20℃冰箱过夜处理。第2天加入染色剂(40×PI母液、100×RNase母液、1×PBS),上流式仪检测。
1.2.5qRT-PCR检测NuSAP1表达:使用Trizol按照说明书步骤提取经过不同浓度含药血清处理72h的HepG2细胞的RNA,随后用Y Applied Biosystems GeneAmp 9700 PCR 系统(37℃,15 min;85℃,5 s;4℃,5 min)行逆转录,最后通过SYBR Green Premix Ex TaqTMⅡ试剂盒行荧光定量PCR(CFX Connect Real-time System)检测NuSAP1基因mRNA的表达量。通过Power=2-△△CT值计算相对表达量,随后采用Power值行统计学分析。引物序列如下:β-actin:Forward 5′-GGACTTCGAGCAAGAGATGG-3′;Reverse 5′-AGGAAGGAAGGCTGGAAGA-3′;NuSAP1:Forward 5′-TCATTTCCTTTTCTTGCCTCA-3,Reverse5′-CCCTCAAGTACAGTGACCTGC-3′。
1.2.6Western-blot检测 NuSAP 1表达:收集HepG2细胞,加入含cocktail蛋白酶抑制剂的RIPA裂解液充分裂解后,离心取得蛋白。BCA法测定蛋白含量,以缓冲液将蛋白稀释至浓度5~10 μg/μL。依据说明书配置分离胶、积层胶,凝固后上样,80V恒定电压下电泳30min,140V恒定电压下电泳1h;制备夹层“三明治”,电压100V,转膜90min。丽春红染液显示蛋白条带,将目的蛋白剪下,晾干备用。常温下封闭液封闭膜2h后,加Nusap1抗体(Nusap1抗体6μL按1∶2 000双蒸水配制12mL),置于4℃冰箱过夜。第2天再加入HRP标记的2抗(兔2抗3μL 加双蒸水 12mL,1∶4 000),在暗室内化学发光、显影、定影,胶片晾干。
1.3统计学处理应用GraphPad Prism5统计学软件进行数据处理分析,计量资料两组间比较采用t检验,多组间比较采用ANOVA统计方法,P<0.05为差异有统计学意义。
2 结 果
2.1含药血清抑制HepG2细胞增殖通过CCK-8实验检测含药血清对HepG2细胞增殖的影响,结果显示与对照组相比,不同浓度的含药血清能够明显抑制HepG2细胞的增殖,这一抑制作用在加入含药血清48h开始出现,72h更为明显。我们发现在48h时,10%及20%含药血清孵育的HepG2细胞与对照组比较,其OD值明显减小,差异有统计学意义(P<0.05),而在72h时这一抑制作用更为明显(P<0.01);同时含药血清抑制HepG2细胞增殖具有浓度依赖性,表现为20%较10%含药血清对HepG2细胞的抑制作用更明显(P<0.01)。见图1。
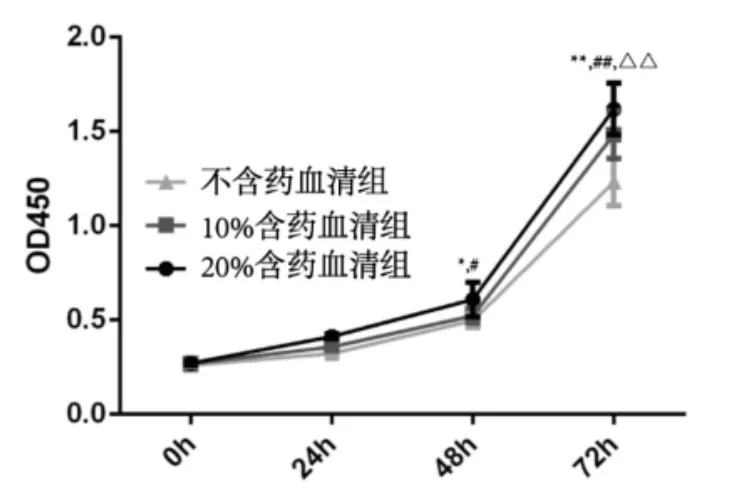
图1 下瘀血汤含药血清抑制Hep-G2细胞增殖
2.2含药血清对HepG2细胞周期的影响通过流式细胞技术检测细胞周期,结果显示与对照组比较,不同浓度的含药血清对HepG2细胞周期起到阻滞作用,主要表现为将细胞阻滞于S及G2期。分别统计各组细胞的S期细胞所占比例,结果显示10%含药血清(P<0.05)及 20%含药血清(P<0.01)组 S期细胞较对照组明显增加,差异有统计学意义;紧接着我们分析各组G2期细胞的比例,结果发现10%(P<0.05)和 20%(P<0.01)含药血清组 G2期细胞比例较对照组明显增加,差异均具有统计学意义。随后我们分别统计各组细胞中处于S+G2期细胞所占比例,结果同样显示10%与20%含药血清处于S+G2期细胞较对照组明显增加,差异有统计学意义(P<0.01),而更为重要的是我们发现20%含药血清组将HepG2细胞阻滞于S+G2期的能力较10%含药血清组更为明显(P<0.01),揭示含药血清对细胞周期的阻滞作用具有浓度依赖性。见图2,表1。

图2 下瘀血汤含药血清阻滞Hep-G2细胞周期流式图

表1 下瘀血汤含药血清阻滞Hep-G2细胞周期流式细胞仪检测结果 %
2.3含药血清对Hep-G2细胞凋亡的影响与对照组比较,10%和20%含药血清对HepG2细胞系早期和晚期凋亡都有促进作用,差异均具有统计学意义(P<0.05)。我们还发现,20%含药血清较10%含药血清对HepG2细胞总体凋亡(早期+晚期)的促进作用更为明显,差异具有统计学意义(P<0.01)。见图3、表2。

图3 下瘀血汤含药血清促进Hep-G2细胞凋亡流式图
2.4含药血清抑制NuSAP1基因表达我们通过qRT-PCR检测NuSAP1基因mRNA的表达情况,结果显示,与对照组比较,10%和20%含药血清组NuSAP1基因的mRNA表达较对照组比较明显降低,差异均具有统计学意义(P<0.05);同样进一步分析发现,这一现象具有浓度依赖性,表现为20%含药血清组NuSAP1基因mRNA表达水平较10%含药血清组下降更为明显,差异具有统计学意义(P<0.05)。随后我们通过Western-blot检测含药血清对细胞表达NuSAP1蛋白的影响,结果显示,10%和20%含药血清均明显抑制NuSAP1蛋白的表达(P<0.05),且随着含药血清浓度的增加,抑制作用更为明显(P<0.05)。见图 4,图 5。

图4 PCR检测下瘀血汤含药血清抑制NuSAP 1表达

图5 Western-blot检测下瘀血汤含药血清抑制NuSAP1蛋白水平表达
3 讨 论
核仁纺锤体相关蛋白1(NuSAP1)是一种微管结合蛋白,在纺锤体中发挥重要作用,是调控细胞周期的重要分子。该蛋白水平在细胞增殖过程中逐步上升,在G2/M期到达高峰,随后出现下降,其过表达会致使细胞停滞在G1期,表达抑制则会导致纺锤体形成障碍,导致M期阻滞[10],从而影响细胞增殖[11]。多项研究表明,NuSAP1基因在正常组织中几乎不表达,而在多种肿瘤细胞中过表达,明显高于非癌细胞[12-13]。抑制NuSAP1表达可以抑制肝癌的生长[14]。NuSAP1高表达与肝癌细胞的病理分化密切相关,并与肝癌的早期转移有关[15]。
下瘀血汤组方简单,大黄苦寒,性沉降,入血分,具有良好的活血逐瘀通经的功效,既清瘀热,又下淤血;桃仁味苦,善入心肝血分,善泄血滞,破血祛瘀力强;土鳖虫归肝经,咸寒入血,性善走窜,能破血逐瘀消积。现代研究证实大黄的有效成分大黄素对多种肿瘤细胞,如肝癌、宫颈癌、肠癌细胞具有杀伤和抑制作用,抗肿瘤作用明显[16-18]。现代研究表明桃仁具有抗凝血、抗血栓、增强免疫力、抗肿瘤等作用[19]。药理研究证实土鳖虫具有抗移码突变能力[20],并能抑制人肝癌、胃癌细胞的呼吸[21]。
本研究结果发现,在含药血清孵育48h后,显示对肝癌细胞增殖的抑制作用,随着孵育时间延长和浓度增加,抑制肝癌细胞增殖的作用更明显,20%含药血清孵育72小时较10%含药血清具有更强抗肿瘤作用,其抑制作用与浓度、时间成一定的正比关系。含药血清对细胞早期凋亡和晚期凋亡均有促进作用,含药血清浓度越高促进凋亡的作用越明显。细胞周期实验显示,高浓度含药血清对肝癌细胞周期的抑制作用更明显。提示应坚持临床长期用药,适当浓煎,适度增加服药次数,以维持血液有效药物浓度,可更好发挥下瘀血汤的抗肿瘤作用。PCR、Western-blot实验结果显示,下瘀血汤具有良好抑制NuSAP1表达的作用,其抑制作用与含药血清浓度有关,20%含药血清的抑制作用更加明显。
综上所述,下瘀血汤对肝癌细胞具有良好的抗增殖、促进凋亡、抑制细胞周期的作用,此作用可能与其抑制NuSAP1表达相关。在今后的实验中,可进一步研究下瘀血汤抑制NuSAP1的信号通路以及与其他基因的关系。
[参考文献]
[1]Bosch FX,Ribes J,Cléries R,et al.Epidemiology of hepatocellular carcinoma[J].Clin Liver Dis,2005,9(2):191-211.
[2]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[3]钦丹萍,蒋挺英,任永葆,等.下瘀血汤对实验性肝硬化及其脂质过氧化反应干预研究[J].中国中医药信息杂志,2003,10(3):25-27.
[4]周蓓,梁艳菊.周岱翰运用下瘀血汤辨治消化道肿瘤[J].辽宁中医杂志,2011,38(12):2338-2339.
[5]倪育淳,赵红艳.周岱翰教授运用下瘀血汤加味治疗肝癌的临床经验介绍[J].新中医,2009,41(5):8-10.
[6]柴可夫,李慧,楼基伟.下瘀血汤对慢性肾功能衰竭大鼠自由基影响的研究[J].中国中医药科技,2002,9(3):142-144.
[7]柴可夫,覃志成,李慧,等.下瘀血汤对糖尿病大鼠肾脏保护作用的实验研究[J].中国中医药科技,2004,11(6):344-345.
[8]陈洪宇,覃志成,王永钧.加减下瘀血汤对脂质诱导小鼠肾小球足细胞增殖影响的实验研究[J].中国中医药科技,2006,13(6):377-379.
[9]陈洪宇,童孟立,王永钧,等.加减下瘀血汤对人肾小球系膜细胞清道夫受体表达的影响[J].中国中西医结合肾病杂志,2003,4(2):67-70.
[10]Ribbeck K,Groen AC,Santarella R,et al.NuSAP,a mitotic RanGTP target that stabilizes and cross-links microtubules[J].Mol Biol Cell,2006,17(6):2646-2660.
[11]Beaudouin J,Gerlich D,Daigle N,et al.Nuclear envelope breakdown proceeds by microtubule-induced tearing of the lamina[J].Cell,2002,108(1):83-96.
[12]Satow R,Shitashige M,Kanai Y,et al.Combined functional genome survey of therapeutic targets for hepatocellular carcinoma[J].Clin Cancer Res,2010,16(9):2518-2528.
[13]谢萍,李璐,张令强,等.微管结合蛋白NuSAP的组织表达谱分析[J].军事医学科学院院刊,2010,34(6):509-512.
[14]Melstrom LG,Bentrem DJ,Salabat MR,et al.Overexpression of 5-lipoxygenase in colon polyps and cancer and the effect of 5-LOX inhibitors in vitro and in a murine model[J].Clin Cancer Res,2008,14(20):6525-6530.
[15]张猛,杨定华,刘萧,等.Nusap1蛋白在肝癌中的表达及其临床意义[J].中南大学学报(医学版),2013,38(9):876-881.
[16]Thacker PC,Karunagaran D.Curcumin and emodin downregulate TGF-β signaling pathway in human cervical cancer cells[J].PLoS ONE,2015,10(3):e0120045.
[17]Pooja T,Karunagaran D.Emodin suppresses Wnt signaling in human colorectal cancer cells SW480 and SW620[J].Eur J Pharmacol,2014,742:55-64.
[18]Hsu CM,Hsu YA,Tsai Y,et al.Emodin inhibits the growth of hepatoma cells:finding the common anti-cancer pathway using Huh7,Hep3B,and HepG2 cells[J].Biochem Biophys Res Commun,2010,392(4):473-478.
[19]王仁芳,范令刚,高文远,等.桃仁化学成分与药理学活性研究进展[J].现代药物与临床,2010,25(6):426-429.
[20]陈永培,郑鸣金,黄锦.临床常用抗肿瘤中草药的抗突变初步研究[J].中国中药杂志,1992,17(7):431-432.
[21]唐先平,高凤玲,王振卿.肿瘤临床常用中药指南[M].北京:科学技术文献出版社,2005.

