子宫内膜息肉患者IVF周期妊娠结局的临床分析
张莉莉,马晓玲,石馨,赵丽辉,贾学玲,张学红
(兰州大学第一医院生殖医学专科医院,甘肃省生殖医学与胚胎重点实验室,兰州 730000)
胚胎的种植以及随后的胎盘生成和持续健康的妊娠源自于胚胎与子宫内膜的相互作用。良好的子宫内膜是保证体外受精-胚胎移植(IVF-ET)良好结局的关键因素。然而,宫腔的异常(包括息肉、粘膜下肌瘤、粘连等)可能干扰子宫内膜对胚胎的接受性,而子宫内膜息肉(EP)最为常见。EP是子宫内膜组织的良性局部增生,由腺体、基质和由上皮覆盖的血管组成,是常见的子宫内膜病变之一。其发病机制可能与炎症刺激或内分泌因素有关。由于检查方法和人群的不同,EP的发病率并不明确,有文献报道为2.8%~34.9%[1]。我院在IVF术前经阴道超声筛查并通过宫腔镜确诊治疗EP。然而宫腔镜检查并摘除息肉的患者是否可获得与正常子宫内膜一样的临床结局,哪种促排卵方案更有利于EP患者的临床结局,本文将就这两个问题进行临床分析和探讨。
资料与方法
一、研究对象
回顾性分析2014年1月至2016年12月在本院生殖专科医院行IVF-ET助孕、术前行宫腔镜检查的536个周期,根据宫腔镜检查情况分为EP组(363个周期)和正常子宫内膜组(正常内膜组,173个周期)。EP组纳入标准:宫腔镜显示子宫内膜多发息肉并行息肉摘除术及全宫腔搔刮术;术后病理证实为EP。排除标准:阴道超声显示晚卵泡期子宫内膜厚度≤7 mm;合并其他宫腔病变,如宫腔粘连、粘膜下子宫肌瘤;合并子宫内膜复杂性增生、不典型增生、子宫内膜癌;合并子宫纵隔、单角子宫、双角子宫、双子宫等子宫畸形。正常内膜组纳入标准:宫腔镜示宫腔无异常,行内膜刺激术;术后病理无异常。
EP组又根据促排卵方案的不同分为两个亚组:长方案组:使用促性腺激素释放激素激动剂(GnRH-a)标准长方案促排卵,共235个周期;超长方案组:使用GnRH-a超长方案促排卵,共128个周期。
二、宫腔镜检查及治疗方法
IVF术前行阴道超声监测子宫内膜,发现卵泡期子宫内膜形态B-C型、回声不均匀或有异常回声的患者均于月经干净后3~7 d内行宫腔镜(Olympus,日本)手术,选用直管式硬宫腔镜。患者取膀胱截石位,常规消毒铺巾,静脉全身麻醉,5%葡萄糖注射液膨宫,充分扩张宫颈后置入宫腔镜,观察宫腔形态、宫颈内口、宫腔前后壁、宫底及宫角等处有无息肉以及息肉的大小、位置、形态与数量。于宫腔镜直视下用微型钳钳夹息肉,取样本送病理检验;并搔刮全宫腔,内膜组织送病检。若宫腔形态正常、未发现息肉,则用小刮匙轻刺激全宫腔,并取少量内膜组织送病检。术后当月黄体中期降调节,进入IVF-ET周期。
三、促排卵方案及IVF-ET
1.长方案:促排卵周期的前一周期黄体中期开始应用GnRH-a(达菲林,3.75 mg/支,博福-益普生,法国)1.125 mg~2.25 mg单次皮下注射进行垂体降调节。降调第12~14天达到垂体完全降调状态,内分泌降调标准达到LH≤5 U/L、E2≤73.2 pmol/L时,根据患者年龄、既往治疗史、性激素水平情况以及超声监测基础窦卵泡数(AFC),于降调达标日开始给予促排卵药物促性腺激素(Gn),促排卵药物种类:果纳芬(Gonal-F,75 U/支,默克雪兰诺,德国),普丽康(Puregon,50 U/支、100 U/支,默沙东,美国),人绝经期促性腺激素(HMG,75 U/支,珠海丽珠制药)。监测卵泡直径与血清性激素水平,适时停用促排卵药物并于当晚肌肉注射人绒毛膜促性腺激素(HCG,2 000 U/支,珠海丽珠制药)5 000~10 000 U,36 h后取卵。取卵后根据患者情况进行IVF,胚胎培养3 d后,选择1~3枚胚胎在B超监测下移植入宫腔。取卵日即开始地屈孕酮(10 mg/片,雅培,荷兰)10 mg/次,3次/d,加阴道用微粉化黄体酮(100 mg/粒,Laboratories Besins International,法国)200 mg/次,3次/d行黄体支持,至临床妊娠12周或血HCG<3 U/L。胚胎移植后14 d检测血β-HCG>3 U/L但移植后4周B超未探及孕囊,监测血β-HCG逐渐下降至正常范围者为生化妊娠;移植后4周B超探及孕囊及胚芽胎心搏动为临床妊娠。妊娠12周内B超监测胚胎发育情况2次,满12周停止黄体支持。
2.超长方案:达菲林降调节2~3次,每次间隔21 d,每次达菲林剂量1.875 mg,最后一次达菲林注射后14~21 d开始给予促排卵药物,其余同长方案。
四、观察指标
MⅡ卵率=MⅡ卵母细胞数/获卵数×100%;优质胚胎率=D3评分2级以上胚胎数/总胚胎数×100%;临床妊娠率=临床妊娠的周期数/总周期数×100%;生化妊娠率=生化妊娠的周期数/总周期数×100%;胚胎种植率=孕囊数/移植的胚胎数×100%;早期流产率=妊娠12周前流产的周期数/总周期数×100%;异位妊娠率=异位妊娠的周期数/总周期数×100%;活产率=足月活产的周期数/总周期数×100%。
五、统计学方法
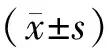
结 果
一、EP组和正常内膜组基础资料比较
EP组和正常内膜组相比,原发不育的比例显著升高(P<0.001);其它基础资料包括年龄、体重指数(BMI)、不育年限、基础性激素水平和不育因素构成比等组间比较均无显著性差异(P>0.05)(表1)。
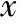
表1 EP组和正常内膜组基础资料比较 [(-±s),n(%)]
注:与正常内膜组比较,*P<0.001
二、EP组和正常内膜组实验室及临床数据比较
EP组移植日子宫内膜厚度显著高于正常内膜组(P<0.001);临床妊娠率、胚胎种植率、早期流产率、异位妊娠率、活产率等比较没有显著性差异(P>0.05);生化妊娠率EP组亦显著高于正常内膜组(P<0.05)(表2)。
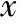
表2 EP组和正常内膜组实验室及临床数据比较 [(-±s),%]
注:与正常内膜组比较,*P<0.05,#P<0.001
三、EP患者中长方案组与超长方案组基础资料、实验室及临床数据比较
EP患者中长方案组与超长方案组基础资料比较均无统计学差异(P>0.05)。与长方案组比较,超长方案组Gn总量显著增多(P<0.001)、HCG日E2显著降低(P<0.05)、获卵数显著减少(P<0.001)、优质胚胎率显著降低(P<0.05)。临床妊娠率、生化妊娠率、胚胎种植率、早期流产率、异位妊娠率及活产率等组间比较均无统计学差异(P>0.05)(表3,4)。
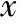
表3 EP患者长方案组与超长方案组基础资料比较 [(-±s),%]
注:与超长方案组比较,*P<0.05,#P<0.001
表4 EP患者长方案组与超长方案组实验室及临床数据比较 [(-±s),%]
注:与超长方案组比较,*P<0.05,#P<0.001
讨 论
一、EP对IVF结局的影响
不孕症患者中独立的宫腔因素约占2%~3%,在40%~50%的低生育力和不孕人群中可发现宫腔病变。IVF反复种植失败的患者宫腔镜检查异常率更高(约51.78%),其中ED及息肉样增生所占比例最大(约26.39%)[2]。除了息肉组织阻挡胚胎种植的机械因素外,研究发现子宫内膜种植窗期息肉组织间质中雌激素受体表达增加而孕激素受体(PR)表达明显降低,雌孕激素受体表达不均衡,息肉组织对孕酮反应不足,局部内膜分泌转化不良,使子宫内膜发育延迟、胚泡与内膜发育不同步[3]。
诊断EP的方法主要有超声、宫腔超声造影、宫腔镜和诊刮术。宫腔镜因其可以直观地观察EP的数量、大小和位置而优于其它3种诊断方法,并能在诊断后立即直视下彻底摘除息肉,起到很好的治疗作用[4]。本院采用超声联合宫腔镜的诊断方法,在IVF前常规在晚卵泡期阴道超声评估子宫内膜,超声显示子宫内膜回声不均匀或三线征不清晰者及子宫内膜厚度≤7 mm者行宫腔镜检查,但因为子宫内膜厚度≤7 mm者宫腔粘连的可能性大而与息肉关系不大故被排除。EP摘除术后复发率很高,有文献报道最高可达43%,并与术后随访时间密切相关[5]。因此,本院在宫腔镜下ED摘除术后当月即开始IVF周期,尽可能在准备妊娠之前减少息肉复发的机会。
本文结果显示,EP组原发不育的比例更高,差异有统计学意义。曹兴凤等[6]的研究也发现原发不育患者中ED和子宫内膜增生最常见。可能的原因为:妊娠的高孕激素状态是子宫内膜增生的保护因素,而继发不育患者经历人工流产可能使ED得以刮除。迄今为止的大多数研究表明宫腔镜息肉切除术对随后的生育率有利。最近的荟萃分析显示,宫腔镜息肉切除术在计划接受宫内授精的妇女中预期怀孕率增加了4倍,然而针对IVF之前的宫腔镜息肉切除术却没有随机对照试验[7]。Yang等[8]的研究显示,56例经阴道超声联合宫腔镜确诊EP的患者在IVF术前行宫腔镜下EP摘除术,临床妊娠率高于112例年龄匹配的随机选择的同期行IVF的患者(63% vs. 41%,P=0.009),但是胚胎种植率没有差异(26% vs. 20%)。
本结果显示EP处理后可以达到正常子宫内膜相似的临床结局,虽然没有统计学差异,临床妊娠率、胚胎种植率和活产率均略高于正常子宫内膜组。值得一提的是EP宫腔镜处理后ET日子宫内膜厚度和生化妊娠率显著高于正常子宫内膜组。虽然有学者认为<2 cm的小息肉无需处理,但Hu等[9]发现有小息肉患者的生化妊娠率较无息肉者显著增高(21.4% vs. 9.1%)。由此推测本研究中EP患者可能由于雌激素受体表达仍高,在促排卵引起的高雌激素水平下内膜生长更快,移植日内膜更厚而容易使胚胎种植,但亦可能因内膜增生过快而复发小息肉,或PR表达仍没有达到正常水平而导致临床前胚胎丢失率高。
二、超长方案对改善EP患者结局的有效性
近年,许多文献报道超长方案的临床结局优于长方案,尤其是针对子宫内膜异位症患者和多囊卵巢综合征(PCOS)患者,但目前针对EP患者超长方案是否更有优势的研究很少。对于调节生殖轴功能,超长方案通过两次或以上充分的降调节,导致血清低雌激素,从整体水平抑制子宫内膜细胞与血管的生长。在子宫内膜局部调节方面,代表子宫内膜容受性的因子同源框基因(HOXA10)、溶血磷脂酸受体3(LPAR3)和环氧合酶2(COX2)的表达在着床窗口期升高,改善了内膜的形态及血流分布使子宫内膜和胚胎的发育更同步,从而改善了子宫内膜容受性[10]。子宫内膜间质细胞和上皮细胞上均存在GnRH受体[11],在子宫局部通过直接抑制细胞增生、促进凋亡影响内膜组织生长。GnRH通过增加促凋亡蛋白bax、FasL和减少抑调亡蛋白Bcl-2表达,表现出抗增殖作用[12]。通过影响内膜细胞炎症因子白细胞介素-1、血管内皮生长因子、COX2的分泌,抑制子宫内膜炎性反应,改善子宫内膜功能[13]。因此,从理论上来讲,超长方案因为多次应用GnRH而应该表现出治疗EP的优势,更有利于IVF结局。
本文结果显示,与长方案组相比,超长方案组Gn总量多、HCG日E2低、获卵数少、优质胚胎率低,可能由于多次降调节使卵巢反应性降低。在获卵数和优质胚胎率没有优势的情况下临床妊娠率可以与长方案相似,且表现出稍高的趋势,说明超长方案可能改善子宫内膜容受性,但对于早期流产率和活产率,超长方案并没有显示出最终的优势。分析出现这个结果的原因,我们认为:(1)本文的超长方案均为降调节两次,对于EP患者可能没有达到完全抑制内膜增生的作用,因为两组移植日子宫内膜厚度相当。需要在以后的研究中开展前瞻性研究,探讨两次、三次或更多次的降调节对于EP患者结局的影响差异,或者增加其它抑制内膜增生的方法。有文献报道,EP患者宫腔镜治疗后给予去氧孕烯炔雌醇疗效更佳,因为高剂量的孕激素使子宫内膜由增生期转为分泌期,有效防止EP复发[14]。(2)分析超长方案组HCG日E2水平降低,可能有两方面的影响:一是雌激素下降,可能因为长时间的垂体抑制使卵泡颗粒细胞发育不良或凋亡增加,故而获卵数减少,卵母细胞质量较差,导致胚胎质量较差[15];二是雌激素的下降可使子宫内膜种植窗开放时间延长进而改善子宫内膜容受性[16]。因此,虽然超长方案使子宫内膜容受性改善而使胚胎更易种植,但因为胚胎质量欠佳和内膜的病理状态未彻底改善而流产率增加,所以最终结局并未显示优势。
综上所述,EP患者经术前宫腔镜诊治可以得到较为满意的临床结局,但仍需要大样本前瞻性研究以寻求EP患者行IVF术最佳的治疗方案。
【参考文献】
[1]黄丽华,向梅. 子宫内膜息肉研究新进展[J].国际妇产科学杂志,2014,41:43-46.
[2]陈平平,高敏芝,赵晓明,等. 体外受精-胚胎移植中反复种植失败后宫腔镜检查的临床意义[J].上海交通大学学报(医学版),2012,32:992-996.
[3]李素春,冯苗,潘萍,等.子宫内膜息肉患者增殖期及种植窗期性激素及激素受体的改变及意义[J].生殖与避孕,2014,34:986-992.
[4]Paradisi R,Rossi S,Scifo MC,et al. Recurrence of endometrial polyps[J].Gynecol Obstet Invest,2014,78:26-32.
[5]Yang JH,Chen CD,Chen SU,et al. Factors influencing the recurrence potential of benign endometrial polyps after hysteroscopic polypectomy[J/OL].PloS One,2015,10:e0144857.
[6]曹兴凤,王蔼明,赵勇,等.宫腔镜在宫腔因素不孕不育症诊治中的应用[J].生殖医学杂志,2014,23:539-544.
[7]Kodaman PH. Hysteroscopic polypectomy for women undergoing IVF treatment:when is it necessary?[J].Curr Opin Obstet Gynecol,2016,28:184-190.
[8]Yang JH,Yang PK,Chen MJ,et al. Management of endometrial polyps incidentally diagnosed during IVF:a case-control study[J/OL].Reprod Biomed Online,2017,34:285-290.
[9]Hu L,Bu Z,Wang Y,et al. The application value of hysteroscopy in women with endometrial polyp or uterine malformations seeking for infertility treatment[J].Fertil Steril,2014,102:e301.
[10]龚斐,郭慧,彭炬,等. 改良超长方案改善多囊卵巢综合征(PCOS)不孕患者子宫内膜容受性的研究[J].生殖与避孕,2015,35:300-308.
[11]Huang HY,Raga F,Kruessel JS,et al. Gonadotropin-releasing hormone messenger ribonucleic acid and protein expression in Vero cells[J].J Assist Reprod Genet,2001,18:268-275.
[12]黄凤英,刘秋红,王焕萍,等. GnRH Ⅱ与GnRH Ⅰ对子宫内膜异位症患者间质细胞分泌VEGF作用的比较[J].中南大学学报(医学版),2010,35:409-418.
[14]黄惠兰,朱彩容. 宫腔镜下子宫内膜息肉电切术临床疗效分析[J].生殖医学杂志,2014,23:673-676.
[15]Lavorato HL,Oliveira JB,Petersen CG,et al. GnRH agonist versus GnRH antagonist in IVF/ICSI cycles with recombinant LH supplementation:DNA fragmentation and apoptosis in granulose cells[J].Eur J Obstet Gynecol Reprod Biol,2012,165:61-65.
[16]Ma WG,Song H,Das SK,et al. Estrogen is a critical determinant that specifies the duration of the window of uterine receptivity for implantation[J].Proc Natl Acad Sci U S A,2003,100:2963-2968.

