表面增强拉曼光谱法快速检测饮料中玫瑰红B
王乐,张爱霞,陈晞,郑新华,何桂华
(济南出入境检验检疫局,山东济南250014)
为降低成本、赋予食品诱人的外观、稳定色泽,某些生产商在食品生产过程中违法使用非食用工业色素,它们主要是以苯、甲苯、萘等芳烃类化工产品为原料,经过磺化、硝化、卤化、偶氮化一系列有机反应化合而成,大多具有一定的毒性[1]。为此,卫生部于2008年印发了“食品中可能违法添加的非食用物质名单(第一批)”通知,列出了6种严禁添加的非食用色素,其中,应用最普遍的红色非食用色素为玫瑰红B,2005年质检总局查出不法分子用罗丹明B替代苏丹红制出毒花椒和火锅底料。
玫瑰红B,又名四乙基罗丹明和碱性玫瑰精,是一种具有鲜桃红色的人工合成的碱性荧光染料;由间羟基二乙基苯胺与邻苯二甲酐缩合制得,通常应用的是它的氯化物[2]。因其具有高毒、高残留和致癌、致畸、致突变等特点[3],1993年起欧美、日本等国家和地区就已明令禁止玫瑰红B用于食品加工过程中[4]。
目前,食品中玫瑰红B的测定方法主要有高效液相色谱法[5-7]、高效液相色谱-质谱联用法[8]、薄层色谱扫描法[9]、分光光度法[10-11]、电化学发光法[12]等。但是,以上检测方法前处理操作较为复杂、耗时,或仪器成本昂贵,且所用溶剂、流动相具有较大的毒性和腐蚀性等缺点,难于普及推广。因此,探索快速、简便、高效的食品色素检测方法,建立有效的安全监控体系,具有非常紧迫的现实意义。
拉曼光谱分析技术是以拉曼散射效应为基础建立起来的,是一种分子结构表征技术。自从1970年被发现以来[13],表面增强拉曼光谱已经被广泛应用在DNA和细胞内分子的检测[14-17]、癌症的诊断以及痕量化学物质的检测[18]、农药残留[19]等方面。传统的电化学腐蚀方法可以简便、高效的制备稳定、均一的表面具有多孔结构的金属基底。本文利用电化学辅助原位制备了一种表面具有多孔银结构的表面增强拉曼(surface enhanced Raman scattering,SERS)活性固相微萃取(solid-phase microextraction,SPME)银丝基底,对人工着色剂玫瑰红B在银丝基底表面的银纳米结构的萃取、SERS行为进行了研究、对SERS测试条件进行了优化,可用于饮料中玫瑰红B的快速检测。
PrincetonⓇPARSTAT 4000电化学工作站,配有3个电极:美国普林斯顿公司;QE65Pro手持式拉曼光谱仪(激发波长 785 nm,扫描范围 300 cm-1~2 000 cm-1,光谱分辨率2 cm-1):美国Ocean Optics公司;液相色谱串联质谱仪、Aglient1200高效液相色谱仪(Thermo Syncronis C18色谱柱,3.0 μm,150 mm×2.1 mm;甲醇+5 mmol乙酸铵水溶液梯度洗脱:0~10 min为5+95(体积比),10 min~13 min为95+5(体积比),13 min~20 min为5+95(体积比);柱温30℃;进样量10μL;流速0.25 mL/min):美国安捷伦公司;API4000质谱仪(电喷雾电压4500 V;离子源温度500℃;载气流速15 L/min;雾化器压力 5 psi;母离子 443.1,子离子 399.1、355.0;去
1 材料与方法
1.1 仪器与试剂
簇电压 100 eV,碰撞能量 58、80 eV):美国 AB SCIEX。
高纯银丝(直径0.6 mm,99.99%):北京有色金属与稀土利用研究所;甲醇(色谱纯)、乙醇(色谱纯)、丙酮(色谱纯)、正己烷(色谱纯):德国Merck公司;盐酸(分析纯)、硝酸(分析纯):国药集团化学试剂有限公司;玫瑰红B(标准品,95.0%)、酸性紫6B(标准品,91.0%)、喹啉黄(标准品,97.2%):德国 Dr.Ehrenstorfer;萘酚黄(标准品,99.0%)、偶氮玉红(标准品,98.0%):德国Sigma-Aldrich。标准溶液:用水配制1 000mg/L的玫瑰红B、酸性紫6B、萘酚黄、偶氮玉红、喹啉黄标准储备溶液,使用时再用水逐级稀释。
1.2 银丝SERS基底的制备
多孔银丝SERS基底,参照文献采用循环伏安法合成[20]。将直径为0.6 mm的银丝依次浸入丙酮、乙醇、超纯水、0.1 mol/L硝酸中进行表面处理,干燥。电化学实验采用自制的三电极电化学工作池,银丝为工作电极,饱和甘汞电极为参比电极,钛桶电极为辅助电极,0.1 mol/L盐酸为电解液、在-0.2 V~0.2 V电位范围内以25 mV/s的速度进行15次电化学反应,制备具有萃取功能的表面增强拉曼银丝基底,制备好的银丝清洗、干燥备用。通过调整扫描速度,可调控银丝表面多孔银纳米结构的尺寸和结构。
1.3 标准拉曼光谱数据库的建立
用Gaussian W03程序对玫瑰红B进行逐步优化并对最优结构进行拉曼频率的理论计算,得出理论特征谱图;利用拉曼光谱仪对玫瑰红B固体标准品进行扫描,得到固体标准品特征谱图。
1.4 样品测试
1)移取番茄混合果蔬汁饮料样品10 mL,分别加入玫瑰红B、萘酚黄、酸性紫6B、喹啉黄标准溶液,使得玫瑰红B浓度为70.0 μg/L、萘酚黄浓度为3.6mg/L、酸性紫6B浓度为7.6mg/L、喹啉黄浓度为4.8 g/L,摇匀,待测。
2)移取可乐样品10 mL于小烧杯中,分别加入玫瑰红B、偶氮玉红标准溶液,使得玫瑰红B浓度为360.0 μg/L、偶氮玉红浓度为5.0mg/L,超声除去二氧化碳,待测。
SERS样品测试:上述待测液经0.22 μm滤膜过滤,将表面增强拉曼基底浸入滤液中静置萃取8 min后,置于钛片上进行表面增强拉曼光谱测试。
HPLC-MS/MS样品测试:待测液加入10 mL超纯水,用柠檬酸水溶液调试pH值至4,移至已活化的PCX固相萃取柱中,依次用6 mL pH=6的水、6 mL甲醇淋洗固相柱。弃去淋洗液,于负压下抽干固相柱。然后用6 mL 10%氨水甲醇洗脱待测组分,接收洗脱液。洗脱液于50℃氮气吹干,用流动相定容至1.0 mL,涡流混合后过0.22 μm滤膜,进行LC-MS/MS分析。
2 结果与分析
2.1 理论拉曼光谱计算及振动模式的归属
对玫瑰红B分子用Gaussian 03程序进行逐步优化并对最优结构进行拉曼频率的理论计算,密度泛函理论(DFT)计算结果文件及分子构型通过Gaussview 5观察和分析,分子结构的拉曼光谱计算结果校正后与固体标准品实验拉曼光谱呈现高匹配度(图1,表1),与文献报道一致[21-22]。

图1 玫瑰红B的理论计算拉曼光谱(a)和固体标准品实验拉曼光谱(b)Fig.1 Theoretical calculated Raman spectrum of Rhodamine B(a)and experimental Raman spectrum of solid standard(b)

表1 玫瑰红B的DFT光谱和固体标准品实验拉曼光谱主要峰的振动模式归属Table 1 Main vibration modes attribution of DFT and experimental Raman spectrum of solid standard
2.2 定性定量方法的建立以及实际样品检测
2.2.1 定性检测
对玫瑰红B的定性检测可选择它的特征峰作为鉴定标准,616、732、1 007、1 073、1 196、1 277、1 357、1 503、1 647 cm-1处峰强度较高见图2,所以选定以上9个峰为定性峰。

图2 银丝基底萃取1.0×10-6mol/L玫瑰红B在萃取时间8min的SERS光谱图Fig.2 SERS spectrum of Rhodamine B on porous Ag fiber in 1.0×10-6mol/L for 8 minute
2.2.2 定量检测
2.2.2.1 萃取基底的选择
纳米结构的差异会显著影响吸附分子的SERS响应,因此,考察了1.0×10-6mol/L玫瑰红B在不同扫速条件下制备的多孔银纳米结构上的SERS响应见图3。

图3 不同扫速银丝基底萃取1.0×10-6mol/L玫瑰红B的SERS光谱图Fig.3 SERS spectrum of 1.0×10-6mol/L Rhodamine B on porous Ag fiber fabricated at different scanning rate
由图3可以看出,玫瑰红B在不同扫速制备的Ag基底上的增强效果不同,其趋势是随着扫描速度的增加,增强效果逐渐增强,当循环伏安法扫速为25 mV/s时,增强效果达到最大值,然后随着扫速的继续增加而逐渐降低。本文采用25 mV/s时得到的银丝基底进行方法学考察。
2.2.2.2 萃取时间的优化
本文采用静置直接萃取法,为了获得最佳萃取效果,对平衡时间进行了优化。为了选择最佳萃取时间,我们考察了玫瑰红B的SERS特征峰强度与萃取时间的动力学曲线。将多孔银萃取丝浸入1.0×10-6mol/L的玫瑰红B萃取工作液中,间隔不同时间连续采集萃取丝上SERS光谱,如图4所示,玫瑰红B萃取时间超过8 min后,特征峰强度不再增加趋于平衡,随着萃取时间增长有下降趋势,选择最佳萃取时间为8 min。
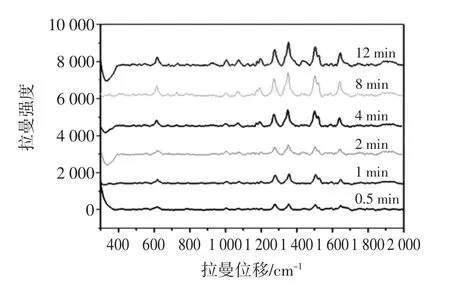
图4 银丝基底萃取1.0×10-6mol/L玫瑰红B的吸附时间平衡趋势图Fig.4 SERS spectrum of Rhodamine B on porous Ag fiber in 1.0×10-6mol/L for different time
2.2.2.3 检出限及线性
在最佳条件情况下,将多孔银萃取丝浸入一系列浓度的玫瑰红B化合物进行萃取8 min,达到平衡后得到系列溶液SERS光谱数据见图5。
由图5可见,当玫瑰红B溶液的浓度降至5×10-9mol/L 时 1 007、1 196、1 277、1 357、1 647 cm-1等峰仍能看出有SERS增强峰的存在,此浓度作为方法的检出限。取1 277 cm-1处的一系列SERS峰来做峰强度与玫瑰红B浓度的平衡吸附曲线和线性关系曲线(y=503.6+1.05×109x,R2=0.997)。


图5 (A)5.0×10-9mol/L-1.0×10-5mol/L玫瑰红B溶液的拉曼光谱,(B)饱和吸附曲线(5.0×10-9mol/L-1.0×10-5mol/L),(C)5.0×10-8mol/L-2.5×10-6mol/L玫瑰红B溶液的校正曲线Fig.5 (A)Raman spectra of Rhodamine B with concentrations from 5.0×10-9mol/L to 1×10-5mol/L.(B)Saturated adsorption curve for Rhodamine B(C)The calibration curve from 5.0×10-8 mol/L to 2.5×10-6mol/L
2.2.3 实际样品SERS检测与HPLC-MS/MS方法的比对
选取空白番茄混合果蔬汁饮料添加玫瑰红B、萘酚黄、酸性紫6B、喹啉黄制作代表性阳性样品,按照“1.4样品测试”孔滤膜过滤后进行原位萃取SERS方法进行检测,结果如图 6所示曲线,616、732、1 007、1 073、1 196、1 277、1 357、1 503、1 647 cm-1处的 SERS峰与玫瑰红B粉末标准物质的拉曼峰基本是一致的,可以确认本文的SERS方法检测出番茄混合果蔬汁饮料样品中玫瑰红B的存在,其含量为63.3 μg/L,添加的萘酚黄、酸性紫6B、喹啉黄未观测到SERS增强信号,对目标物玫瑰红B不产生干扰。为了验证上述方法的准确性,对番茄混合果蔬汁饮料和可乐(添加玫瑰红B、偶氮玉红)样品进行固相萃取前处理后采用液相色谱-串联四级杆质谱法对其中玫瑰红B进行检测[4,23],比对结果见表2。

图6 番茄混合果蔬汁饮料样品中玫瑰红B的SERS图谱Fig.6 SERS spectrum of Rhodamine B in mixing fruit-vegetable juice beverage sample

表2 饮料样品的检测结果(n=6)Table 2 Test results of drink samples(n=6)
由对比结果可以看出,SERS检测方法可以在保证准确性的前提下,节省检测时间、操作简便。
3 结论
采用电化学方法制备了具有SERS活性的多孔银丝基底,XRD、EDS分析证明了多孔纳米结构由Ag元素组成,SEM显示该基底具有纳米颗粒组成的堆集孔结构,且稳定性、均匀性较好。优化了银丝基底的萃取条件,采用循环伏安25 mV/s扫描条件下制备的银丝基底在目标溶液中吸附8分钟后进行拉曼测试;固体标准品拉曼扫描结合理论计算建立了玫瑰红B的标准拉曼谱图。在最佳条件下,建立了基于多孔银丝基底的食品中人工合成着色剂玫瑰红B的SERS快速分析方法,检测限达到5×10-9 mol/L。相比液相色谱-串联质谱检测方法,可以避免有机流动相的污染、节省检测成本,SERS增强基底可低成本自制且便于携带、适用于批量食品样品的现场快速检测。
参考文献:
[1]王惠琴,郑大威,林太凤,等.食用色素在食品中的应用及检测方法研究[J].食品工程,2009(4):3-5
[2]卢士英,邹明强.食品中常见的非食用色素的危害与检测[J].中国仪器仪表,2009(8):45-50
[3]程慧,李兵,占春瑞.腊肠中罗丹明B的高效液相色谱串联质谱检测方法[J].食品科学,2010,31(4):223-225
[4]张贞理,梅英杰,张全美,等.固相萃取-超高效液相色谱-电喷雾串联质谱法测定调味品中的罗丹明B[J].分析实验室,2012,31(4):15-19
[5]范文锐,吴青,劳扬,等.高效液相色谱法同时测定食品中7种非食用色素[J].分析化学,2012,40(2):292-297
[6]王传现,韩丽,方晓明,等.食品中罗丹明B的高效液相色谱荧光检测[J].分析仪器,2008(1):27-30
[7]李小燕,李梅,陈其锋,等.固相萃取-高效液相色谱检测葡萄酒中罗丹明B[J].2011,32(8):238-243
[8]杨建龙,潭纹.LC-MS/MS同时测定朱砂中掺假染料猩红808和玫瑰红B的含量[J].中国现代应用药学酿造,2015,32(8):979-983
[9]夏立娅,韩媛媛,匡林鹤.薄层色谱扫描法同时检测豆制品中碱性橙、皂黄、柠檬黄和日落黄以及辣椒粉中酸性橙II、丽春红2R和罗丹明B[J].分析试验室,2010,29(6):15-18
[10]Mustafa Soylak,Yunus Emre Unsal,Erkan Yilmaz,et al.Determination of rhodamine B in soft drink,waste water and lipstick samples after solid phase extraction[J].Food and Chemical Toxicology,2011(49):1796-1799
[11]Pourreza N,Rastegarzadeh S,Larki A,et al.Micelle-mediated cloud point extraction and spectrophotometric determination of rhodamine B using Triton X-100[J].Talanta,2008(77):733-736
[12]屈忠凯,邓光辉,王士伟,等.毛细管电泳-电化学发光分离检测辣椒粉中罗丹明B[J].食品科学,2015,36(4):217-220
[13]Chen L,Choo J.Recent advances in surface-enhanced Raman scattering detection technology for microfluidic chips[J].Electrophoresis,2008,29:1815-1828
[14]Park H,Lee S,Chen L,et al.SERS imaging of HER2-overexpressed MCF7 cells using antibody-conjugated gold nanorods[J].Phys Chem Chem Phys,2009,11:7444-7449
[15]Bell S E J,Sirimuthu N M S.Surface-enhanced Raman spectroscopy(SERS)for sub-micromolar detection of DNA/RNA mononucleotides[J].J Am Chem Soc,2006,128(49):15580-15581
[16]Barhoumi A,Halas N J.Label-Free Detection of DNA Hybridization Using Surface Enhanced Raman Spectroscopy[J].J Am Chem Soc,2010,132(37):12792-12793
[17]Sha M Y,Xu H,Penn S G,et al.SERS Nanoparticles:a New Optical Detection Modality for Cancer Diagnosis[J].Nanomedicine,2007,2(5):725-734
[18]欧阳雨,乐果涂膜表面增强拉曼光谱研究[J].分析测试学报,2012,32(8):996-1000
[19]Mosier-Boss P A,Lieberman S H.Surface-Enhanced Raman Spectroscopy(SERS)and Molecular Modeling of the Chromate Interaction with 4-(2-Mercaptoethyl)Pyridinium[J].Langmuir,2003,19(17):6826-6836
[20]Liu Z,Wang L,Bian W W,et al.Porous silver coating fiber for rapidly screening organotin compounds by solid phase microextraction coupled with surface enhanced Raman spectroscopy[J].RSC Adv,2017(7):3117-3124
[21]Ma Y,Hu W,Song X,et al.Density Functional Theory Study on Raman Spectra of Rhodamine Molecules in Different Forms[J].Chinese Journal of Chemical Physics,2014,27(3):291-296
[22]林爽,哈斯乌力吉,林翔,等.应用SERS滤纸基底检测饮料中违禁色素的研究[J].光谱学与光谱分析,2016,36(6):1749-1754
[23]郑新华,王乐,韩焕美,等.液相色谱串联质谱法检测食品中4种人工合成着色剂[J].食品安全质量检测学报,2016,7(4):1412-1418
—— 陕西榆林清涧老年大学校歌

