P2X7R/NLRP3信号通路在酒精性肝损伤中的作用
潮 蓉,武小娟,王羽辉,苏倩倩 ,吕雄文
(1. 安徽医科大学药学院,安徽 合肥 230032;2. 安徽省胸科医院药剂科,安徽 合肥 230022)
酒精性肝病(alcoholic liver disease, ALD)是由于长期、大量饮酒引起的肝脏的损害,其发展过程为酒精性脂肪肝、酒精性肝炎、酒精性肝硬化。目前,我国ALD的发病率逐渐增加,已成为仅次于病毒性肝炎的第二大病因[1]。因此,治疗酒精性肝损伤受到日益广泛的关注。
嘌呤受体 P2X7(purinergic 2X7 receptor, P2X7R)是一种离子型配体门控通道受体,由配体ATP激活后,可使离子通道开放,促进Ca2+、Na+内流以及K+外流,进而介导一系列细胞信号转导,如可激活核苷酸结合寡聚化结构域样受体3(NACHT-LRR-PYD-containing proteins 3 inflammasome, NLRP3),核转录因子-κB(nuclear transcription factor kappa B, NF-κB)、转化生长因子β(transforming growth factor β, TGF-β)等多条通路,诱导成熟白细胞介素1β(interleukin 1β, IL-1β)、白细胞介素18(interleukin 18, IL-18)等细胞因子的成熟和释放[2],在炎症反应和免疫调节中起着非常重要作用。研究表明,ATP-P2X7R是激活NLRP3的一条重要信号通路,NLRP3炎性体的活化主要通过分泌IL-1β、IL-18发挥下游效应[3]。已有报道,IL-1β促进慢性肝损伤[4],IL-18也被发现参与肝细胞的损伤[5],由此推测,P2X7R可能通过激活NLRP3引起肝细胞损伤。为了探讨P2X7受体及其介导的NLRP3炎性体信号通路在酒精诱导的肝损伤中的作用,本实验应用C57BL/6小鼠制备急性酒精肝模型,通过使用P2X7特异性阻断剂A438079干预模型动物,观察抑制P2X7R对肝损伤的影响,并探讨P2X7R-NLRP3信号通路在酒精性肝损伤中的作用。
1 材料与方法
1.1 材料
1.1.1实验动物8~10周龄C57BL/6小鼠,♂,体质量(23±3)g,由安徽医科大学实验动物中心提供。小鼠的饲养环境为SPF级动物房,室温(18~23) ℃,湿度为40%~60%,每笼2只。
1.1.2试剂P2X7抗体(美国Santa Cruz公司),A438079(美国TOCRIS公司),NLRP3抗体、ASC抗体、IL-1β、IL-18(北京博奥森公司),ECL化学发光试剂盒(美国Thermo公司)。
1.1.3仪器DL-5M高速冷冻离心机(德国saftarius公司),DK-8D型电热恒温水槽(上海一恒科技有限公司),LD4-2型低速离心机(北京医用离心机厂),XW-80A微型旋涡混合仪(上海泸西分析仪器厂有限公司)。
1.1 方法
1.2.1小鼠急性酒精性肝损伤模型建立建立30只♂ C57BL/6小鼠,随机分为3组(n=10):对照组、模型组、A438079组。采用美国国立卫生院酒精滥用与酒精中毒研究所(National Institute on Alcohol Abuse and Alcoholism, NIAAA)肝病研究室建立ALD模型的方法建立小鼠急性酒精性肝损伤模型[6],造模过程包括适应期5 d、造模期10 d、灌胃1次、取标本1 d,总计需16 d。d 1、2,对照组、模型组、A438079组喂对照液体饲料;d 3对照组喂对照液体饲料,模型组、A438079组喂2/3对照液体饲料+1/3酒精液体饲料;d 4对照组喂对照液体饲料,模型组、A438079组喂1/3对照液体饲料+2/3酒精液体饲料;d 5对照组喂对照液体饲料,模型组、A438079组 喂酒精液体饲料;d 6~15对照组喂对照液体饲料,模型组、A438079组喂酒精液体饲料;最后1周,分组进行以下处理[7],对照组和模型组:给予等剂量的生理盐水腹腔注射(每只约0.2 mL),每日1次;A438079组:根据小鼠体质量,腹腔注射200 μmol·kg-1[8]的A438079(按7 g·L-1配制A438079,每只约0.2 mL),每日1次。最后1天清晨给予单次31.5%酒精溶液灌胃,剂量为10 mL·kg-1。禁食9 h后,每组随机抽取6只小鼠眼眶取血并剖腹取肝,血清用于检测测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase ,AST)、胆固醇(cholesterol ,TCHO)、甘油三酯(triglyceride ,TG)的水平,肝组织用于组织病理的观察和免疫组化分析。
1.2.2生化指标的检测取血后,按照试剂盒说明书操作,采用全自动生化分析仪检测各组小鼠血清ALT、AST、TCHO和TG。
1.2.3组织病理学检查将肝组织固定于福尔马林中,再流水冲洗过夜,经过脱水包埋,制成石蜡组织块,再进行组织切片,脱蜡水化、染色,最后进行脱水、透明、封片、拍照。通过HE染色观察肝组织的损伤情况。
1.2.4免疫组织化学分析制备肝脏石蜡切片,二甲苯脱蜡,梯度乙醇脱水,PBS冲洗,3% H2O2室温孵育10 min,PBS冲洗,抗原修复10 min,蒸馏水洗,PBS洗,正常山羊血清封闭10 min,加入一抗,4℃过夜,37℃孵育20 min,PBS冲洗,加入二抗,37℃孵育30 min,PBS冲洗,加入SP复合物孵育20 min,PBS冲洗,DAB显色,苏木精复染,梯度乙醇脱水,中性树胶封片。以PBS代替一抗作为阴性对照。采集高倍视野(×200倍)图像,Imagine-Pro-Plus软件分析,分别对各组小鼠肝组织切片的免疫组化染色的阳性表达进行定量分析,测定组织中蛋白染色平均光密度值并分析,染色越深,反映蛋白的表达越高。
1.2.5Western blot法检测肝组织中的P2X7、NLRP3、ASC、IL-1β、IL-18蛋白的表达水平取各组小鼠的肝组织样品制成肝匀浆,加含有10 μL PMSF的1 mL RIPA裂解液,置冰浴中裂解30 min;4 ℃、12 000 r·min-1离心30 min,取上清,用BCA试剂盒定量,加入蛋白上样缓冲液,100℃加热10 min使蛋白变性。每孔上样10 μL总蛋白,进行SDS-PAGE凝胶电泳,先在80 V恒压下电泳,待染料进入分离胶后增至120 V,电泳至染料离开分离胶底部。电泳结束后,将蛋白转移到PVDF膜上。膜放入10 mL封闭液(5%脱脂奶粉溶于TBST)封闭3 h。膜用TBST清洗3次,每次10 min,加入预先配好的一抗中4℃孵育过夜。再分别加入与一抗相对应的二抗,室温下孵育1 h,配制显色液,进行化学发光拍照。

2 结果
2.1P2X7特异性阻断剂对模型小鼠肝功能的影响Tab 1结果显示,与空白对照组比较,模型组小鼠血清ALT、AST、TCHO、TG明显升高(P<0.01),表明急性酒精性肝损伤模型成立。与模型组相比,P2X7特异性阻断剂A438079组小鼠血清ALT、AST、TCHO、TG明显降低,差异有统计学意义(P<0.01)。说明A438079可减轻酒精所致的小鼠的肝损伤。

Tab 1 Comparison of serum ALT, AST, TCHO, TG content in each group(±s, n=5)
##P<0.01vscontrol;**P<0.01vsmodel
2.2P2X7特异性阻断剂对模型小鼠肝脏组织病理的影响为观察肝组织中的病理损伤,我们进行了病理切片和HE染色检测。Fig 1结果表明,正常组小鼠肝脏未见明显病变,模型组小鼠肝细胞可见明显脂肪变性,肝细胞肿胀明显,肝索排列紊乱。
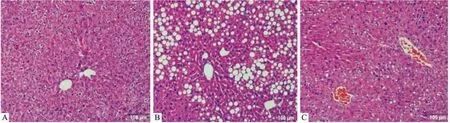
Fig 1 Pathological changes of liver tissues in mice (×200)
A: Control; B: Model; C: A438079
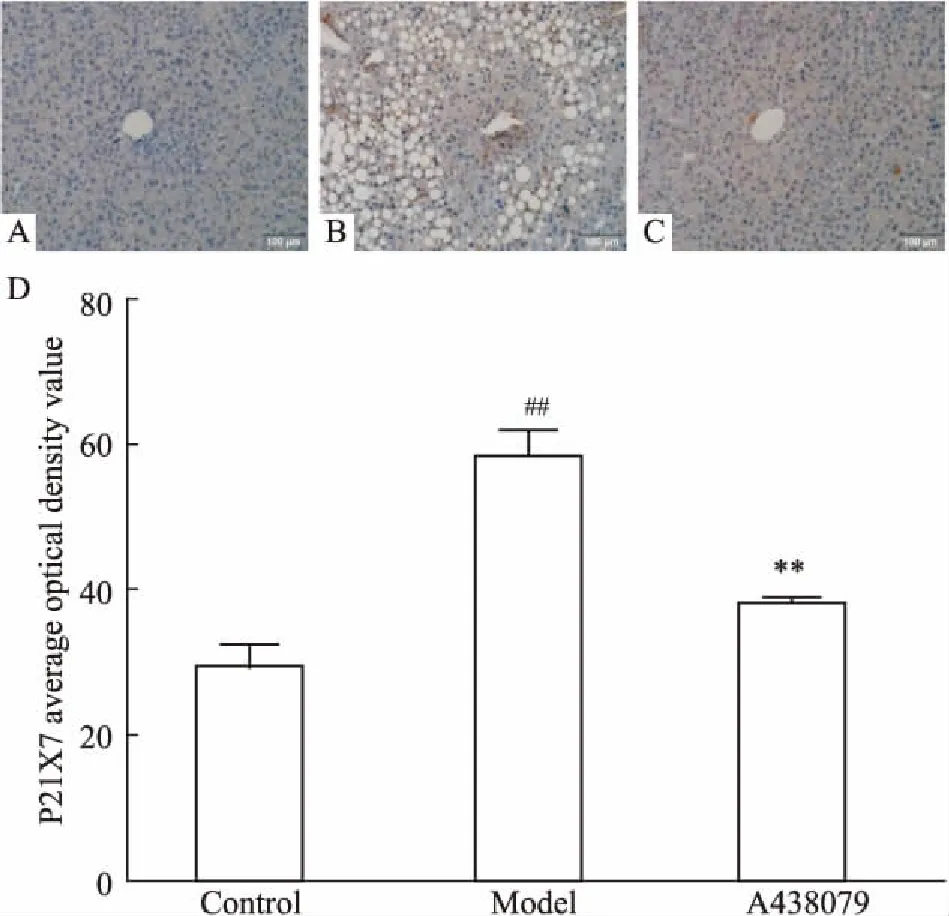
Fig 2 Expression of P2X7 in liver tissues of mice in each group (×200)
A: Control; B: Model; C: A438079; D: Immunohistochemical P2X7 protein optical density ratio analysis results.##P<0.01vscontrol group;**P<0.01vsmodel group
P2X7特异性阻断剂A438079组肝脏脂肪变性明显减少。说明A438079可以有效的抑制酒精诱导的肝脏组织病理损伤。
2.3P2X7特异性阻断剂对模型小鼠肝脏中P2X7R表达的影响用免疫组化染色测定P2X7特异性阻断剂对模型小鼠肝脏中P2X7R表达的影响,采集高倍视野图像,测定肝脏组织中P2X7R蛋白染色平均光密度值,进行半定量分析。Fig 2结果显示,P2X7R细胞染色呈黄色或棕黄色为阳性,定位于细胞质。与正常对照组比较,模型组小鼠肝脏组织P2X7R蛋白表达明显升高;与模型组相比,A438079组小鼠肝脏组织P2X7R蛋白表达明显降低。
2.4酒精性肝损伤模型以及P2X7特异性阻断剂对小鼠肝组织中P2X7、NLRP3、ASC表达的影响Fig 3结果显示,与对照组相比,模型组P2X7、NLRP3、ASC蛋白的表达明显升高(P<0.01);与模型组相比,A438079组P2X7、NLRP3、ASC蛋白的表达明显降低(P<0.01)。
2.5酒精性肝损伤模型以及P2X7特异性阻断剂对小鼠肝组织中IL-1β、IL-18表达的影响Fig 4结果显示,与对照组相比,模型组IL-1β、IL-18的表达明显升高(P<0.01);与模型组相比,A438079组IL-1β、IL-18的表达明显降低(P<0.01)。
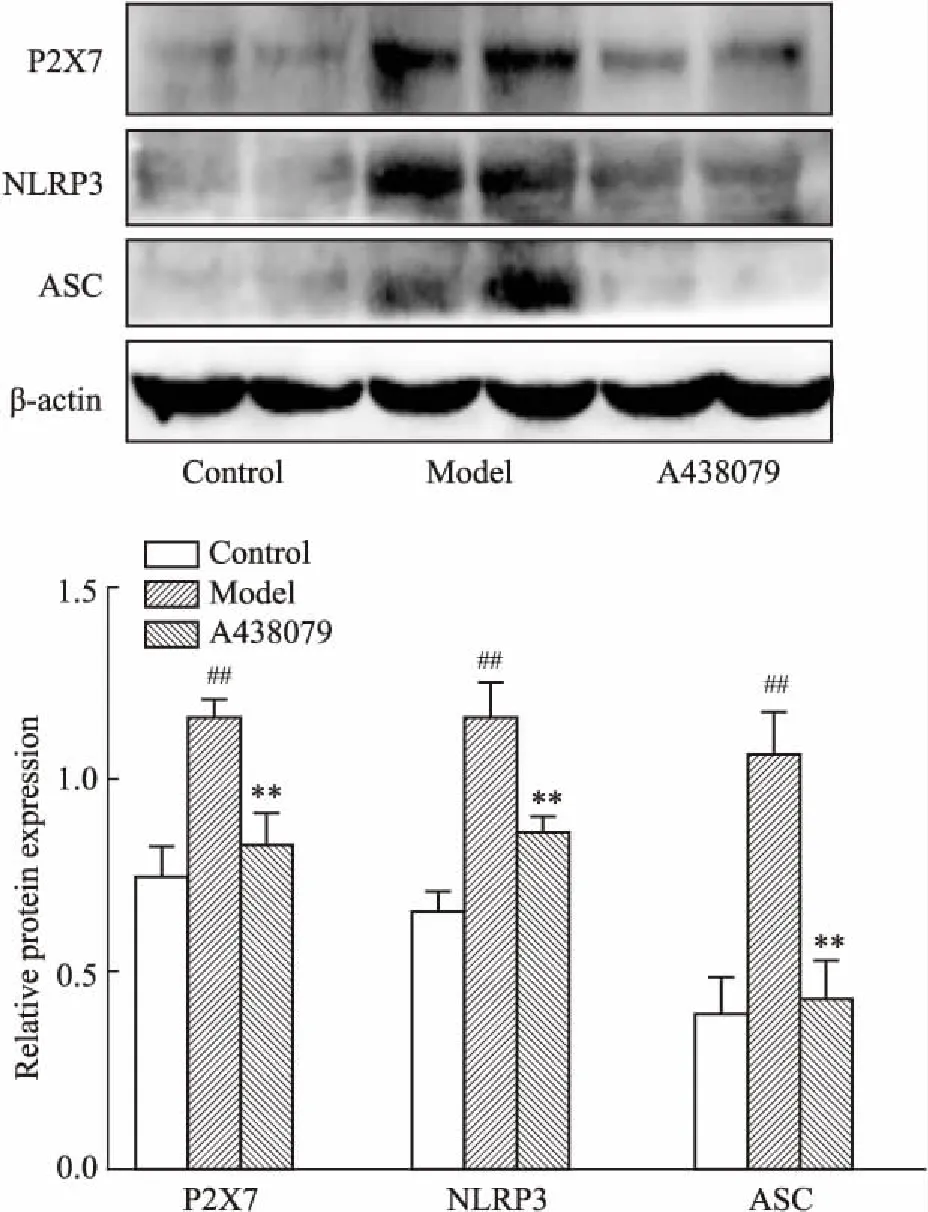
Fig 3 Expression of P2X7, NLRP3, ASC in liver tissues of mice
##P<0.01vscontrol group;**P<0.01vsmodel group
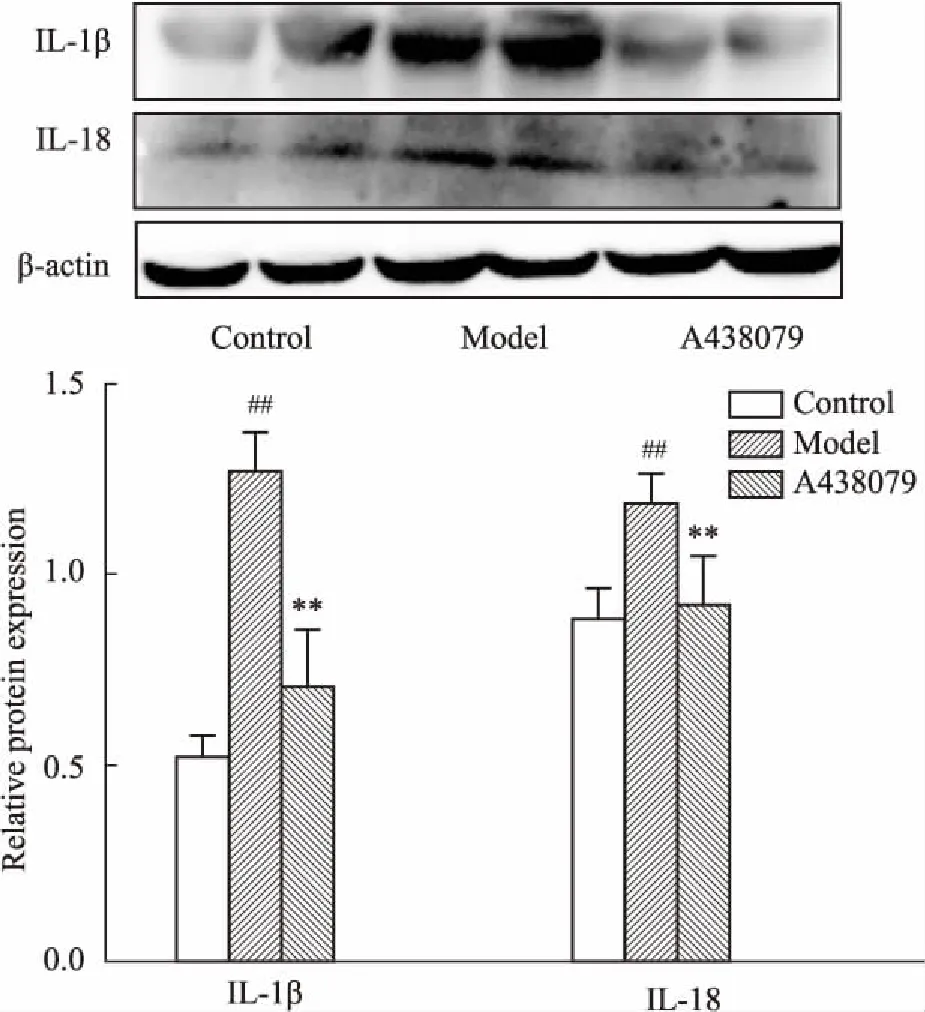
Fig 4 Expression of IL-1β, IL-18 in liver tissues of mice
##P<0.01vscontrol group;**P<0.01vsmodel group
3 讨论
ALD的疾病缺乏针对性的治疗方法,ALD研究更接近人类ALD的动物模型,研究其发病机制具有非常重要的意义。有文献总结了不同动物模型模拟ALD病变情况[9],总结了各种模型的优缺点,综合各种因素,本实验选择了Gao-binge模型,可模拟人ALD的发病过程。采用NIAAA法建立酒精性肝损伤小鼠模型,经模型组与对照组比较,模型组小鼠血清ALT、AST明显升高,提示造模成功。
肝脏是酒精代谢的主要脏器,长期、大量的饮酒会引起肝脏损伤,酒精导致肝损伤的机制复杂,目前认为主要有以下几种学说:内毒素、氧化应激和炎症反应;其中炎症反应在ALD的发生发展过程中起到了关键性的作用[10]。在酒精的刺激下,肝脏内被激活的的巨噬细胞可产生大量的包括IL-1β、IL-18等在内的炎症因子,导致肝损伤[11]。
有研究表明,P2X7受体直接与炎症有关,在很多疾病过程中影响到IL-1β、IL-18的释放[12]。P2X7受体是一种在体内分布广泛的ATP门控的阳离子通道蛋白,在肾、脑、肝、骨等组织中以及巨噬细胞、肥大细胞、淋巴细胞等细胞系中均有表达[13]。本研究结果显示,与对照组相比,模型组小鼠肝组织中P2X7的表达明显增加;而P2X7受体抑制剂A438079组的结果表明,P2X7受体表达下调可以抑制 NLRP3炎性体活化,减少炎症因子的产生,从而减轻肝损伤。
IL-1β是一个有效的致炎因子,它被激活的前提是半胱天冬酶-1(caspase-1蛋白酶)的活化,caspase-1可以切割pro-IL-1β使其具备生物活性,并被细胞释放出来;而有活性的caspase-1,正是由NLRP3炎症体激活以后产生的。由此可见,P2X7、NLRP3、IL-1β三者之间有着极其重要的联系[14]。 P2X7作为NLRP3的上游受体,经ATP激活后,可引起NLRP3炎性体活化。NLRP3炎性体是NLRs炎性体家族成员之一,主要由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)、caspase-1蛋白组成,在多种与炎性相关的肝病发生发展过程中都起到重要的调节作用。激活的NLRP3通过受体ASC募集caspase-1,进而引起促炎因子IL-1β、IL-18的合成和分泌,启动并进一步放大炎症反应[15]。
分析本实验所得结果,与对照组相比,模型组小鼠肝组织出现脂肪变性,模型组血清ALT、AST、TG、TCHO含量明显升高, P2X7、NLRP3、ASC 表达明显增强,同时发现伴随三者表达的增高,IL-1β、IL-18的表达也明显增强;与模型组相比,抑制剂A438079组小鼠肝组织脂肪变性减轻,血清中的ALT、AST、TG、TCHO含量都有不同程度的降低,P2X7、NLRP3、ASC表达明显减弱,IL-1β、IL-18的表达也明显减弱。由此我们推测,通过活化P2X7受体进而激活NLRP3炎性受体,可能是酒精性肝损伤中炎性因子表达水平上调的重要机制。
本课题研究结果表明,应用P2X7受体特异性抑制剂A438079可有效抑制酒精性肝损伤中的炎症反应,该抑制剂可以成为临床酒精肝损伤防治的新选择。研究具有高选择性、安全性及有效性的P2X7受体特异性抑制剂将为临床肝脏疾病防治提供新的思路和新的方向。
参考文献:
[1]邬 升,郑世华.酒精性肝病的研究进展[J].海南医学, 2013,24(9):1326-8.
[1]Wu S, Zheng S H. Advances in alcoholic liver disease[J].HainanMed, 2013,24(9):1326-8.
[2]Costa-Junior H M, Sarmento Vieira F, Coutinho-Silva R.C terminus of the P2X7 receptor: treasure hunting [J].PurinergicSignal, 2011,7(1):7-19.
[3]Taguchi T, Nazneen A, Abid M R, et al. Cisplatin-associated nephrotoxicity and pathological events[J].ContribNephrol, 2005,148:107-21.
[4]Strowig T, Henao-Mejia J, Elinav E, et al. Inflammasomes in health and disease[J].Nature, 2012,481(7381): 278-86.
[5]Ogura Y, Sutterwala F S, Flavell R A. The inflammasome: first line of the immune respone to cell stress[J].Cell, 2006,126(4): 659-62.
[6]高斌,常彬霞,徐明江.慢性酒精喂养加急性酒精灌胃的酒精性肝病小鼠模型(NIAAA模型或Gao-Binge模型)[J].传染病信息, 2013,26(5):307-11.
[6]Gao B,Chang B X, Xu M J. Mouse model of chronic and binge ethanol feeding(the NIAAA model)[J].InfectiousDisInf, 2013,26(5):307-11.
[7]Huang C, Yu W, Cui H, et al. P2X7 blockade attenuates mouse liver fibrosis [J].MolMedRep, 2014,9(1):57-62.
[8]Taylor S R,Turner C M, Elliott J I, et al.P2X7 deficiency attenuates renal injury in experimental glomerulonephritis[J].JAmSocNephrol, 2009,20(6):1275-81.
[9]周恒,李俊,王华. 酒精性肝病动物模型研究进展[J]. 中国药理学通报, 2016,32(4):468-72.
[9]Zhou H, Li J, Wang H. Advances in animal models of alcoholic liver disease [J].ChinPharmacolBull, 2016,32(4):468-72.
[10] Kawaratani H, Tsujimoto T, Douhara A , et al. The effect of inflammatory cytokines in alcoholic liver disease [J].MediatorsInflamm, 2013,2013:495156.
[11] Forsyth C B, Voigt R M, Burgess H J, et al. Gircadian rhythms, alcohol and gut interactions[J].Alcohol, 2015,49(4):389-98.
[12] Mehta N, Kaur M, Singh M, et al. Purinergic receptor P2X7: a novel target for anti-inflammatory therapy[J].BioorgMedChem, 2014,22(1):54-88.
[13] Ji X, Naito Y, Weng H, et al.P2X7 deficiency attenuates hypertension and renal injury in deoxycorticosterone acetate-salt hypertension[J].AmJPhysiol, 2012,303(8): F1207 -15.
[14] Brydges S D, Broderick L, McGeough M D, et al. Divergence of IL-1,IL-18, and cell death in NLRP3 inflammasomopathies [J].JClinInvest, 2013,123(11):4695-705.
[15] Lu C Y, Hartono J, Senitko M, et al. The inflammatory response to ischemic acute kidney injury:a result of the right stuff in the wrong place[J].CurrOpinNephrolHypertens, 2007,16(2):83-9.

