成人支原体肺炎的CT表现
马风荣,刘春红,袁慧书
(1.北京大学第三医院影像科,北京100191;2.首都医科大学附属北京中医医院研究所,北京100010)
支原体肺炎(mycoplasma pneumoniapneumonia,MPP)是由肺炎支原体引起的以间质性病变为主的急性肺部炎性病变。支原体介于病毒和细菌之间,其引起的肺部炎症常伴咽炎、支气管炎等表现。MPP与肺炎链球菌等常见细菌性肺炎的某些临床表现相似,易误诊,但治疗方法明显不同,磺胺类药物和β-内酰胺类抗生素等对MPP治疗无效,因此,临床确诊很重要。Leon等[1]在亚洲10个国家的研究结果显示,肺炎支原体已成为社区获得性肺炎第2大最常见致病菌。国内外研究[2]表明,肺炎支原体感染多见于青壮年,其影像学表现有一定特征性,可为临床诊断、治疗提供帮助。本研究回顾性分析2016年4月至2017年2月在北京大学第三医院确诊的50例支原体抗体阳性且HRCT阳性患者的影像学特点,现报道如下。
1 资料与方法
1.1一般资料50例中,男17例,女33例;年龄18~60岁,中位年龄31岁。临床症状:多数患者受凉后或无明显诱因出现发热、咳嗽、咳痰、畏寒、寒战、咽痛、胸痛等,部分患者伴黏痰、脓痰、血痰,重者可有气短。起病较缓慢,多数为咽炎、支气管炎的表现,本组 50例中,5例(10%)白细胞升高,28例(56%)中性粒细胞升高,35例(70%)C反应蛋白升高。支原体抗体血清学检测方法被动凝集法以血清稀释度1∶40及以上出现明显凝集为阳性。
1.2仪器与方法采用Siemens Somatom Emotion 16排螺旋CT扫描仪,扫描参数:130 kV,120 mA,层厚 1.0~1.5 mm,层距 10 mm,扫描时间 2 s,矩阵512×512。采用高分辨力(骨)重建法,保留原始扫描数据并对部分患者的图像行后处理。
2 结果
50例中,双侧肺多叶15例,单侧肺35例,右侧肺23例,左侧肺12例;发生于下叶30例。支气管壁增厚41例,占 82%(图1a);磨玻璃样密度灶40例(图1b),占80%;树芽征12例,占24%;腺泡结节21例,占 42%(图2);实变 31 例(图1b),占 62%;胸腔积液4例,占8%;淋巴结肿大1例,占2%。50例均给予莫西沙星静脉滴注治疗,15例治疗1周后复查,肺内病变明显吸收好转(图3),其中9例治疗20 d后复查,肺内病变完全吸收。多数患者治疗8~12 d退热。
3 讨论
3.1支原体的病理生理学肺炎支原体介于细菌与病毒之间,大小为200 nm,是能独立生活的最小的自由生物,无细胞壁,仅有由3层膜组成的细胞膜,可通过分泌物及空气传播,引发局部流行[3]。其可在无细胞的培养基上分裂繁殖、生长,对β-内酰胺酶抗生素不敏感。由于肺炎支原体没有细胞壁,其对万古霉素、磺胺类作用于细胞壁的药物有耐药性。目前用于治疗MPP的药物有喹诺酮类、四环素类、大环内酯类等。本研究采用莫西沙星静脉治疗,效果显著。莫西沙星是第4代氟喹诺酮类抗菌药,可通过改变分子结构来增强抗菌活性,且其耐药率低、半衰期长,具有较高的耐受性与安全性[4]。
3.2肺炎支原体的致病机制肺炎支原体在发病前2~3 d至病愈数周,都可在呼吸道分泌物中发现。其致病机制尚未完全明确,目前认为肺炎支原体可通过黏附及细胞毒性效应直接损伤呼吸道上皮,通过接触感染,黏附在上皮细胞表面,借此抵抗吞噬细胞的吞噬,破坏上皮细胞和抑制纤毛活动,其合成的过氧化氢等可导致上皮细胞的氧化应激损伤。其致病性可能与患者对其代谢产物或病原体的过敏反应有关。感染后机体会产生特异性抗体,一般引起体液免疫。国内报道[5]显示,在社区获得性肺炎中,MPP占22.3%~36%,高于肺炎链球菌肺炎。也有文献[6-7]报道,对成人而言,社区获得性肺炎中肺炎支原体是最常见的病原体,阳性率为20.7%。
3.3MPP的病理变化当支原体侵入呼吸道后,可直接黏附在上皮细胞上并自我复制,损害呼吸道的防御功能,最终引起呼吸道感染[8]。肺部病变可呈间质性肺炎或支气管肺炎(小叶性肺炎)改变,伴急性支气管炎,细支气管壁多增厚,黏膜水肿,管腔内有多核白细胞、中性粒细胞等浸润。当病变进展累及肺泡时,其内可分泌少量渗出液,肺泡壁和间隔有中性粒细胞、浆细胞等炎性细胞浸润,会出现局灶性肺不张、肺实变和肺气肿等影像改变。当渗出累及胸膜时,胸膜可有纤维蛋白渗出和少量渗液,影像上则表现为胸腔积液。
3.4成人支原体感染的肺部HRCT表现及预后复习文献发现小儿支原体感染的报道相对较多,因小儿肺功能发育不够完整,一旦感染,发病迅速且进展快,而成人机体各项功能较完善,病情进展相对缓慢且临床症状较轻,胸部CT表现特征一般集中在下叶及上叶舌段[9]。病变一般由支气管黏膜上皮开始,出现支气管壁水肿、增厚,炎性细胞进一步聚集、堆积,可进一步向周围的支气管血管周围发展,表现为支气管炎及周围间质炎。在HRCT上则表现为中央间质及支气管壁增厚、边缘模糊及磨玻璃样密度灶。炎性病变继续往远端发展可延续为支气管炎,会导致支气管管腔狭窄,腔内黏液栓形成,远端肺泡出现渗液,有时可出现多个结节融合。在HRCT上则分别表现为树芽征和腺泡结节。若病变继续朝周围间质蔓延,则表现为树雾征(受累的间质病变表现为磨玻璃样密度灶,其围绕、深入实质病灶与血管之间及其周围,似树周围的雾)及磨玻璃样密度灶。国内其他研究[10]表明,磨玻璃样密度灶占 82.6%,本组占 80%,与报道接近。磨玻璃样密度灶一般位于实变病灶周围,随病情进展,可表现为磨玻璃影过渡到实变或磨玻璃影中散在实变影[11],随着肺泡及周围间质渗出增多,可导致间质增厚,部分肺泡萎缩,严重者可发展为纤维素性渗出和透明膜形成[12],当气道内黏液栓形成或肺泡上皮剥落堵塞支气管时,可出现肺不张[10],部分可有肺实变改变。若肺野外带的细支气管、肺间质受侵犯,则使其充血、水肿及炎性细胞浸润,胸膜受渗出液刺激,会引起胸膜渗出改变,产生胸腔积液。儿童MPP常伴肺不张、胸腔积液及肺门淋巴结肿大等,本研究中,成人患者淋巴结肿大及胸腔积液所占的比例相对较少。胸片对上述影像学改变的显示有一定局限性,尤其是早期病变,而胸部CT可直接、准确地显示病变部位、范围及性质[13-14]。MPP演变的不同阶段均有相应的CT表现,且支原体感染的临床与影像不同步。Reittner等[15]对114例肺炎的HRCT研究表明,小叶中心结节和磨玻璃样密度灶同时存在,对诊断MPP有很大的提示作用。MPP如诊断治疗及时,发病至痊愈可数日至2~5周,免疫力正常患者恢复期一般需1~2周。影像学高密度阴影完全吸收消失,一般比临床症状延长2~3周。偶见病变游走及复发。
3.5鉴别诊断MPP应与以下疾病鉴别:①细菌性肺炎,一般急性起病,临床多数出现高热,影像学上肺叶或肺段分布的实变影,以肺泡渗出为主,含气支气管征明显。②小叶性肺炎,一般临床与影像表现同步,常规抗感染治疗有效,多位于下叶,范围比较小,主要以实质病变为主,间质受累较轻。③肺结核,上叶尖后段及下叶背段多见,多灶性、多态性常见,可有空洞、钙化。④病毒性肺炎,临床症状重且与影像表现同步,都是间质受累为主,但外围多见。
总之,我国成人支原体感染阳性患者多数肺内有病理改变,女性发病率明显高于男性,右肺病变明显多于左肺,且以双肺下叶多发。HRCT主要表现为支气管壁增厚、支气管周围炎、树芽征及腺泡结节,病变初期,病原体沿支气管周围间质蔓延,表现为磨玻璃样密度灶,随疾病进展,逐渐发展为大片实变影,或在磨玻璃影中混杂斑片状实变影,或两者同时存在,部分合并胸腔积液、肺不张等。临床工作中,如HRCT出现上述征象,结合实验室检查,可高度提示临床MPP感染的可能。随着MPP发病率逐年升高,难治性MPP、重症MPP及耐药性MPP的数量也逐年增加[16-17]。其用药原则与细菌性、病毒性感染明显不同,因此临床快速诊断、治疗准确非常关键。
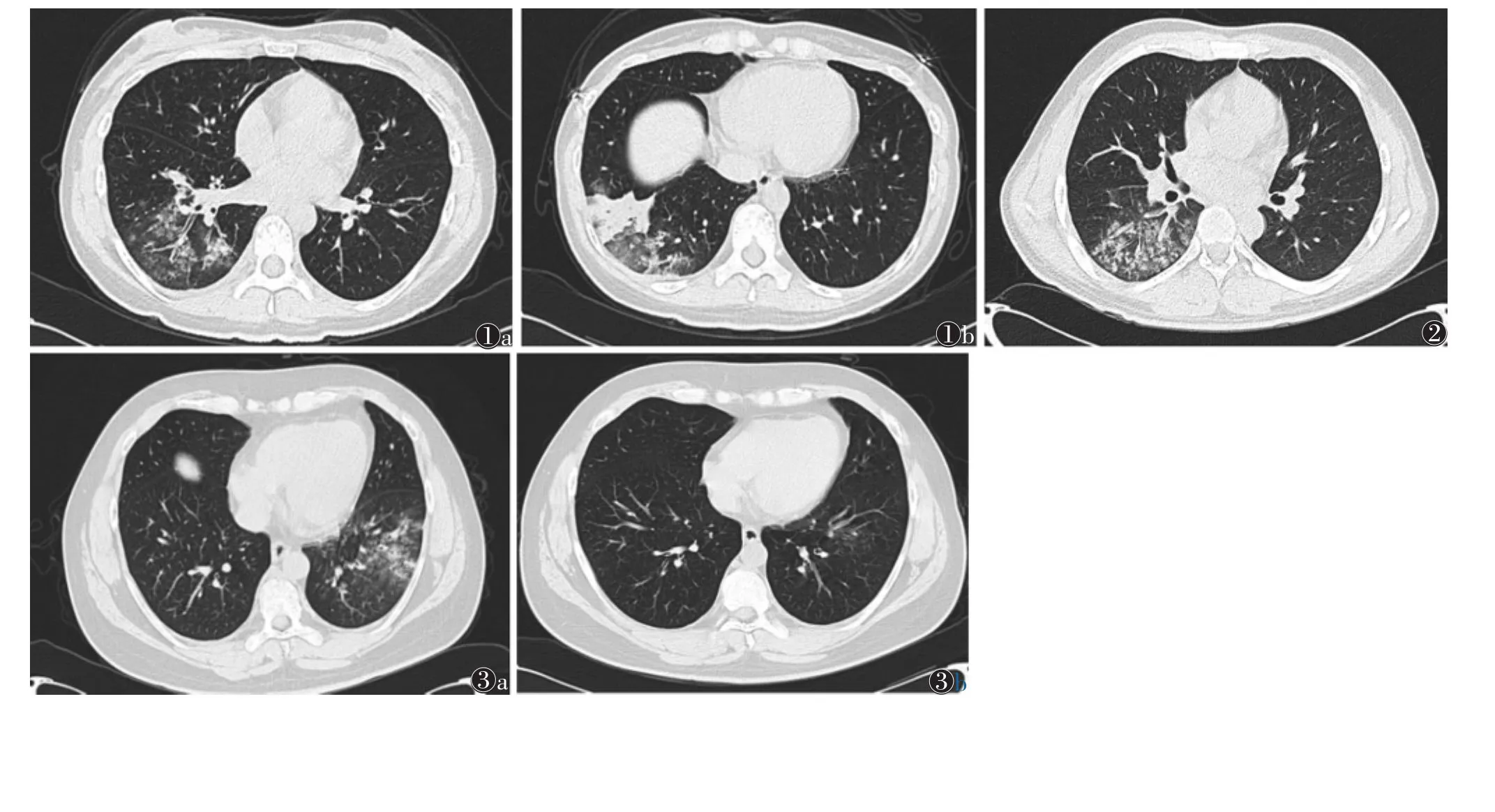
图1 女,29岁,咳嗽咳痰5 d,血清学支原体抗体阳性 图1a CT示右肺下叶斑片状、结节状高密度影,局部支气管壁增厚 图1b 可见局部实变及其周边磨玻璃样密度灶 图2 女,45岁,受凉后发热咳嗽8 d,血清学支原体抗体阳性,CT示右肺下叶局部支气管壁增厚,沿支气管走行可见树芽征及腺泡结节 图3 男,31岁,无明显诱因发热伴咳嗽,咳痰5 d,血清学支原体抗体阳性 图3a CT示左肺下叶支气管壁及中央间质增厚,淡片状磨玻璃样密度灶 图3b 治疗8 d后复查,左肺下叶病变已基本吸收消失
[参考文献]
[1]Leon P,Nadjm B,Horby P,et al.The bacterial aetiology of adult community-acquired pneumonia in Asia:a systematic review[J].Trans R Soc Trop Med Hyg,2014,108:326-337.
[2]Dumke R,Schnee C,Pletz MW,et al.Mycoplasma pneumoniae and Chlamydia spp.infection in community-acquired pneumonia,Germany,2011-2012[J].Emerg Infect Dis,2015,21:426-434.
[3]章成伟,李金.阿奇霉素对急性期MPP患儿血浆氧自由基及心肌酶水平的影响[J]. 现代实用医学,2015,27(1):100-102.
[4]马燕.炎琥宁联合莫西沙星治疗成人MPP疗效观察[J].临床合理用药杂志,2012,5(5):58-59.
[5]胡必杰,何礼贤,魏丽,等.中国城市成人社区获得性肺炎病原谱和预后的流行病学调查(中期报告)[C]//中华医学会第六次全国呼吸病学术会议,2004.
[6]张雪冬,刘双.肺炎支原体感染的实验室研究进展[J].临床肺科杂志,2011,16(2):241-243.
[7]陈会新,宋爱丽,肖永红.痰热清联合阿奇霉素治疗MPP疗效观察[J]. 临床肺科杂志,2014,19(2):359-361.
[8]Aviner S,Miskin H,London D,et al.Mycoplasma pneumonia infection:a possible trigger for immune thrombocytopenia[J].Indian J Hematol Blood Transfus,2011,27:46-50.
[9]陈世煌,卢丽梅,陈杰云.CT在MPP中的影像特点及应用价值探析[J]. 中外医疗,2016,35(31):176-178.
[10]王宏伟,丁长伟,杨军洁.支原体肺炎的CT表现[J].中国医学影像技术,2005,21(2):292-294.
[11]张建辉,冯雪松,王书轩.小儿MPP影像诊断[J].辽宁医学杂志,2007,21(2):127-129.
[12]曲丹,林琳,李胜岐.成人肺炎MPP的CT影像特点[J].中国医学影像技术,2010,26(2):269-271.
[13]黄雅.难治性支原体肺炎的肺外表现及免疫因子观察[J].临床医学工程,2014,21(8):989-990.
[14]侯小萍.成人支原体肺炎的CT影像表现[J].医学理论与实践,2014,27(22):3045-3046.
[15]Reittner P,Ward S,Heyneman L,et al.Pneumonia:high-resolution CT findings in 114 patients[J].Eur Radiol,2003,13:515-521.
[16]Kawai Y,Miyashita N,Kubo M,et al.Nationwide surveillance of macrolide-resistant Mycoplasma pneumonia infection in pediatric patients[J].Antimicrob Agents Chemother,2013,57:4046-4049.
[17]Hong KB,Choi EH,Lee HJ,et al.Macrolide resistance of Mycoplasma pneumoniae,South Korea,2000-2011[J].Emerg Infect Dis,2013,19:1281-1284.

