正常人脑生长发育规律的DTI初步研究
吴道清,刘 耀,陈 钦,李晓卿,李华灿
(福建中医药大学附属第二人民医院影像科,福建 福州 350003)
DTI是在20世纪90年代迅速发展的MRI功能成像技术,主要反映了人体组织中水分子的扩散特性,用于观察大脑白质纤维结构的特性。本文通过研究100例正常人脑的DTI成像,分析脑白质纤维束DTI参数在不同性别中的差异性及与年龄的相关性,以了解人脑白质纤维束的生长发育及自然老化过程。
1 资料与方法
1.1一般资料选择2015年11月至2017年3月在我院检查的100例健康志愿者,年龄11个月~83岁,中位年龄32岁。按年龄分组:幼儿组(≤6岁)、儿童组(7~14岁)、青年组(15~35岁)、中年组(36~60岁)、老年组(>60岁),每组 20例,男女各10例。志愿者选择标准:无中枢神经系统疾病;无心、肝及肾脏等各种重要脏器病变;无MRI检查禁忌证。所有患者均签署知情同意书,并经伦理委员会讨论通过。
1.2 仪器与方法应用 GE signa HDx 3.0 T高场MRI仪,头部正交线圈,患者取仰卧位,头颅置于线圈中央,用海绵垫固定两侧。常规颅脑检查轴位T1WI TR/TE 1 785 ms/23 ms;T2FLAIR TR/TE/TI 8 650 ms/160 ms/2 100 ms。DTI采用SS-GSE-EPI序列;扫描范围从桥脑下部至头顶部,层厚4 mm,无间隔,共扫描28层,扩散敏感梯度方向数:25,TR/TE 6 000 ms/110 ms,矩阵 256×256,FOV 24 cm×24 cm,b 值为0、1 000 s/mm2,扫描时间共 252 s。
1.3图像及数据处理把扫描图像传至ADW 4.5后处理工作站。采用Functool软件,对DTI数据进行后处理,获得部分各向异性(FA)值、ADC值的参数图,对相应区域采用ROI方法获取数据。
1.4统计学处理 采用SPSS 18.0统计软件,数据以±s表示。所有数据行正态分析及方差齐性检验;不同性别间比较采用两样本t检验;左右侧比较采用配对t检验;各年龄组间采用方差分析;ADC值及FA值与年龄间相关性行Spearman秩相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1不同性别间各部位FA值及ADC值比较(表1,2)不同性别各部位FA值及ADC值比较,差异均无统计学意义(均P>0.05)。
表1 不同性别间各部位FA值比较(±s)
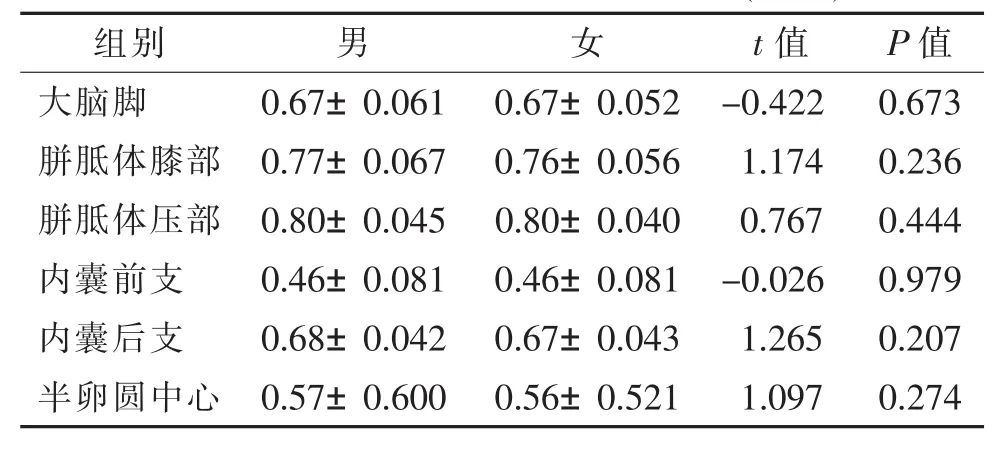
表1 不同性别间各部位FA值比较(±s)
组别 男 女 t值 P值大脑脚 0.67±0.061 0.67±0.052 -0.422 0.673胼胝体膝部 0.77±0.067 0.76±0.056 1.174 0.236胼胝体压部 0.80±0.045 0.80±0.040 0.767 0.444内囊前支 0.46±0.081 0.46±0.081 -0.026 0.979内囊后支 0.68±0.042 0.67±0.043 1.265 0.207半卵圆中心 0.57±0.600 0.56±0.521 1.097 0.274
表2 不同性别间各部位ADC值比较(×10-4mm2/s,±s)

表2 不同性别间各部位ADC值比较(×10-4mm2/s,±s)
组别 男 女 t值 P值大脑脚 8.47±0.56 8.40±0.47 1.053 0.294胼胝体膝部 8.25±0.51 8.35±0.49 -1.459 0.146胼胝体压部 7.87±0.55 7.80±0.49 0.959 0.339内囊前支 7.90±0.46 8.10±0.55 -1.331 0.152内囊后支 7.52±0.36 7.54±0.42 -0.408 0.684半卵圆中心 7.76±0.45 7.71±0.42 0.897 0.371
2.2不同年龄组FA值及ADC值比较(表3,4)不同年龄组间各部位FA值及ADC值比较,差异均有统计学意义(均 P<0.05)。
表3 不同年龄组间各部位FA值比较(±s)
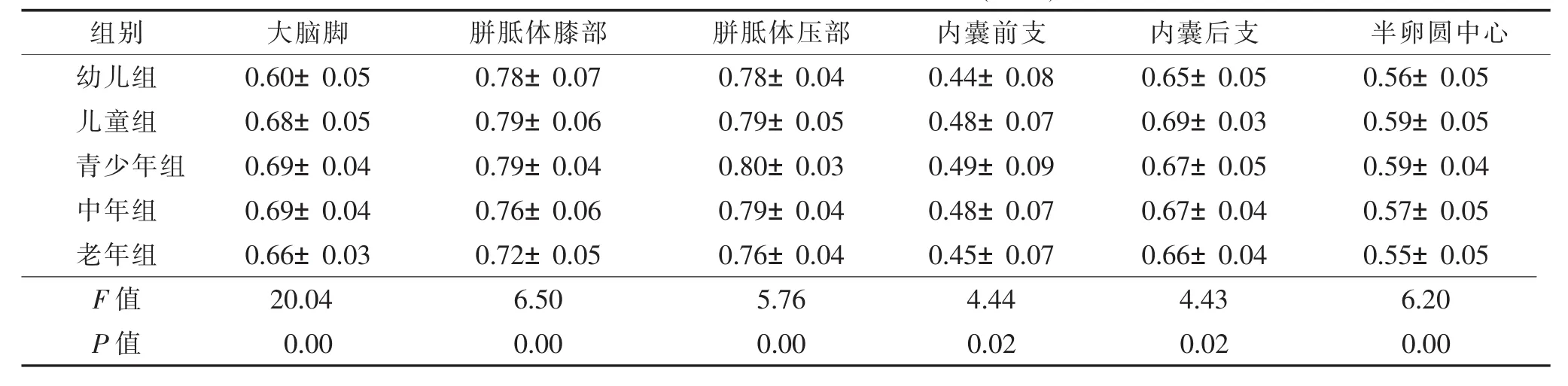
表3 不同年龄组间各部位FA值比较(±s)
组别 大脑脚 胼胝体膝部 胼胝体压部 内囊前支 内囊后支 半卵圆中心幼儿组 0.60±0.05 0.78±0.07 0.78±0.04 0.44±0.08 0.65±0.05 0.56±0.05儿童组 0.68±0.05 0.79±0.06 0.79±0.05 0.48±0.07 0.69±0.03 0.59±0.05青少年组 0.69±0.04 0.79±0.04 0.80±0.03 0.49±0.09 0.67±0.05 0.59±0.04中年组 0.69±0.04 0.76±0.06 0.79±0.04 0.48±0.07 0.67±0.04 0.57±0.05老年组 0.66±0.03 0.72±0.05 0.76±0.04 0.45±0.07 0.66±0.04 0.55±0.05 F值 20.04 6.50 5.76 4.44 4.43 6.20 P值 0.00 0.00 0.00 0.02 0.02 0.00
表4 不同年龄组间各部位ADC值比较(×10-4mm2/s,±s)
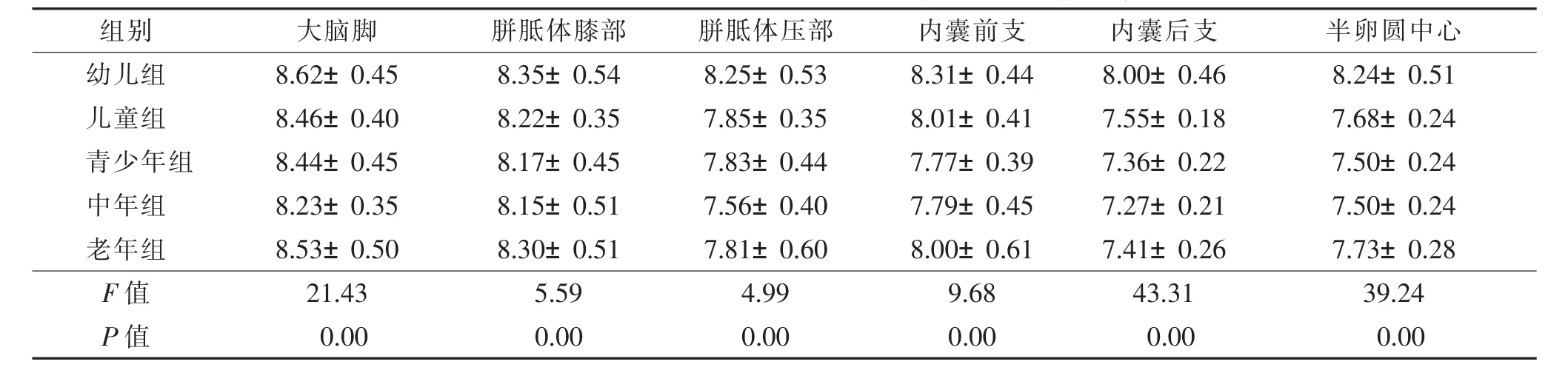
表4 不同年龄组间各部位ADC值比较(×10-4mm2/s,±s)
组别 大脑脚 胼胝体膝部 胼胝体压部 内囊前支 内囊后支 半卵圆中心幼儿组 8.62±0.45 8.35±0.54 8.25±0.53 8.31±0.44 8.00±0.46 8.24±0.51儿童组 8.46±0.40 8.22±0.35 7.85±0.35 8.01±0.41 7.55±0.18 7.68±0.24青少年组 8.44±0.45 8.17±0.45 7.83±0.44 7.77±0.39 7.36±0.22 7.50±0.24中年组 8.23±0.35 8.15±0.51 7.56±0.40 7.79±0.45 7.27±0.21 7.50±0.24老年组 8.53±0.50 8.30±0.51 7.81±0.60 8.00±0.61 7.41±0.26 7.73±0.28 F值 21.43 5.59 4.99 9.68 43.31 39.24 P值 0.00 0.00 0.00 0.00 0.00 0.00
2.3ADC值及FA值与年龄相关性(表5)把各年龄组分成5个等级,分别与ADC值及FA值行相关性分析。ADC值与年龄之间,除胼胝体膝部及压部外,其余部分均具有较强相关性;FA值在大脑脚、胼胝体膝部及半卵圆中心与年龄具有较强相关性,其他部位与年龄则无相关关系。

表5 各部位ADC值及FA值与年龄相关性
3 讨论
DTI是一种可在体无创性评价人脑白质纤维束走向及完整性的MRI成像方法[1],可从量和方向上反映水分子扩散的变化,并以此反映组织内扩散的各向异性[2]。DTI最常用的参数指标是FA和ADC。FA是指弥散的各向异性部分与弥散张量总值的比值,反映了各向异性成分占整个弥散张量的比例,可用于评价细胞膜与髓鞘的完整性。在人脑白质中水分子运动受神经纤维走行方向、密集程度及髓鞘等多种因素的影响。水分子在平行纤维走行方向的扩散程度较高,呈高度的各向异性。各向异性程度越高,FA值越大。ADC值主要反映水分子单位时间内扩散运动的范围。在人体组织中,水分子弥散越受限制,ADC值越低。所以,FA值与ADC值相结合可较准确地评价脑白质的形态结构变化。
本研究分析人脑不同部位包括大脑脚、胼胝体膝部、压部、内囊前后肢及半卵圆中心的FA值及ADC值,不同性别间上述部位的FA值及ADC值无差异性[3]。但不同年龄组间的FA值与ADC值差异有统计学意义。人脑的发育遵循着一定的规律,在青少年之前,随着年龄增长,ADC值逐渐下降,FA值逐渐升高,这是由于神经细胞的增殖、轴突发育及髓鞘化等多种因素的作用;进入成年后,特别是老年人,其髓鞘退化脱失,神经纤维束减少,细胞外间隙扩大,水分子扩散增加,ADC值升高,FA值逐渐降低[4]。脑白质的发育从出生开始,前12个月是快速发育阶段;之后1年逐渐修饰、改进;再之后逐步趋于稳定,直到成人水平[5]。 Stadlbauer等[6]研究发现,大脑额叶、边缘叶、胼胝体和颞叶部分区域的纤维束密度随着年龄增长而显著降低。Gong等[7]认为轴突密度与年龄呈负相关。本研究以传统年龄分组进行统计,表明ADC值在成年之前逐渐降低,FA值则逐渐升高;在中年阶段改变不明显;而在老年阶段ADC值又有升高趋势,FA值降低。这说明人脑神经组织在成年之前是逐步发育、完善的[8];而随年龄进一步增长,人脑神经组织逐渐退变。本研究中大部分部位的FA值或ADC值与年龄具有较强的相关性,其余相关性不强,可能与例数偏少有关。
总之,DTI已广泛应用于日常临床工作,本研究通过分析正常人脑ADC值与FA值随年龄增长的变化趋势,了解人脑白质纤维束生长发育的精细变化信息,可为相关疾病的诊断或预后判断等提供依据。
[参考文献]
[1]Sala S,Agosta F,Pagani E,et al.Microstructural changes and atrophy in brain white matter tracts with aging[J].Neurobiol Aging,2012,33:488-498.
[2]付民峰,许宏霞.基于DTI分析小脑上脚及其交叉各向异性分数和ADC值的差异性[J].中国中西医结合影像学杂志,2015,13(4):488-490.
[3]赵霞,王剑飞,鞠文萍,等.正常中年人海马磁共振扩散张量成像相关参数研究[J]. 磁共振成像,2016,7(10):743-748.
[4]谢铭飞,高思佳,胡文,等.健康成人脑白质扩散峰度成像与年龄相关性变化的初步研究[J].中国临床医学影像学杂志,2016,27(10):685-689.
[5]Hermoye L,Saint-Martin C,Cosnard G,et al.Pediatric diffusion tensor imaging:normal database and observation of the white matter maturation in early childhood[J].Neuroimage,2006,29:493-504.
[6]Stadlbauer A,Ganslandt O,Salomonowitza E,et al.Magnetic resonance fiber density mapping of age-related white matter changes[J].Eur J Radiol,2012,81:4005-4012.
[7]Gong NJ,Wong CS,Chan CC.Aging in deep gray matter and white matter revealed by diffusional kurtosis imaging[J].Neurobiol Aging,2014,35:2203-2216.
[8]Cancelliere A,Mangano FT,Air EL,et al.DTI values in key white matter tracts from infancy through adolescence[J].AJNR Am J Neuroradiol,2013,34:1443-1449.

