三个稀土-主族三金属Lnバ-Srギ-Kガ配合物的结构与发光性质
王宏胜 李公春 吴艳超 张万强 陈新华
0 引 言
近年来,设计合成含有稀土元素的配位聚合物成为配位化学研究领域的一大热点。特别是具有良好发光性质的稀土配合物,由于在荧光探针、激光材料、光致发光及电致发光等领域的潜在应用价值而受到极大关注[1-5]。含稀土的异金属配合物特别是3d~4f配位聚合物,由于其新颖的结构和良好的性质成为相关研究的重要内容之一[6-10]。而稀土与主族元素的配位聚合物的合成与性质研究相对比较少,一些研究者合成并研究了稀土-碱金属和稀土-碱土金属的双金属配位聚合物的性质[11-13]。根据文献报道,少数含稀土元素的三金属配位聚合物被合成并报道,其中配体均为多元羧酸或氰根离子[14-18],而这些配合物中只有Euバ-Srギ-Kガ和Tbバ-Srギ)-Kガ与2,4,6-吡啶三甲酸的配合物具有较好的光致发光性质[18]。研究表明,有机配体在配位聚合物的结构和性质方面有着重要的作用,对于含稀土异金属配位聚合物的性质,非稀土元素可能对稀土元素有不同的影响,比如在发光配合物中,部分元素可能会对稀土离子的荧光产生敏化作用,也可能产生淬灭作用。在此基础上,我们使用2,4,6-吡啶三甲酸(H3ptc)为有机配体,在水热条件下和稀土钐、钆或镝的三价离子的高氯酸盐水溶液、碳酸钾及碳酸锶反应,成功合成出3个含有3种金属离子的三维配位聚合物[LnSrK(ptc)2(H2O)]n(Ln=Sm(1)、Gd(2)、Dy(3)), 其 中Smバ-Srギ-Kガ和Dyバ-Srギ-Kガ的配合物在紫外光照射下发射Smバ和Dyバ的特征荧光,Gdバ-Srギ-Kガ配合物在紫外光照射下发射由配体向金属离子发生核移跃迁产生的绿色荧光。
1 实验部分
1.1 试剂与仪器
Sm(ClO4)3、Dy(ClO4)3和 Gd(ClO4)3水溶液分别用Sm2O3、Dy2O3和 Gd2O3与高氯酸反应制得,3种稀土氧化物纯度均大于99.95%;2,4,6-吡啶三甲酸用氧化法合成;实验中所使用的其它化学试剂均为分析纯。
C、H、N元素含量用VarioELⅢ元素分析仪 (德国Elementar公司)测定;红外光谱用FTIR-650型红外光谱仪(天津港东科技发展股份有限公司)(4 000~400 cm-1,KBr压片法)测定;熔点仪用 WRS-1B数字熔点仪(上海申光仪器仪表有限公司)测定;荧光激发光谱、发射光谱和绝对量子产率用FLS980稳态瞬态荧光光谱仪(英国Edinburgh仪器公司)测定。
1.2 配体的合成
2,4,6-吡啶三甲酸 (H3ptc)用高锰酸钾氧化2,4,6-三甲基吡啶制备[19],对产品进行了元素分析和红外光谱测试,结果如下。元素分析按C8H5NO6计算值(%):C,45.51;H,2.39;N,6.63。 测定值(%):C,45.74;H,2.08;N,6.49。 IR(KBr pellet,cm-1):3 544,3 421,1 719,1 591s,1555,1431,1402,1 280,1 197,1088,926,722,758,706,685,626,563。
1.3 [LnSr K(ptc)2(H 2O)]n(Ln=Sm(1)、Dy(2)、Gd(3))的合成
配合物[SmSrK(ptc)2(H2O)]n(1)的单晶体用0.040 mol·L-1的 Sm(ClO4)3水 溶 液 (0.2 mmol,5.00 mL),SrCO3(0.2 mmol,0.029 6 g),K2CO3(0.1 mmol,0.013 8 g)和 H3ptc(0.4 mmol,0.084 4 g)在 180 ℃水热条件下反应制备,产率55%(基于Sm3+计算)。配位聚合物[DySrK(ptc)2(H2O)]n(2)和[GdSrK(ptc)2(H2O)]n(3)的单晶体制备方法与配合物1的制备方法相同,只是将使用的Sm(ClO4)3水溶液改变为Dy(ClO4)3或Gd(ClO4)3水溶液,产率63%和58%。对配合物1(C16H6N2O13SmSrK)的元素分析理论值(%):C,27.02;H,0.85;N,3.94。 测 定 值 (%):C,26.65;H,1.24;N,4.15。 配合物 2(C16H6N2O13DySrK)的理论值(%):C,26.56;H,0.84;N,3.87。测定值(%):C,26.21;H,1.13;N,3.91。 配合物 3(C16H6N2O13GdSrK)的理论值(%):C,26.76;H,0.84;N,3.90;测定值(%):C,26.42;H,1.08;N,3.77。熔点测试表明,3个配合物的熔点均大于300℃。
1.4 配合物的结构表征
选取适合结构分析的3种配合物的单晶体,配合物1在Bruker SMART1000 CCD X射线单晶衍射仪上,采用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm),以φ-ω扫描方式在一定的θ范围内收集衍射数据,利用SADABS程序对数据进行吸收校正,晶体结构用 SHELXS-97[20]和 SHELXL-97[21]软件进行解析和精修。配合物2和3在Bruker APEX-ⅡCCD型X射线单晶衍射仪上收集数据,同样用SHELXS-97和SHELXL-97软件进行解析和精修。3个配合物的主要晶体学数据和结构精修参数列于表1。3种金属离子和氧原子或氮原子的键长值列于表2中。
CCDC:1566176,1;1566177,2;1566178,3。
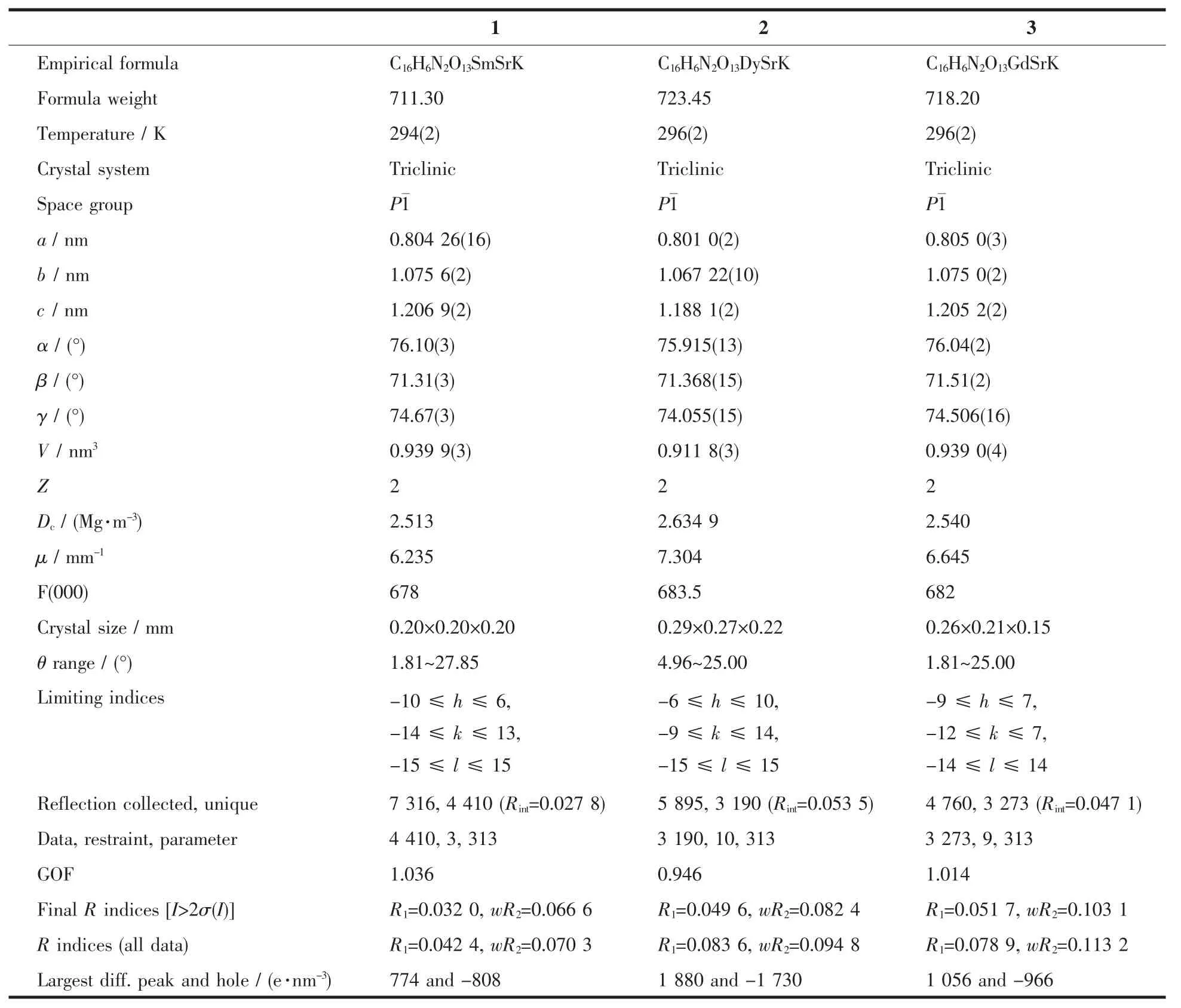
表1 三个配合物的晶体和结构精修数据Table 1 Crystal data and structure refinement for the three complexes
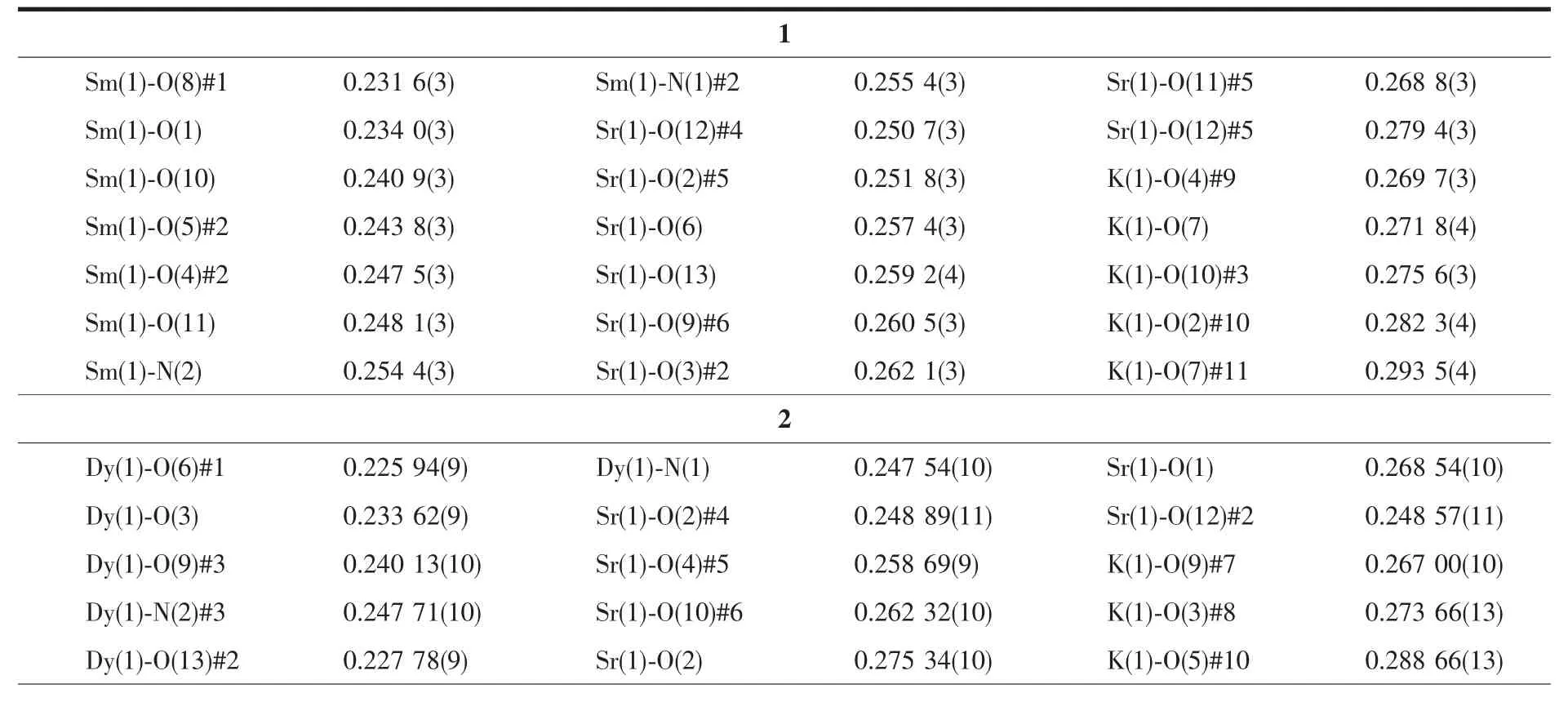
表2 三个配合物的部分键长(nm)Table 2 Selected bond lengths(nm)for three complexes
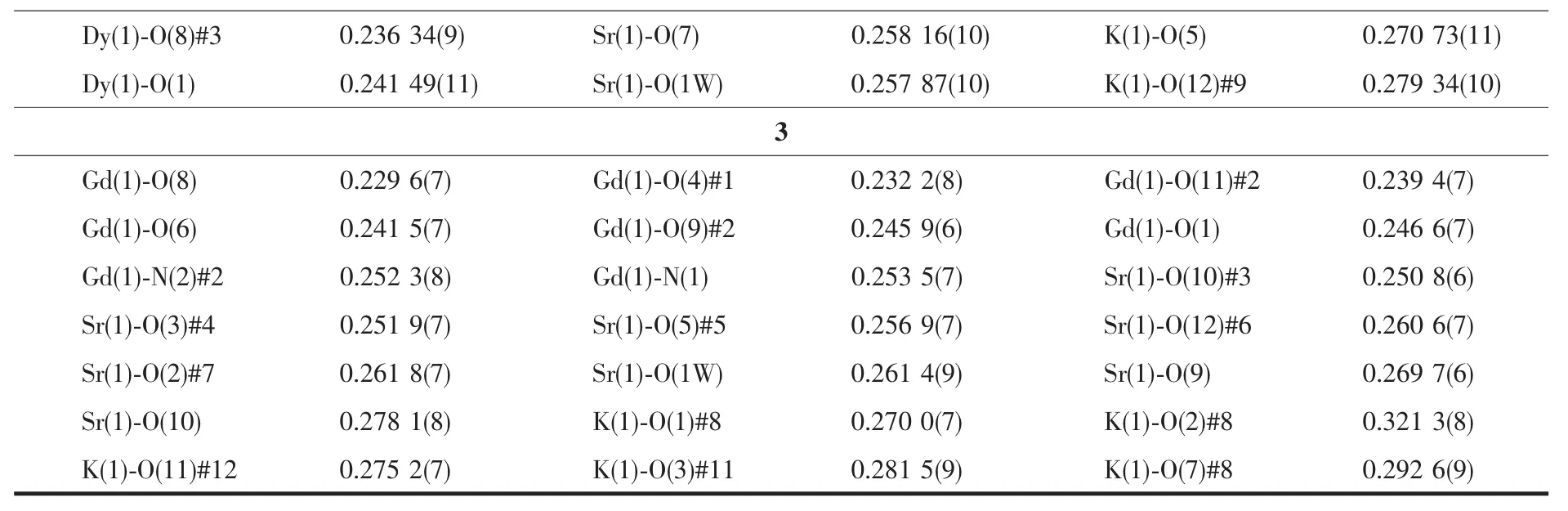
续表2
2 结果与讨论
2.1 配合物的结构
三个配合物为同构化合物,以配合物2为例对三者的结构进行说明。如图1所示,稀土Dy3+离子在配合物中为八配位,配位原子为6个氧原子和2个氮原子,配位氧原子均为配体羧基氧原子,每个Dy3+离子与2个ptc阴离子配体的2-、6-位羧基上一个氧原子及吡啶环上氮原子螯合配位;Sr2+离子也是八配位,配位原子都是氧原子,其中1个氧原子来自配位水分子,其余7个来自配体羧基氧原子。Dy3+离子和Sr2+离子都处于由8个配位原子形成的变形四方反棱柱多面体中。K+离子与5个羧基氧原子配位,形成了变形四方锥结构。通过配体与金属离子的连接,形成了三维网状结构的配位聚合物,如图2所示。配体ptc在配合物中有2种配位方式,一种方式中同时连接了2个Dy3+、3个Sr2+及2个K+共7个金属离子,另一方式中连接了2个Dy3+、3个Sr2+及3个K+共8个金属离子(图3)。
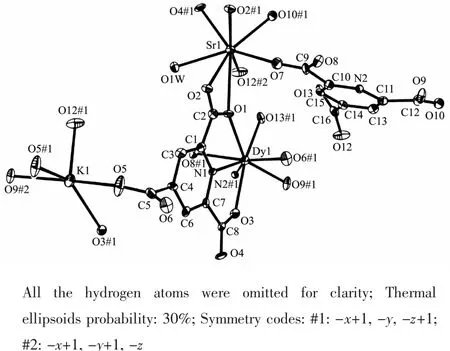
图1 配合物2中Dyバ、Srギ、Kガ离子的配位环境Fig.1 ORTEPrepresentation of 2 showing the coordination environment of Dyバ,Srギand Kガ
2.2 配合物的红外光谱
三个配合物的红外谱图如图4所示。从图中可以看出,羧酸配体在1 700 cm-1附近的-COOH的红外吸收峰消失,在1 625 cm-1处出现了-COO-的反对称伸缩振动吸收峰,而在1 370 cm-1附近出现了-COO-的对称伸缩振动吸收峰。表明H3ptc形成阴离子配体与金属离子配位,而且3个配合物的红外图非常相近,表明ptc阴离子以相同的配位方式与稀土离子形成配合物,这也与结构解析的结果一致。
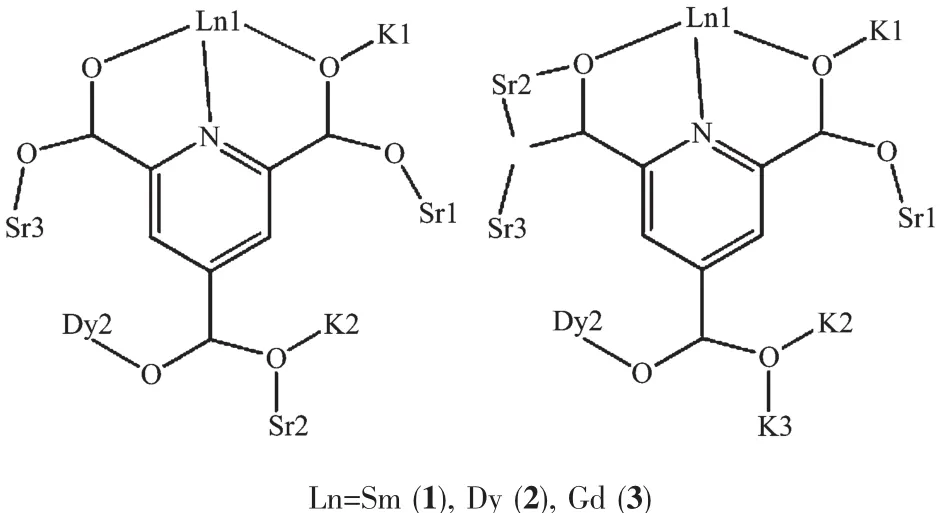
图3 配体ptc在配合物中的2种配位方式Fig.3 Coordination modes of ptc ligands in the complexes
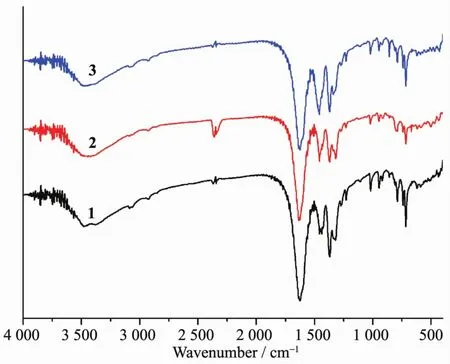
图4 三个配合物的红外光谱Fig.4 IR spectra of three complexes
2.3 配合物的光致发光性质
在室温下,测试了3个配合物的激发和发射光谱及光致发光的量子产率。
2.3.1 配合物1的荧光光谱及量子产率
以600 nm作为发射波长,激发狭缝为2.0 nm,发射狭缝为0.5 nm,测试了配合物1粉末样品的激发光谱,如图5a所示。从图中可以看出其最佳激发波长在306 nm。用306 nm作激发波长,激发狭缝为2.0 nm,发射狭缝为0.5 nm,测试了配合物的发射光谱, 如图 5b所示,在 562、601、645、709和 788 nm等5处出现了荧光发射峰,分别对应于Smバ4G5/2→6HJ(J=5/2、7/2、9/2、11/2、13/2)的跃迁。 通常钐配合物的发射光谱中可以看到在可见区4G5/2→6HJ(J=5/2、7/2、9/2)跃迁的3个发射峰,在此配合物中,还可以看到在可见区的4G5/2→6H11/2跃迁峰及在近红外区的4G5/2→6H13/2的跃迁发射峰。在室温下测试该配合物粉末样品光致发光的绝对量子产率为0.5%。
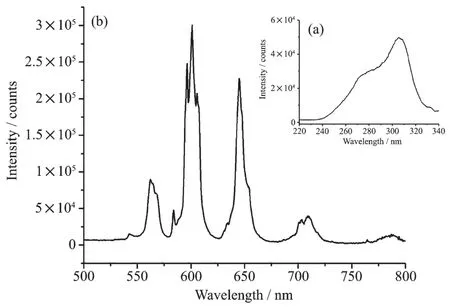
图5 配合物1的激发光谱(a)和发射光谱(b)Fig.5 Excitation(a)and emission(b)spectra of complex 1
2.3.2 配合物2的荧光光谱及量子产率
以575 nm作为发射波长,激发狭缝为1.0 nm,发射狭缝为0.5 nm测试了配合物2粉末样品的激发光谱,如图6a所示。从图中可以看出其最佳激发波长在304 nm。用304 nm作激发波长,激发狭缝为1.0 nm,发射狭缝为0.5 nm,测试了配合物的发射光谱,如图6b所示,在486、575、663和753 nm等4处出现了荧光发射峰,分别对应于Dyバ的4F5/2→6HJ(J=15/2、13/2、11/2、9/2)跃迁。 通常镝配合物的发射光谱中可以看到4F5/2→6HJ(J=15/2、13/2)跃迁的2个发射峰,在此配合物中,也可以看到4F5/2→6H11/2和4F5/2→6H9/2跃迁产生的2个较弱发射峰。在室温下测试该配合物粉末样品光致发光的绝对量子产率为2.0%。
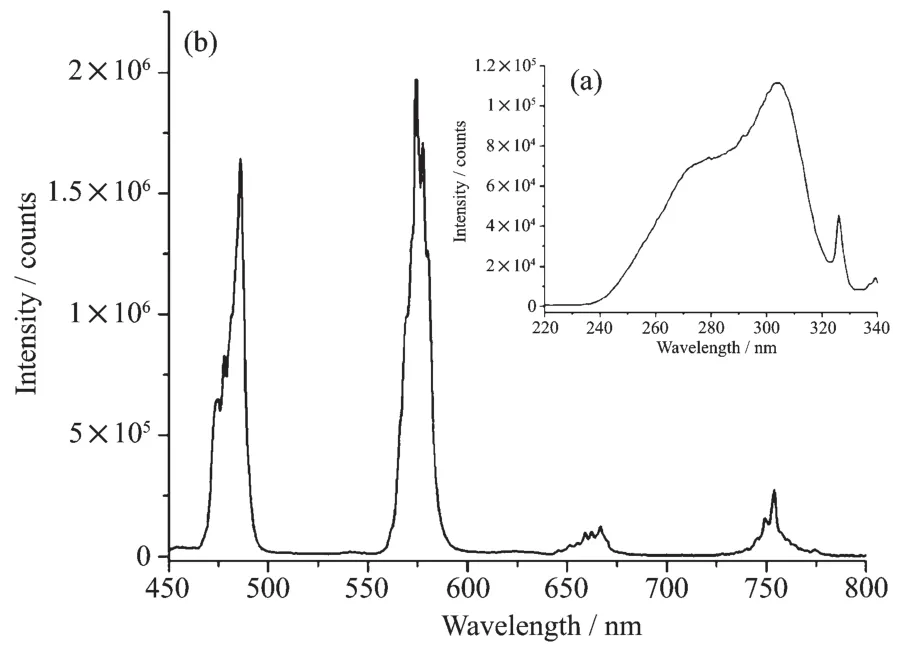
图6 配合物2的激发光谱(a)和发射光谱(b)Fig.6 Excitation(a)and emission(b)spectra of complex 2
2.3.3 配合物3的荧光光谱及量子产率
以515 nm作为发射波长,激发狭缝和发射狭缝分别为1和0.5 nm测试了配合物3的粉末样品的激发光谱,如图7所示。从图中可以看出其最佳激发波长在352 nm。用352 nm作激发波长,激发狭缝为1.0 nm,发射狭缝为0.5 nm,测试了配合物的发射光谱,如图8所示,在450~650 nm范围内出现了一个宽的荧光发射峰,其中最强峰在515 nm处,该发射峰是由于配体向金属离子发生荷移跃迁产生。从该配合物的最佳激发波长和发射波长可以看出,该配合物对紫外光的Stokes位移比较大,达到了~170 nm。另外,该配合物发射光谱范围比较宽,在450~650 nm均有发射,覆盖了可见光的大部分区域。在室温下测试该配合物粉末样品光致发光的绝对量子产率为12.8%。另外从该配合物的色度坐标图(图9)可以看出,该配合物在波长为350 nm左右的紫外光激发下,发射绿色荧光。

图7 配合物3的激发光谱Fig.7 Excitation spectrum of complex 3
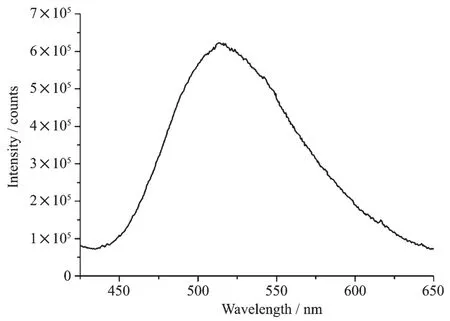
图8 配合物3的发射光谱Fig.8 Emission spectrum of complex 3
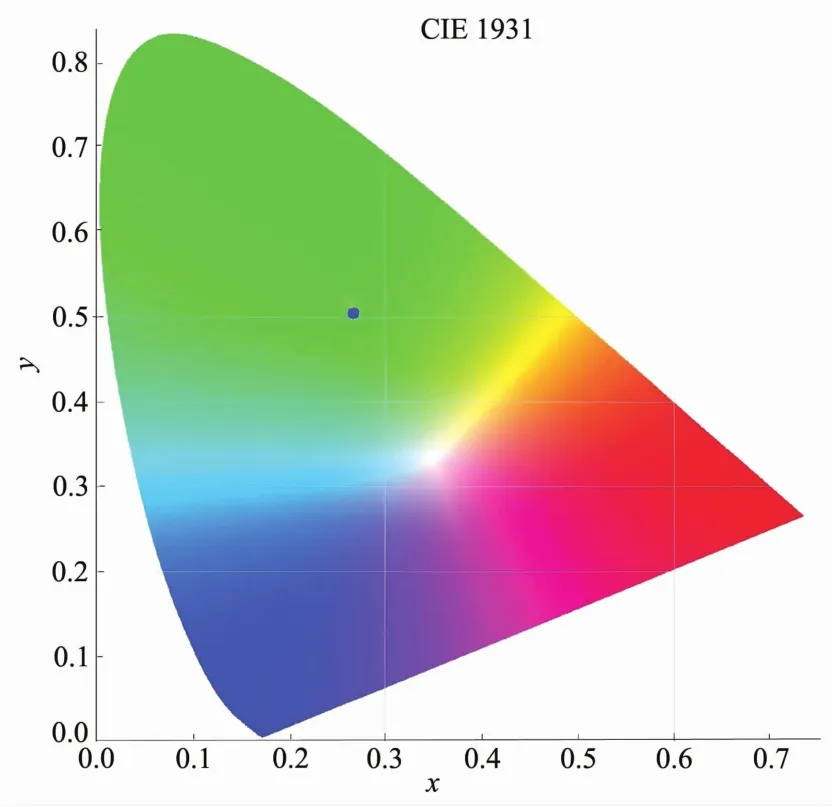
图9 配合物3的色度坐标Fig.9 Chromaticity diagram of complex 3
对比3个配合物的荧光激发光谱,可以看出1、2两个配合物的最佳激发波长很相近,而且激发峰形也相似,它们和3的激发峰峰形及最佳激发波长相差很大,由此可知,尽管3种配合物的配体和结构相同,且均为三金属配合物,但是在光致发光的机理上有着本质的区别,配合物1和2是按照稀土配合物发光机理中的“天线效应”产生荧光,即在紫外光激发时,配体被首先激发,然后经过系间窜越到配体三重激发态,再将能量传递给稀土离子使其被激发产生荧光,而配合物3是由于发生配体向金属离子的核移跃迁产生荧光。
3 结 论
采用水热合成法制备了3个含稀土和主族元素的三金属配位聚合物,测定了3种化合物的晶体结构。对配合物进行了元素分析、红外光谱、熔点等表征。对3种配合物的光致发光性质进行了测试,结果表明,Smバ-Srギ-Kガ和 Dyバ-Srギ-Kガ与配体 ptc生成的配合物在紫外光照射下发射Smバ和Dyバ的特征荧光;Gdバ-Srギ-Kガ配合物在紫外光照射下发绿色荧光,该发光是由于配体向金属离子发生核移跃迁产生。这为利用稀土钆元素合成发光配合物提供了新的思路。
参考文献:
[1]Liu Q Y,Wang W F,Wang Y L,et al.Inorg.Chem.,2012,51:2381-2392
[2]QUAN Jing-Miao(全静苗),LEI Hai-Rui(雷海瑞),LIU Feng-Yi(刘峰毅),et al.Scientia Sinica Chimica(中国科学:化学),2017,47(7):876-881
[3]Cui Y J,Xu H,Yue Y F,et al.J.Am.Chem.Soc.,2012,134:3979-3982
[4]ZHAO Peng-Fei(赵朋飞),SHE Jiang-Bo(佘江波),LI Dong-Dong(李冬冬),et al.Acta Photonica Sinica(光子学报),2014,43(2):0216001
[5]ZHOULiang(周亮),DENGRui-Ping(邓瑞平),ZHANGHong-Jie(张洪杰).Chinese J.Inorg.Chem.(无机化学学报),2014,30(1):113-120
[6]Zhao B,Cheng P,Dai Y,et al.Angew.Chem.Int.Ed.,2003,42:934-936
[7]Zhao B,Cheng P,Chen X Y,et al.J.Am.Chem.Soc.,2004,126:3012-3013
[8]Zhao X Q,Zhao B,Ma Y,et al.Inorg.Chem.,2007,46:5832-5834
[9]Gao H L,Zhao B,Zhao X,et al.Inorg.Chem.,2008,47:11057-11061
[10]Cui Y J,Yue Y F,Qian G D,et al.Chem.Rev.,2012,112:1126-1162
[11]Huang Y G,Jiang FL,Hong M C.Coord.Chem.Rev.,2009,253:2814-2834
[12]Mishra S,Ledoux G,Jeanneau E,et al.Dalton Trans.,2012,41:1490-1502
[13]Zhao X Q,Zuo Y,Gao D L,et al.Cryst.Growth Des.,2009,9:3948-3957
[14]Gao H L,Yi L,Ding B,et al.Inorg.Chem.,2006,45:481-483
[15]Kou H Z,Zhou B C,Gao S,et al.Angew.Chem.Int.Ed.,2003,42:3288-3291
[16]Kou H Z,Zhou B C,Wang R J.Inorg.Chem.,2003,42:7658-7665
[17]Zhang W Z,Lv T Y,Wei D Z,et al.Inorg.Chem.Commun.,2011,14:1245-1249
[18]Wang H S,Xia J,Zhai B,et al.J.Coord.Chem.,2014,67:3234-3242
[19]Syper L,Kloc K,Mlochowski J.Tetrahedron,1980,36:123-129
[20]Sheldrick G M.SHELXS 97,Program for the Solution of Crystal Structures,University of Göttingen,Germany,1997.
[21]Sheldrick G M.SHELXL 97,Program for the Refinement of Crystal Structures,University of Göttingen,Germany,1997.

