老年糖尿病患者vaspin与不同体质量指数的相关性
王洁妤,田 甜,李 耘,杨 伟
(首都医科大学宣武医院老年医学科,北京 100053;*通讯作者,E-mail:yangw-79@163.com)
脂肪组织是主要的储能组织,现已发现脂肪组织分泌多种生命活性物质,如瘦素、抵抗素、脂联素、白细胞介素-6、肿瘤坏死因子、visfatin等,它们均称为脂肪细胞因子。因此脂肪组织也被认为是机体的一种内分泌器官。在调节肥胖相关的血管疾病(如糖尿病、动脉粥样硬化和胰岛素抵抗)过程中发挥着重要的作用[1]。vaspin是2005年由日本学者从肥胖的自发性T2DM的OLETF(Otsuka Long-Evans Tokushima Fatty)大鼠内脏脂肪组织中分离出来的一种脂肪细胞因子,动物实验证明它有胰岛素增敏作用[2]。近年来国内外对vaspin与肥胖、T2DM、胰岛素抵抗之间的关系进行了大量的研究,发现其与肥胖、糖代谢、胰岛素抵抗的关系密切[3]。由于老年人群的异质性存在,同时合并多种慢性疾病,且预期寿命均不相同,针对这一人群的研究甚是缺乏,本研究针对老年糖尿病人群,观察血清vaspin与不同体质量指数的患者的变化及其临床意义,探讨其在老年人群中由肥胖向糖尿病发生、发展的可能机制。
1 研究对象与方法
1.1 研究对象
选取2014-07~2017-10于首都医科大学宣武医院老年医学科及内分泌科住院治疗的老年T2DM患者176例,入组患者均符合2013年中国成人2型糖尿病指南关于2型糖尿病的诊断标准[4],将所有人群按BMI分组,分为正常组(BMI<24 kg/m2)62例、超重组(24 kg/m2≤BMI<28 kg/m2)64例、肥胖组(BMI≥28 kg/m2)50例。
糖尿病诊断标准:糖尿病症状(口干、多饮、多尿、消瘦等)+任意时间血浆葡萄糖≥11.1 mmol/L,或空腹血糖水平≥7.0 mmol/L,或口服葡萄糖耐量实验(OGTT)中,餐后2 h血糖水平≥11.1 mmol/L。
1.2 检测指标及方法
测量身高、体质量,计算体质量指数(BMI)=体质量(kg)/身高(m2);测量腰围、臀围,计算腰臀比(WHR)[WHR=腰围(cm)/臀围(cm)];测量收缩压(SBP)、舒张压(DBP)。
vaspin的测定:每例另留一份血清,2 h内于3 500 r/min离心5 min,分离血清,-80 ℃保存,标本收齐后用酶联免疫吸附法(ELLSA)测定血清vaspin水平,在美国全自动多功能酶标仪上完成。血糖(FPG及PPG)采用葡萄糖氧化酶法测定;HbA1c采用比色法测定;血清C肽、空腹胰岛素(FINS)采用放射免疫分析法测定。超敏C反应蛋白(hs-CRP,采用酶联免疫吸附法测定);生化相关血脂指标包括:总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HLD-C),均在日立7600全自动生化分析仪上完成;计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FPG×FINS/22.5。
1.3 统计学分析
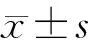
2 结果
2.1 一般资料比较
三组在性别、年龄、病程方面差异均无统计学意义(P>0.05),具有可比性。OD组BMI、WHR及SBP均高于NWD组,差异有统计学意义(P<0.01或P<0.05);OWD组BMI及WHR高于NWD组,有统计学差异(P<0.05,见表1)。
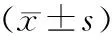
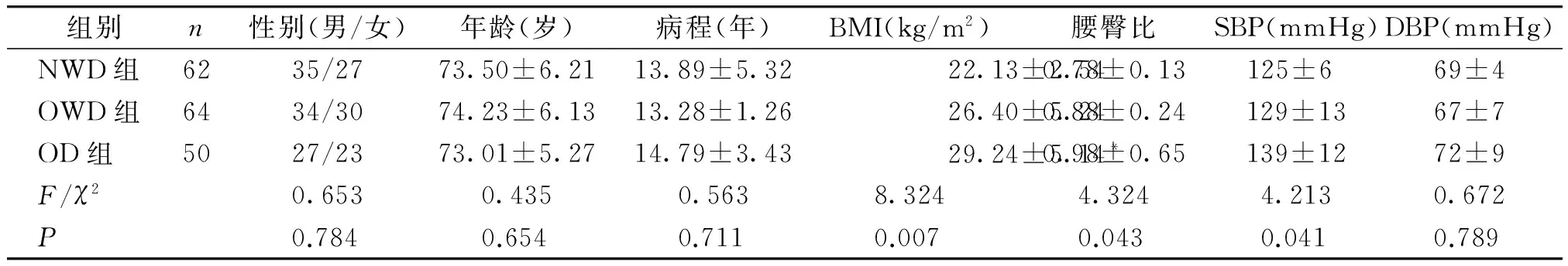
组别n性别(男/女)年龄(岁)病程(年)BMI(kg/m2)腰臀比SBP(mmHg)DBP(mmHg) NWD组6235/2773.50±6.2113.89±5.3222.13±2.540.78±0.13125±6 69±4 OWD组6434/3074.23±6.1313.28±1.2626.40±5.240.88±0.24129±1367±7 OD组5027/2373.01±5.2714.79±3.4329.24±5.14*0.98±0.65139±1272±9 F/χ20.6530.4350.5638.3244.3244.2130.672 P0.7840.6540.7110.0070.0430.0410.789
与OWD组比较,*P<0.05,与NWD组比较,P<0.05,P<0.01。
2.2 生化指标比较
FPG、HDL、TG、HOMA-IR、hsCRP分别在三组间比较,差异有统计学意义(P<0.05);经过两两比较,OD组的FPG、TG、HOMA-IR、HsCRP均高于OWD和NWD组,OD组HDL低于OWD和NWD组,有统计学差异(P<0.05),OWD和NWD组之间差异无统计学意义(P>0.05);TC、LDL-C、FINS三组间相比,均差异无统计学意义(P>0.05,见表2)。
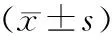
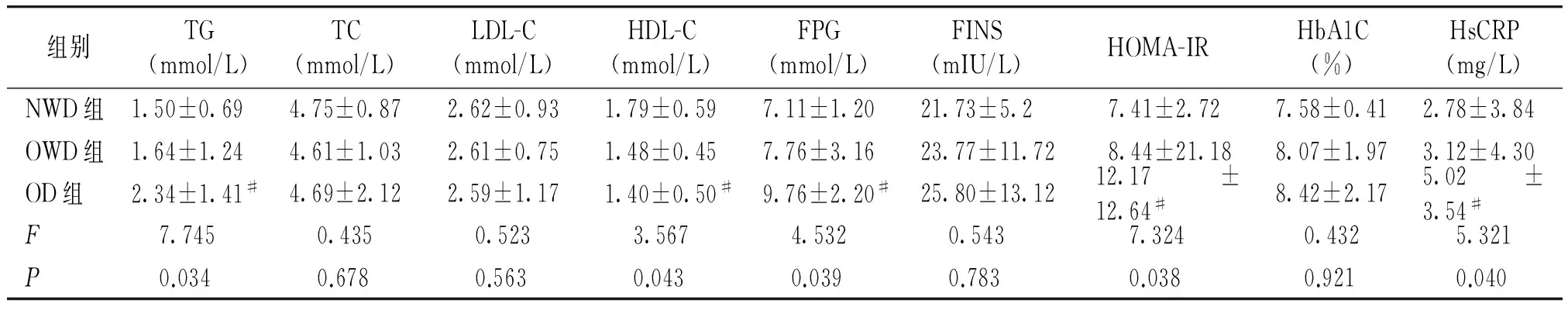
组别TG(mmol/L)TC(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)FPG(mmol/L)FINS(mIU/L)HOMA-IRHbA1C(%)HsCRP(mg/L)NWD组1.50±0.694.75±0.872.62±0.931.79±0.597.11±1.2021.73±5.2 7.41±2.727.58±0.412.78±3.84OWD组1.64±1.244.61±1.032.61±0.751.48±0.457.76±3.1623.77±11.72 8.44±21.188.07±1.973.12±4.30OD组2.34±1.41#4.69±2.122.59±1.171.40±0.50#9.76±2.20#25.80±13.1212.17±12.64#8.42±2.175.02±3.54#F7.7450.4350.5233.5674.5320.5437.3240.4325.321P0.0340.6780.5630.0430.0390.7830.0380.9210.040
与NWD组比较,*P<0.05;与OWD比较,#P<0.05
2.3 不同分组血清vaspin水平比较结果
按照BMI分组,血清vaspin在三组之间差异比较有统计学意义(P<0.05);经过两两比较,OD组的vaspin高于OWD和NWD组。而OWD和NWD之间无统计学差异。按照性别分组(男性104人,女性70人),女性血清vaspin水平明显高于男性,差异有统计学意义(P<0.05,见表3,4)。
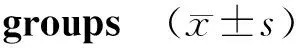

组别nvaspin(pg/ml)FP NWD组62236.04±65.413.76<0.05 OWD组64287.31±87.96 OD组50415.43±124.27#
与OWD比较,#P<0.05;与NWD组比较,P<0.05
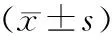


分组nvaspin(pg/ml)tP 男性96276.68±87.994.23<0.05 女性80401.12±98.73
与男性组比较,P<0.05
2.4 糖尿病患者vaspin与其他指标的相关分析
空腹血清vaspin与性别、TG、BMI、HOMA-IR为正相关(r值分别为0.855,0.857,0.880,0.776,均P<0.05),与年龄、病程、FINS、腰围、WHR、SBP、TC、LDL-C、HDL-C、FBG、HbA1C、HsCRP无相关性(见表5)。
表5糖尿病患者血清vaspin与各项指标的相关性分析
Table5PearsoncorrelationanalysisbetweenvaspinandvariousfactorsinpatientswithT2DM
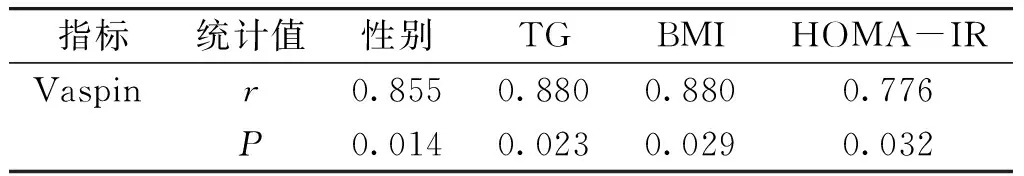
指标统计值性别TGBMIHOMA-IRVaspinr0.8550.8800.8800.776P0.0140.0230.0290.032
3 讨论
糖尿病是老年人中最常见的健康问题之一,也是世界性的问题。美国全国营养和调查的数据(2005-2006年)表明,糖尿病的患病率在老年人群中显著增加,影响了17%的65岁以上的人群。与衰老相关的糖尿病的高发病率,其主要发病机制是胰岛素抵抗和胰岛素分泌减少。生活方式因素包括减少体力活动与老龄化导致肥胖和胰岛素抵抗相互作用及年龄因素也会对胰岛素敏感性产生影响[5-7]。脂肪组织传统理念认为是一个长期的能量储存器官,现在认为它在全身各系统的代谢过程中起到了整合作用,这种作用很关键。因为许多代谢性功能部分是被脂肪组织分泌的许多种蛋白质介导的。这些由脂肪组织分泌的因子统称为脂肪细胞因子。vaspin即内脏脂肪组织来源的丝氨酸蛋白酶抑制剂。Hida等[8]实验证实,在肥胖小鼠模型中,vaspin能显著减少食物的摄入并改善高血糖。因此,在治疗肥胖和T2DM时,vaspin很可能成为一个重要工具。
目前关于vaspin与胰岛素水平、胰岛素抵抗指数(HOMA-IR)相关性的研究,有不同的结论。部分文献报道,在肥胖儿童人群中,血清vaspin水平与空腹胰岛素(FINS)及胰岛素抵抗指数(HOMA-IR)均为正相关[6]。Klöting等[7]针对超重或肥胖人群进行研究,发现vaspin mRNA在内脏或皮下脂肪组织均有表达,且在皮下脂肪组织中vaspin mRNA的表达量与空腹胰岛素(FINS)呈正相关,与胰岛素敏感性指数负相关。Youn等[8]针对正常健康人群进行的研究亦发现,校正体质量指数后血清vaspin水平与胰岛素敏感性指数负相关。也有少数文献报道[9],vaspin水平与空腹胰岛素(FINS)水平及胰岛素抵抗指数(HOMA-IR)无相关性。本实验单因素相关分析发现血清vaspin与HOMA-IR为正相关(r值分别为0.180,0.176,P<0.05),与部分文献相同。本结果提示胰岛素抵抗与高vaspin水平有关,vaspin可能代偿性地参与了胰岛素抵抗的发生。本研究单因素相关分析还发现血清vaspin与TG为正相关,说明vaspin在脂质代谢紊乱、胰岛素抵抗中均发挥了重要的作用,究其原因可能为血清vaspin水平升高使得腹内脂肪产生了FFA,而FFA又使得血脂发生异常,导致了高甘油三酯血症,FAA亦能为糖原异生提供能量,与此同时还抑制胰岛素的降解,最终呈高胰岛素血症,出现了血脂、血糖的异常。
关于在老年患者vaspin与肥胖的关系尚有一些争论,Aust等[10]和Seeger等[11]研究未发现血清vaspin与BMI之间存在相关性,本研究发现按BMI分为正常(BMI<24 kg/m2)、超重(24 kg/m2≤BMI<28 kg/m2)、肥胖(BMI≥28 kg/m2),肥胖组血清vaspin最高,超重组血清vaspin次之,正常组血清最低,肥胖组较其他组比较,差异有统计学意义。vaspin与BMI也存在相关性,这与大多数学者的研究是一致的[12-15]。考虑vaspin属于内脏脂肪分泌的细胞因子,那么对于老年群体,是采用BMI作为检测体质量是否超标的指标,还是使用WHR也存在一定的争论,毕竟老年人群以内脏肥胖为主,WHR可能更加反映出其特点,但仍需要更多大规模的老年医学研究去证明。
参考文献:
[1] Halter JB, Musi N, McFarland Horne F,etal. Diabetes and cardiovascular disease in older adults: current status and future directions[J]. Diabetes,2014,63:2578-2589.
[2]Hida K, Wada J, Eguchi J,etal.Visceral adipose tissue-derived serine protease inhibitor: a unique insulin-sensitizing adipocytokine in obesity[J].Proc Natl Acad Sci U S A,2005,102(30):10610-10615.
[3]韩丽红,滕宗艳.关于vaspin的研究进展[J].中华老年多器官疾病杂志,2014,13(9):713-716.
[4]贾爱华,徐少勇,明洁,等.我国不同诊断标准下肥胖流行病学特征分析[J].中华糖尿病杂志,2017,9(4):221-225.
[5]杨伟,华琦.衰老相关的慢性炎症与胰岛素抵抗的研究进展[J].中华老年多器官疾病杂志,2017,16(1):68-71.
[6]Choi KM. The impact of organokines on insulin resistance, inflammation,and atherosclerosis[J].Endocrinol Metab(Seoul),2016,31:1-6.
[7]Koting N,Bemdt J,Kralixch S,etal.Vaspin gene expression in human adipose tissue:association with obesity andtype 2 diabetes[J].Biochem Biohys Res Commun,2006,339(1):430-436.
[8]Youn BS, Klöting N, Kratzsch J,etal. Serum vaspin concentrations in human obesity and type 2 diabetes.[J]. Diabetes,2008,57(2):372-377.
[9]Jian W, Peng W, Xiao S,etal. Role of serum vaspin in progression of type 2 diabetes: a 2-year cohort study[J]. PLoS One, 2014,9: e94763.
[10]Aust G, Richter O, Rohm S,etal.Vaspin serum concentrations in Patients with carotidstenosis[J]. Atherosclerosis,2009,204:262-266.
[11]Seeger J, Ziegelmeier M, Bachmann A,etal. Serum levels of the adipokine vaspin in relation to metabolic andrenal parameters[J]. J Clin Endocrinol Metab, 2008, 93(1):247-251.
[12]Zhu X, Jiang Y, Shan PF,etal. Vaspin attenuates the apoptosis of human osteoblasts through ERK signaling pathway[J]. Amino Acids, 2013, 44(3): 961-968.

