红枫湖樱桃花粉超低温保存探究
宋常美, 文晓鹏, 李庆宏
(1.贵阳学院生物与环境工程学院,贵州贵阳 550003; 2.贵州大学农业生物工程重点实验室,贵州贵阳 550025;3.贵阳市农业试验中心,贵州贵阳 550003)
花粉保存是育种工作的核心内容,适宜的保存方式能延长花粉活力,利于进行异地授粉,克服花期不育等困难,进行杂交种子生产及保持单倍体基因,可有效地推动育种工作的开展,为资源创新提供有力保障。温度和湿度是影响花粉贮藏的重要因素。低温和干燥的环境下,代谢过程减弱且呼吸作用降低,能较长时间保持花粉活力,随贮藏时间的延长,花粉贮藏物质消耗过多,酶活性下降,水分过度缺乏,从而使活力下降[1-2]。低温保存可适当延长花粉寿命,但活力仍会下降,超低温可长时间保持花粉活力并避免病虫害引入,且便于资源交换[3-4]。目前,凤梨[5]、柑橘[6]、唐菖蒲[7]、椰子[8]、桃[9]和橄榄[10]等植物花粉均已成功保存。而有关樱桃,尤其是中国樱桃花粉超低温保存却未见报道。
贵州省是樱亚属植物起源中心之一[11],种质资源丰富,具有遗传改良物质基础。近些年,该省大力发展果蔬产业,樱桃被列为精品水果得以大面积发展,并引种甜樱桃,为利用其耐储存的特点,望将地方资源与其进行杂交能创造耐储存、品质优良且适合在西南大面积栽种的品种。然而,甜樱桃的花期较地方樱桃晚1个月,因此进行地方樱桃花粉长期保存研究具有一定的意义。红枫湖樱桃(PrunuspseudocerasuL.‘Hongfenghu’)是贵阳市本土种质资源,果实较大,可作为育种材料,本试验期望通过建立其花粉长期保存体系,为中国樱桃花粉长期保存提供理论参考,最终服务于育种工作。
1 材料与方法
1.1 材料
2011年2月底从贵阳市乌当区摘取即将开放的红枫湖樱桃花,随后将花药用镊子夹落在硫酸纸上自然阴干1 d,随后连同花药一起进行干燥处理。
1.2 方法
1.2.1试验设计本试验设置了液氮(-196 ℃)、-80 ℃及-20 ℃ 3种温度保存樱桃花粉。液氮保存即超低温保存,将花粉置于含硅胶的干燥器中,常温和4 ℃下干燥0、3、6、9、12 h后收集于冻存管并迅速置入液氮,1 h后用流水解冻 10 min 进行萌发率检测。-80 ℃及-20 ℃保存时将花粉置于含硅胶的干燥器,4 ℃下处理0、3、6、9、12 h后收集于冻存管,用锡箔纸包裹后放入试管盒,盒子用锡箔纸包裹后再用2个塑料袋包裹,分置于-80 ℃及-20 ℃保存12个月,干燥 3 h 的花粉每月检测1次活力,其余保存6个月后检测1次。此外,将-80 ℃及-20 ℃下保存3月后花粉取出置于含硅胶的干燥器,室温下干燥0、3、6 h/周,连续处理4周,检测保存过程中干燥时间对花粉活力的影响。每个处理含3支冻存管,即3个重复。
1.2.2花粉活力检测花粉活力检测采用离体萌发法和坐果率检测。离体萌发法检测操作如下:取适量培养基(0.1 g/L 硼酸+10%蔗糖+0.5%琼脂)在载玻片上,待凝固后用医用棉签蘸少量花粉均匀抖落在上面,随后放入垫有湿滤纸的培养皿,用保鲜膜封皿后置于恒温培养箱中培养,培养温度为25±2 ℃,8 h后统计数据。所有处理均含3个重复,每个重复培养3个载玻片,每个载玻片选3个视野计数,每个视野花粉数多于50粒。坐果率检测时将-80 ℃及-20 ℃下保存12个月的花粉进行同株授粉,同时采用当年花粉为对照,授粉时将处于铃铛期或棉花期的花朵进行连被去雄,30 d后统计坐果率。
1.3 数据统计分析
数据均采用SPSS 17.0软件分析,萌发率=萌发花粉数/花粉总数×100%(花粉管长度超过花粉粒直径作为萌发标准),坐果率=坐果数/授粉总数×100%。
2 结果与分析
2.1 干燥温度及时间对超低温保存的影响
干燥温度对花粉超低温保存的萌发率有明显影响(图1)。2种温度下干燥3 h的花粉萌发率明显高于未干燥的花粉,未干燥花粉萌发率仅63.55%,而干燥后的花粉可达到83%以上。室温下随干燥时间的延长萌发率逐渐下降,12 h降至最低(54.65%),15 h略有回升(62.57%)。然而,4 ℃下干燥的花粉萌芽率在3 h后并未随时间延长而降低。因此,为避免花粉活力下降,室温干燥时间以约3 h为宜,4 ℃下的干燥时间没有明显影响。

2.2 干燥时间及保存温度的影响
将干燥不同时间的花粉在-20 ℃及-80 ℃下保存6个月后进行活力检测,发现干燥时间无明显影响,萌发率为85%~86%(图2)。从图3可以看出,保存温度也无明显影响,-20 ℃及-80 ℃下保存的花粉萌发率无明显差异,且保存10个月前几乎无变化,随后略有下降。保存1个月后检测的花粉活力约为86%,12个月后降至约84%。因此,考虑技术及成本,-20 ℃下适合樱桃花粉较长时间保存。
2.3 保存中干燥时间的影响
为避免花粉湿度高导致萌发率下降,因此设计在保存过程中对花粉抽出进行干燥0、3、6 h/周,但发现干燥反而引起萌发率下降(表1)。-20 ℃及-80 ℃下,花粉活力均随干燥时间的延长而下降。-20 ℃下,不干燥萌芽率可一直保持85%以上,但4周后,干燥3 h和6 h的萌发率分别为67.61%和52.06%。-80 ℃下,不干燥萌芽率亦可一直保持85%以上,4周后干燥3 h和6 h的萌发率分别为61.93%和52.52%。
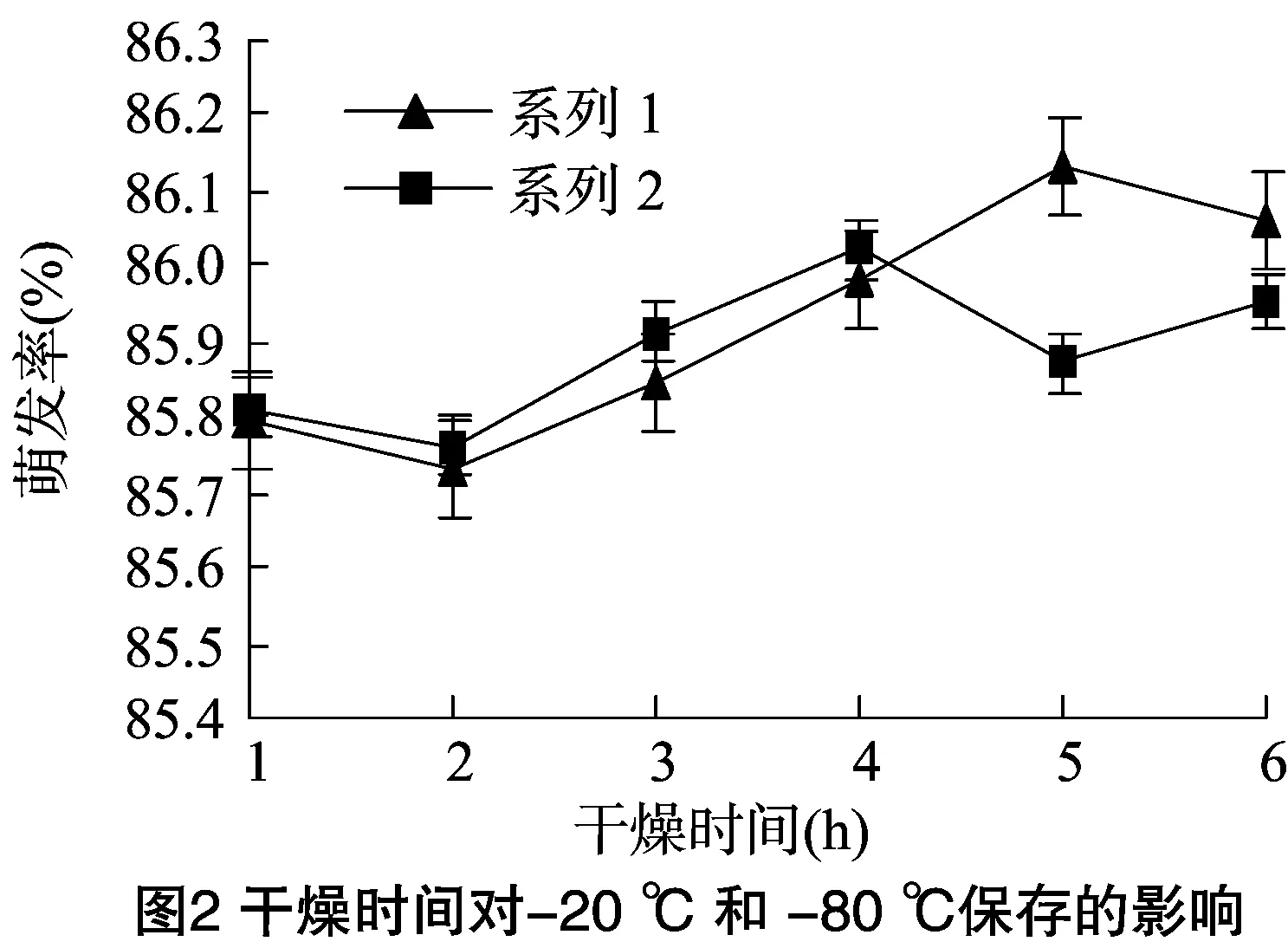


表1 保存中干燥时间对花粉萌发率的影响
注:同列数据后相同字母表示经邓肯氏多重极差检验在0.05水平上差异不显著。表2同。
2.4 坐果率检测
-20 ℃及-80 ℃下保存1年后的花粉与CK无显著差异(表2、图4),保存的花粉授粉坐果率均可达到80%左右,但三者数值以-80 ℃最高(87.17%),其次为CK(84.75%)、-20℃(78.68%)。由此可见,-20 ℃及-80 ℃下保存1年后的花粉可用于授粉。

表2 保存温度对坐果率的影响
3 讨论
Towill认为超低温保存效果取决于花粉的干燥度,适宜的干燥方式和干燥时间对花粉储藏有较大影响[12]。许多植物用硅胶干燥4 h为好[13-15]。Barnabas认为含水量对花粉的超低温保存影响很大,但过分干燥不行[16-17]。干燥后的辣椒花粉进行超低温(-196 ℃)贮藏1年仍具有新鲜花粉一半活力,但未干燥几乎无有效储藏期[18]。本试验对干燥温度和时间进行了探讨,发现室温干燥3 h后可获得较高萌发率,干燥时间过长则萌发率下降,12 h后急剧下降。然而,本试验在-196 ℃、-20 ℃和-80 ℃下保存时均发现,4 ℃下干燥时间长短无影响,且试验中还发现部分花粉受潮成团的现象。本试验同时发现,将保存在-20 ℃和-80 ℃下的花粉取出,于室温干燥0、3、6 h后获得的结果不一样,干燥3 h或6 h花粉活力下降,尤其以6 h下降更快。这也许说明干燥时的温度对花粉保存的影响大于含水量。究其原因,可能有3点:一是花粉在4 ℃干燥时已经历低温锻炼,同时在放入-20 ℃和 -80 ℃ 时具有多层包裹物,一定程度上降低了低温的刺激,从而更利于适应环境变化。陶丽等在4 ℃、25 ℃及-80 ℃下储藏澳洲坚果花粉,发现-80 ℃最差,认为与保存前未干燥处理有关,这也说明干燥时的低温锻炼对花粉活力有一定影响[19]。二是室温干燥时温度较高,花粉失活较快。杨帆等采用自然干燥、干燥皿干燥、40 ℃烘箱干燥3种方式干燥澳洲坚果花粉,并在4 ℃保存,结果表明前2种方式下花粉萌发率极显著高于后者[20]。三是花粉经历反复的解冻和冷冻,细胞易受伤害导致活力下降。这与吕晋慧等在地被菊花粉保存上的观点[21]一致。综上,本试验认为,樱桃花粉干燥时的温度比含水量的影响更大,低温干燥可避免花粉活力在储存前快速下降。

花粉是否具有活力最有利的证据为是否能授粉,某些花粉经低温保存后,出现离体萌发率低而授粉能力强的现象[22]。这种现象可能是因为低温保存后的花粉对萌发培养基不敏感[23-24],保存后的花粉萌发率达到10%~30%就能授粉坐果[25-26]。本试验中,储存于-20 ℃和-80 ℃下的花粉萌发率均在85%左右,授粉率与新鲜花粉相比无显著差异,甚至数值上-80 ℃储藏花粉高于新鲜花粉。矮牡丹经超低温保存后出现花粉萌发率明显升高的“冷刺激”现象[1]。魔芋[27]和山龙眼属[28]花粉超低温保存中均发现此现象,但该现象出现的机制目前尚不清楚。玫瑰花粉经液氮超低温保存后的授粉能力与新鲜花粉也没有区别[29]。Parton等将保存于-80 ℃下6个月的蜻蜓凤梨花粉进行授粉,授粉能力并未下降,而虎纹凤梨却被发现其授粉能力不如新鲜花粉[30]。飞燕草花粉储存在25 ℃下60 d便没有授粉能力,而-30 ℃下180 d后授粉能力高于新鲜花粉[31]。总体而言,-20 ℃便可进行樱桃花粉长期保存。
本试验储藏花粉是同花药一起保存的,与仅保存花粉的方法有差异,但也获得了较好的效果,这样使得操作更简便,且提高花粉利用率。这种方法在杜鹃红山茶花[32]和桂花[33]上亦用到。
参考文献:
[1]贾文庆,张少伟,刘露颖,等. 不同培养基和贮藏方法对矮牡丹花粉萌发的影响[J]. 西南农业学报,2013,26(1):338-341.
[2]韩成刚,盖树鹏. 不同条件下芍药花粉的贮藏寿命[J]. 种子,2012,31(3):87-89.
[3]胡晋,郭长根. 超低温(-196 ℃)保存杂交水稻恢复系划分的研究[J]. 作物学报,1996,22(1):72-77.
[4]殷晓辉,舒理慧. 植物种资资源的超低温保存研究进展[J]. 热带亚热带植物学报,1996,4(3):75-82.
[5]Parton E,Vervaeke I,Delen R,et al. Viability and storage of bromeliad pollen[J]. Euphytica,2002,125(2):155-161.
[6]Kundu M,Dubey A,Srivastav M,et al. Effect of gamma ray irradiation and cryopreservation on pollen stainability,invitrogermination,and fruit set inCitrus[J]. Turkish Journal of Biology,2014,9(38):1-9.
[7]Geng X M,Qiu J Y,Okubo H S . Changes of carbohydrate content duringLiliumandGladioluspollen cryopreservation[J]. Grana,2013,52(3):202-206.
[8]Machado C D A,Moura C R F,Lemos E E P D,et al. Pollen grain viability of coconut accessions at low temperatures[J]. Acta Scientiarum Agronomy,2014,36(2):227-232.
[9]宋常美,李庆宏. 艳红桃花粉离体萌发及超低温保存探究[J]. 种子,2015,34(11):91-93,99.
[10]Alba V,Bisignano V,Alba E,et al. Effects of cryopreservation on germinability of olive (OleaeuropaeaL.) pollen[J]. Genet Resour Crop Evol,2011(58):977-982.
[11]曹东伟. 李属樱亚属植物分子亲缘地理学研究[D]. 西安:西北大学,2006.
[12]Towill L E. Low temperature and freeze-/vacuum-drying presevation of pollen[M]//Cryopreservation of plant cells and organs. Boca Raton:CRC Press,1985.
[13]Yates I E,Sparks D. Hydration and temperature inuenceinvitrogermination of pecan pollen[J]. J Amer Soc Hort Sci,1989,114(4):599-605.
[14]Parton E,Vervaeke I,Delen R,et al.Viability and storage of bromeliad pollen[J]. Euphytica,2002,125(2):155-161.
[15]Hughes H G,Lee C W. Low temperature preservation ofClianthusformosuspollen[J]. Hortscience,1991,26(11):1411-1412.
[16]Barnabas B. Freeze preservation of pollen[J]. Les Colloques de I′INRA,1983(21):429-433.
[17]Barnabas B,Rajki E. Storage of maize (ZeamaysL.) pollen at -196 ℃ in liquid nitrogen[J]. Euphytica,1976,25(1):747-752.
[18]张保才,李晓丹,崔鸿文,等. 不同贮藏方式对辣椒花粉生活力及授粉效果的影响[J]. 西北农业学报,2013,22(7):132-137.
[19]陶丽,倪书邦,贺熙勇,等. 不同贮藏方式对澳洲坚果花粉萌发率的影响[J]. 中国南方果树,2010,39(3):52-54.
[20]杨帆,陶丽,陈丽兰,等. 澳洲坚果花粉保存及生活力测定[J]. 中国农学通报,2014,30(13):126-130.
[21]吕晋慧,赵耀,王媛,等. 地被菊花粉活力和储藏性研究[J]. 园艺学报,2012,39(12):2483-2490.
[22]Honda K,Watanabe H,Tsutsui K. Cryopreservation of Delphinium pollen at -30 ℃[J]. Euphytica,2002,126(3):315-320.
[23]Stanley R G,Linskens H F. Pollen:biology,biochemistry and management[M]. New York:Springer Berlin Heidelberg,1974.
[24]Shivanna K R,Johri B M. The Angiosperm pollen:Structure and function[M]. New Delhi,India:Wiley Eastern Ltd.,1985.
[25]Nath J,Anderson J O. Effect of freezing and freeze-drying on the viability and storage ofLiliumlongioraandZeamaysL. pollen[J]. Cryobiology,1975,12(1):81-88.
[26]Layne R E C,Hagedorn D J. Effect of vacuum-drying,freeze-drying and storage environment on the viability of pea pollen[J]. Crop Science,1963,3(5):433-436.
[27]张玉进,张兴国,刘佩瑛. 魔芋花粉的低温和超低温保存[J]. 园艺学报,2000,27(2):139-140.
[28]Van Der Walt I D,Littlejohn G M. Storage and viability testing of protea pollen[J]. J Amer Soc Hort Sci,1996,121(5):804-809.
[29]Marchant R,Power J B,Davey M R,et al. Cryopreservation of pollen from two rose cultivars[J]. Euphytica,1993,66(3):235-241.
[30]Parton E,Vervaeke I,Delen R,et al. Viability and storage of bromeliad pollen[J]. Euphytica,2002,125(2):155-161.
[31]Honda K,Watanabe H,Tsutsui K. Cryopreservation ofDelphiniumpollen at -30 ℃[J]. Euphytica,2002,126(3):315-320.
[32]刘玉玲,潘文,张方秋,等. 杜鹃红山茶花粉保存及其生活力测定[J]. 广东林业科技,2010,26(2):1-6.
[33]张洪伟,段一凡,李稚,等. 不同贮藏方法对桂花花粉活力影响的研究[J]. 南京林业大学学报(自然科学版),2014,38(增刊1):7-12.

