戈壁异常球菌Dgl5蛋白生物学功能研究
张亨 刘盈盈 陈云 平淑珍 王劲
(1. 西南科技大学生命科学与工程学院,绵阳 621000;2. 中国农业科学院生物技术研究所,北京 100081)
高盐、低温等环境因素会导致细胞内水分的大量流失,严重影响生物体正常的生长代谢。自然界中很多生物通过调节胁迫应答基因的表达量来减弱这类非生物胁迫的影响[1]。植物胚胎发育晚期丰富蛋白(Late embryogenesis abundant,LEA)在响应非生物胁迫中起重要作用[2-4],通常以分子伴侣的形式保护细胞内生物大分子不受损伤[5-7]。Battaglia等[8]根据LEA蛋白保守氨基酸序列及亲疏水性将其分为7个家族。其中LEA1、2、3、4、6、7家族蛋白都是典型的亲水蛋白,在天然状态下都具有重复的保守基序(motifs)且高度亲水。而LEA5家族蛋白缺少明显的motifs而且具有较高的疏水特性[9]。LEA5进一步又可以分为5A(SMP)、5B(LEA_3)、5C(LEA_2)3个亚类。其中LEA5C亚类因含有一个“WHy(Water Stress and Hypersensitive response,WHy)”结构域而备受关注[10]。LEA5C蛋白最早发现于植物中,且研究工作集中在序列比较、性质预测、分子鉴定、异源表达等方面。已有研究表明来源于植物的LEA5C与生物体逆境胁迫相关,具有类似分子伴侣的功能[11]。如He等[9]将水稻的LEA5C家族蛋白OsLEA5在大肠杆菌中过量表达,发现其能提高大肠杆菌对高盐和冷冻等胁迫的抗性;体外实验显示,在反复冻融处理条件下OsLEA5蛋白能够保护乳酸脱氢酶(LDH)活性。到目前为止,除大部分植物来源的LEA5C蛋白外,在细菌和古细菌中也发现了该类蛋白的存在[12]。但关于细菌和古细菌来源的LEA5C蛋白的功能研究大部分是对宿主的抗逆表型进行分析,其抵抗非生物胁迫的分子机理报道较少,与植物来源的LEA5C蛋白是否一样拥有类似分子伴侣的功能有待研究。
耐辐射微生物对氧化、高盐和UV射线等具有极强抗性,能在高温、严寒及干燥等极端逆境下生存,具有非凡的适应机制以抵抗极端环境造成的损伤[13]。已有研究报道,来自耐辐射异常球菌(Deinococcus radioduransR1) 的 LEA5C家 族蛋白DrwH可以通过保护苹果酸脱氢酶(Malate dehydrogenase,MDH) 及 乳 酸 脱 氢 酶(Lactate dehydrogenase,LDH)的活性并且能够增强大肠杆菌氧化胁迫抗性[14]。本研究室从新疆戈壁极端环境分离到一株耐辐射细菌-戈壁异常球菌(Deinococcus gobiensisI-0)[15]。 基 因 组 序 列 分 析 显 示 该 菌 中Dgo_CA1605基因编码的蛋白与LEA5C家族蛋白序列具有相似性,为此本研究将该蛋白命名为Dgl5(Deinococcus gobiensisLEA5C protein,Dgl5)。本研究通过构建Dgl5蛋白表达载体,进行外源表达与纯化,探索非生物胁迫下Dgl5蛋白对大肠杆菌生长的影响,并在体外逆境条件下测定Dgl5对MDH和LDH酶活的保护作用,为了解耐辐射戈壁异常球菌极端抗性机制及LEA5C蛋白的分子机理奠定良好的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株质粒和培养条件 野生型戈壁异常球菌(Deinococcus gobiensisI-0)为本实验室保存;高频转化受体菌大肠杆菌Escherichia coliTop10及表达菌株E. coliBL21(DE3)购自北京全式金生物技术有限公司;质粒 pET28a 及pGEX4T-2由本实验室保存。大肠杆菌于 LB 培养基(1% Typtone,0.5% Yeast extract,1% NaCl,pH 7.0,固体培养基含 1.5%琼脂)中37℃条件下培养。
1.1.2 主要试剂 限制性内切酶、BSA购于 New England Biolabs 公司;细菌基因组提取试剂盒、常规质粒提取试剂盒及胶回收纯化试剂盒购自 Magen公司;MDH、LDH、草酰乙酸、NADH购于Sigma Aldrich公司;无缝克隆试剂盒购自北京中美泰和生物技术有限公司;其他生化试剂均为分析纯。引物合成和基因测序均由华大基因完成。
1.2 方法
1.2.1 Dgl5蛋白生物信息学分析 从NCBI中获取戈壁异常球菌基因Dgo_CA1605的序列及所编蛋白的氨基酸序列信息。利用Protparam(http://web.expasy.org/protparam/)在线预测Dgl5蛋白的分子质量、等电点、总平均亲水指数及各种氨基酸含量等基本性质;利用Protscale(http://web.expasy.org/protscale/),结合Kyte等总结出的氨基酸疏水指数,进行Dgl5蛋白亲疏水性分析;利用Cspritz(http://protein.bio.unipd.it/cspritz/)对蛋白进行无序特征预测;利 用 SMART(http://smart.embl.de/smart/set_mode.cgi?NORMAL=1)对蛋白质结构域进行分析。利用DNAMAN进行多序列比对并构建进化树。
1.2.2 重组E. coli菌株的构建 从NCBI中获取Dgo_CA1605的序列。根据同源重组的方法设计引 物 F1(5'-3'):CAGCAAATGG GTCGCGGATC CATGCAGGTG CCCACCGTGC A ;R1(5'-3'):TCGAGTGCGG CCGCAAGCTT GTCAGAAGGG CAGGATGGCC GC,并由华大基因有限公司合成。以D. gobiensisI-0基因组DNA为模板,使用F1/R1引物扩增目的片段,扩增产物长度为465 bp。PCR反应条件是:95℃预变性5 min;95℃变性 30 s,65℃退火30 s,72℃延伸30 s,30个循环;72℃延伸5 min。同时用BamH I和Hind III 37℃酶切pET28a质粒2 h。琼脂糖凝胶电泳确定片段及酶切产物正确后回收。用无缝克隆试剂50℃连接20 min,之后将连接产物转化E. coliTop10,在含有50 μg/mL Kan的LB平板上筛选,获得阳性转化子并测序。提取测序正确的重组质粒,转化表达菌株BL21(DE3)获得重组菌株 BL21(pET28a-Dgl5)。同样的方法构建重组菌株BL21(pGEX4T-2-Dgl5),用于表达含有GST-tag的融合蛋白GST-Dgl5。引物如下:
F2(5'-3'):CTGTTCCAGG GGCCCCATAT GATGCAGGTG CCCACCGTGC A;
R2(5'-3'):ATGATGATGA TGATGCTCGA GTCAGAAGGG CAGGATGGCC GC。
1.2.3 重组E. coli菌株非生物胁迫实验 将实验的重组菌株及对照菌株在LB平板上分别划线过夜培养,从活化的平板上分别挑取单菌落于5 mL新鲜的液体LB培养基(50 μg/mL Kan)中37℃过夜培养,按初始OD600为0.1分别接种于20 mL新鲜的液体LB 培养基中(50 μg/mL Kan),培养 30 min 后加入终浓度为0.1 mmol/L IPTG 于培养基中,连续培养至菌液OD600约为0.6,分别取出1 mL菌液进行如下胁迫处理:(1)盐胁迫:将上述1 mL菌液进行10倍梯度稀释(10-1-10-5),每个稀释度各取6 μL点在含有500 mmol/L NaCl的固体LB培养基表面,经37℃培养约48 h左右,观察菌落形成情况。(2)冷冻胁迫:将上述1 mL菌液进行反复冻融处理(-80℃冷冻20 min 室温融化20 min为一次反复冻融循环),处理后立即进行10倍梯度稀释(10-1-10-5),每个稀释度各取6 μL点在固体LB培养基表面,经37℃培养约16 h左右,观察菌落形成情况。(3)氧化胁迫:将上述1 mL菌液中分别加入终浓度为20 mmol/L 30% H2O2,处理15 min后立即进行10倍梯度稀释(10-1-10-5),每个稀释度各取10 μL点在固体LB培养基表面,经37℃培养约16 h左右,观察菌落形成情况。上述胁迫实验分别进行3次独立实验,确定菌株的非生物胁迫表型。
1.2.4 Dgl5蛋白表达与纯化 将重组菌株E. coli菌株(E. colipGEX4T-2-Dgl5/BL21)活化后挑取单菌落于20 mL新鲜的液体LB培养基(50 μg/mL Amp)中37℃过夜培养,之后按初始OD600为0.1接种于1 000 mL含Amp的新鲜LB液体培养基中,37℃培养至菌液OD600约为0.6,加入终浓度为0.1 mmol/L的IPTG,16℃连续培养15 h。6 000 r/min离心8 min收集菌体,用30 mL裂解Buffer(140 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,1.8 mmol/L K2HPO4,pH 7.3)重悬菌体,超声破碎细胞,14 000 r/min、50 min离心收集上清。将上清倒入用裂解Buffer平衡好的亲和层析柱中,并用裂解Buffer洗去杂蛋白,最终用洗脱Buffer(50 mmol/L Tris-HCl,10 mmol/L 谷胱甘肽还原酶,pH 8.0)洗脱目的蛋白。SDS-PAGE检测蛋白纯化情况,并采用Brandford法测定蛋白浓度。
1.2.5 液氮反复冻融胁迫条件下MDH和LDH酶活测定 本实验通过检测A340变化评估MDH与LDH活性。所用缓冲液如下:MDH酶溶解液(50 mmol/L 磷酸钾缓冲液,pH 7.2),MDH反应液(0.2 mmol/L草酰乙酸、0.2 mmol/L NADH、150 mmol/L磷酸钾缓冲液,pH 7.5);LDH酶溶解液(25 mmol/L Tris-HCl,pH7.2),LDH 反 应 液(100 mmol/L KCl、2 mmol/L 丙酮酸钠、0.15 mmol/L NADH、25 mmol/L Tris-HCl,pH7.5)。为测定Dgl5蛋白在液氮反复冻融条件下对MDH和LDH酶活性的保护作用,按照MDH与蛋白1∶2.5的摩尔比;LDH与蛋白1∶2的摩尔比混合样品,以GST蛋白作为参照,牛血清蛋白(BSA)和磷酸缓冲液分别作为阳性和阴性对照。MDH样品混合体系如表1。将混合体系进行液氮反复冻融处理(液氮处理1 min后室温孵育20 min为1个循环)两次,取每次处理后的样品10 μL混匀到600 μL对应的反应液中,测定反应起始1 min内A340酶活性变化。每个实验重复3次。
2 结果
2.1 生物信息学分析
戈壁异常球菌基因组数据分析显示,Dgo_CA 1605定位于D. gobiensisI-0基因组染色体上,Dgl5(AFD25532)由140个氨基酸组成,分子量为14.5 kD,富含Leu(12.9%)、Ala(11.4%)、Val(12.1%)、Pro(8.6%)等疏水性氨基酸。Kyte-Doolittle亲疏水图(图1-A)表明该蛋白是一类疏水蛋白。Cspritz显示该蛋白为有序结构(图1-B)。氨基酸序列比对(图1-C)显示,Dgo_CA1605蛋白含有一个WHy结构域,推测该蛋白属于LEA5C蛋白家族。利用SMART软件在线预测Dgl5的结构域,结果显示,Dgl5含有由123个氨基酸残基组成的WHy结构域,该结构域含有典型的“NPN”保守位点,与LEA5C蛋白家族WHy结构域类似。综上所述,Dgl5为疏水蛋白,含有一个典型的WHy结构域,属于LEA5C蛋白家族。

表1 MDH酶活测定样品混合体系

图1 Dgl5序列分析,亲疏水性及无序结构预测
为研究Dgl5蛋白与LEA家族蛋白的进化关系,本研究选取了24种LEA蛋白,构建了系统发育树。黑色箭头所指为Dgl5蛋白。结果(图 2-A)显示,系统发育树总体分为两大支。其中一支均为LEA5C家族蛋白,分别来源于植物、古菌和细菌。其中,Dgl5与来源于Deinococcus属其他细菌的同源蛋白关系最近,与Deinococcus radiodurans中的DrwH蛋白处于同一进化分支。同时通过Blast分析,与Dgl5蛋白同源性较高的蛋白均属与Deinococcus属(图 2-B红框内),说明Dgl5蛋白是Deinococcus属特异性蛋白。另一支包含植物LEA1、2、3、4、6和7家族蛋白,该分支蛋白均为亲水蛋白。可见LEA5C家族蛋白与典型的LEA家族蛋白不同。
2.2 重组大肠杆菌非生物胁迫实验
已有研究表明LAE5C蛋白与逆境胁迫抗性相关。为了研究Dgl5的功能,本研究对重组E. coli菌株(E. colipET28a-Dgl5/BL21,BL21-1)及仅含空载体pET28a的大肠杆菌(E. colipET28a/BL21,BL21-0)分别进行高盐、反复冻融及氧化胁迫处理。结果(图3)显示,正常条件下表达Dgl5蛋白的重组菌株BL21-1与对照菌株BL21-0生长没有差异。在培养基中添加500 mmol/L NaCl后,所有菌株的生长速率减慢,与对照菌株BL21-0相比,表达Dgl5蛋白的重组菌株BL21-1的生存能力提高了近一个数量级。对于反复冻融,经反复冻融2次后,生长趋势与NaCl冲击结果类似。而在20 mmol/L H2O2冲击条件下虽然两个菌株生长状况下降但两者并没有明显差异。以上结果表明,Dgl5可以提高大肠杆菌抗盐及抗冷冻的能力,可能参与了高盐和冷冻胁迫反应。
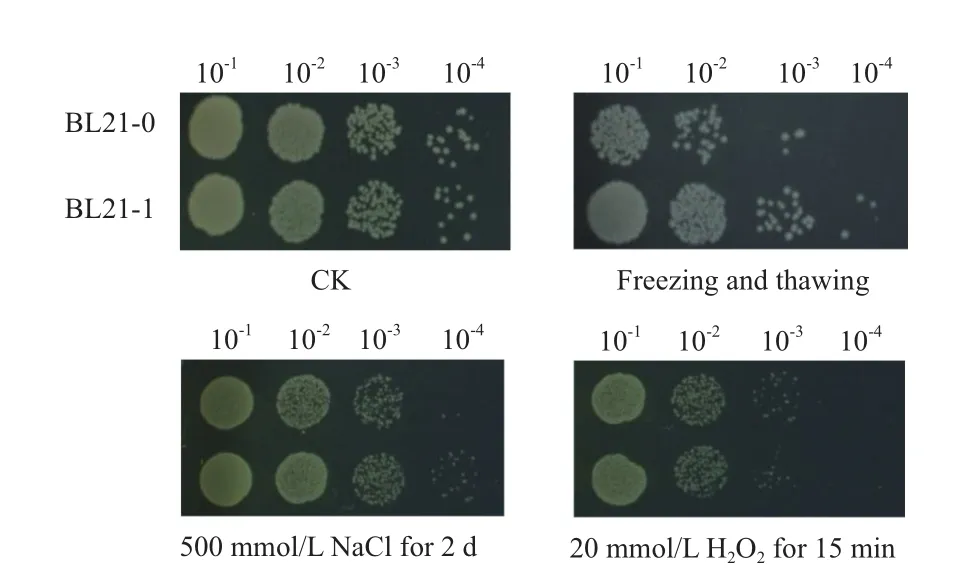
图 3 表达Dgl5蛋白重组菌株的表型分析
2.3 Dgl5蛋白的表达纯化
本研究表达了带有GST-tag的Dgl5蛋白用于体外实验。对GST-Dgl5蛋白进行诱导表达,经亲和层析过柱纯化,获得纯化后的蛋白。SDS-PAGE分析结果(图4)显示,以仅含空载体pGEX4T-2的大肠杆菌及未诱导的表达Dgl5蛋白的重组菌BL21(pGEX4T-2-Dgl5)为空白对照,0.2 mmol/L IPTG诱导下出现与融合蛋白GST-Dgl5大小(40.5 kD)吻合的条带。用裂解Buffer洗去杂蛋白,之后用含有10 mmol/L 谷胱甘肽还原酶的洗脱Buffer获得较高纯度的目标融合蛋白GST-Dgl5,收集洗脱液,用Brandford法测定其浓度为0.84 mg/mL,-80℃保存。
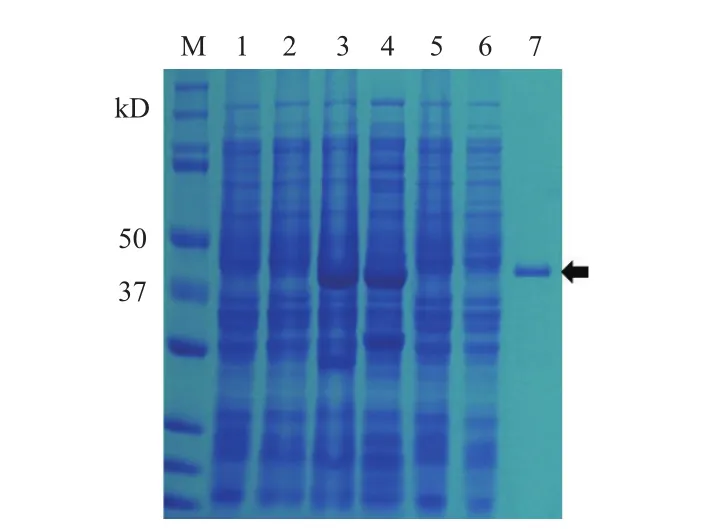
图4 GST-tag的Dgl5蛋白纯化
2.4 液氮反复冻融条件下Dgl5蛋白对MDH和LDH活性的保护
结果如图5(将未胁迫样品的酶活视为100%),MDH酶活随反复冻融次数的增加而减少。反复冻融一次后MDH的酶活为80%,反复冻融两次后损失更严重,MDH的酶活仅有50%;而添加Dgl5蛋白后明显降低了MDH酶活性的损失,MDH活性仍保留90%和70%以上。Dgl5对LDH 在反复冻融下的保护作用与 MDH 结果类似。BSA同样对MDH和LDH有保护作用,但保护作用低于Dgl5蛋白。另外,GST对MDH和LDH也有保护作用,但是非常微弱。其功能明显低于Dgl5及BSA蛋白。
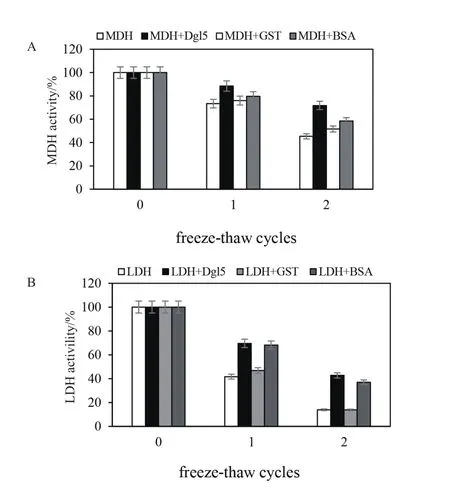
图 5 反复冻融条件下Dgl5对MDH(A)和LDH(B)的保护
3 讨论
LEA5C蛋白具有高度疏水性,较低的序列重复性、高比例的非极性氨基酸及热稳定性较差等特性。本研究通过生物信息学分析发现Dgl5蛋白是一个14.5 kD的小分子蛋白,疏水性氨基酸占总氨基酸的45%,Kyte-Doolittle亲疏水图表明该蛋白属于疏水性LEA5C蛋白。根据BLAST显示,Dgl5与Deinococcus属蛋白亲缘关系最近且与同属蛋白具有较高的序列相似性,是一个Deinococcus属特异性蛋白。Deinococcus属微生物可以在极端环境中生存,其拥有非凡的适应机制以抵抗极端环境造成的损伤。Dgl5来自戈壁异常球菌,是分离于戈壁沙漠的Deinococcus属细菌。为适应沙漠干旱、冷和热等环境,戈壁异常球菌进化得到了一类能在极端环境下发挥功能的蛋白。关于Dgl5的分析显示其属于LEA5C蛋白,一类与胁迫相关的疏水蛋白,可能对戈壁异常球菌适应极端环境有重要作用。
目前为止,有关LEA5C蛋白研究工作集中在序列比较、性质预测、分子鉴定、异源表达等方面,研究表明这些蛋白在干旱、盐、高低温、渗透等胁迫条件下大量积累且能提高宿主细胞抵抗非生物胁迫的能力。如Liu等[17]在玉米中鉴定了LEA5C蛋白(ZmLEA5C),编码该蛋白的基因受低温、渗透、氧化以及信号分子的诱导,在烟草和酵母中表达,能够增强细胞耐受渗透和低温胁迫的能力;Wu和Wang等[18-19]于2014和2016年分别鉴定了来源丹参的LEA5C蛋白(SmLEA和SmLEA2),在大肠杆菌中过量表达能够显著提高宿主对干旱和盐胁迫的抗性。而本研究中,Dgl5在大肠杆菌中异源表达能够增强大肠杆菌抵抗高盐和冷冻胁迫的能力。这些结果表明不同细菌来源的LEA5C蛋白有不同的生物学功能,但其本质都与细胞内水分胁迫抗性密切相关,造成功能差异的原因可能是其各自适应极端环境的结果。
LEA5C蛋白与典型的亲水LEA家族蛋白不同,是疏水蛋白,进化关系上也明显处于两个分支。关于细菌LEA5C基因的由来目前被广泛认可的说法是“水平转移”[12],即细菌通过整合植物防御基因到自己的防御系统中或干扰宿主的信号途径以应对胁迫环境。大量研究表明,LEA蛋白具有类似分子伴侣的活性,能够防止胁迫条件下底物蛋白的聚合。Dgl5为LEA5C蛋白,推测其发挥功能的原因是作为分子伴侣保护酶或蛋白免受非生物胁迫的损伤。因此,本研究表达了GST-Dgl5融合蛋白用于体外实验。体外实验选用MDH和LDH作为模式酶评估反复冻融条件下GST-Dgl5对底物酶的保护作用。苹果酸脱氢酶(MDH)是TCA循环途径的重要酶之一,催化的反应是:苹果酸+NAD+草酰乙酸+NADH+H+。乳酸脱氢酶(LDH)是糖酵解途径的关键酶,催化的反应是:丙酮酸+NADH+H+乳酸+NAD+。NADH、NAD+分别在340 nm和260 nm波长处有最大吸收峰。因此可以通过检测A340变化评估MDH与LDH活性。本研究结果显示Dgl5蛋白在反复冻融条件下可以保护MDH和LDH酶活,说明Dgl5蛋白有类似分子伴侣的功能。但具体的分子机制仍不清晰,根据已有研究报道,具有类似分子伴侣活性的非典型LEA蛋白可以利用其疏水特性使已聚合的蛋白发生解聚[20]。本研究认为Dgl5蛋白有类似的疏水机制稳定底物蛋白,但仍需要大量的实验证明。
4 结论
本研究确定了戈壁异常球菌(D. gobiensisI-0)中Dgo_CA1605基因编码的蛋白属于LEA5C家族蛋白,命名为Dgl5。成功构建了表达Dgl5蛋白的重组菌株E. colipET28a-Dgl5/BL21,非生物胁迫实验表明该蛋白能增强大肠杆菌抵抗高盐及冷冻胁迫的能力。表达纯化了融合蛋白GST-Dgl5并进行了体外酶活保护实验。结果表明Dgl5蛋白在反复冻融条件下可以保护MDH和LDH酶活,推测Dgl5蛋白可能具有类似分子伴侣的功能。
[1]Pearce RS. Molecular analysis of acclimation to cold[J]. Plant Growth Regulation, 1999, 29(1-2):47-76.
[2]Artus NN, Uemura M, Steponkus PL, et al. Constitutive expression of the cold-regulatedArabidopsis thalianaCOR15a gene affects both chloroplast and protoplast freezing tolerance[J]. Proc Nat Acad Sci, 1996, 93(23):13404-13409.
[3]Thomashow MF. Plant cold acclimation:freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Biology,1999, 50(1):571-599.
[4]Goyal K, Walton LJ, Tunnacliffe A. LEA proteins prevent protein aggregation due to water stress[J]. Biochemical Journal, 2005,388(1):151-157.
[5]Reyes JL, Rodrigo MJ, Colmenero-Flores JM, et al. Hydrophilins from distant organisms can protect enzymatic activities from water limitation effectsin vitro[J]. Plant, Cell & Environment, 2005, 28(6):709-718.
[6]Chakrabortee S, Meersman F, Schierle G S K, et al. Catalytic and chaperone-like functions in an intrinsically disordered protein associated with desiccation tolerance[J]. Proc Nat Acad Sci,2010, 107(37):16084-16089.
[7]Kanuru M, Aradhyam GK. Chaperone-like activity of calnuc prevents amyloid aggregation[J]. Biochemistry, 2017, 56(1):149-159.
[8]Battaglia M, Olvera-Carrillo Y, Garciarrubio A, et al. The enigmatic LEA proteins and other hydrophilins[J]. Plant Physiol, 2008, 148(1):6-24.
[9]He S, Tan L, Hu Z, et al. Molecular characterization and functional analysis by heterologous expression inE. coliunder diverse abiotic stresses for OsLEA5, the atypical hydrophobic LEA protein fromOryza sativaL.[J]. Mol Gene Genomics, 2012, 287(1):39-54.
[10]Jaspard E, Hunault G. Comparison of amino acids physico-chemical properties and usage of late embryogenesis abundant proteins,hydrophilins and WHy domain[J]. PLoS One, 2014, 9(10):e109570.
[11]Dang NX, Popova AV, Hundertmark M, et al. Functional characterization of selected LEA proteins fromArabidopsis thalianain yeast andin vitro[J]. Planta, 2014, 240(2):325-336.
[12]Ciccarelli FD, Bork P. The WHy domain mediates the response to desiccation in plants and bacteria[J]. Bioinformatics, 2004, 21(8):1304-1307.
[13]Makarova KS, Aravind L, Wolf YI, et al. Genome of the extremely radiation-resistant bacteriumDeinococcus radioduransviewed from the perspective of comparative genomics[J]. Microbiology and Molecular Biology Reviews, 2001, 65(1):44-79.
[14]Jiang S, Wang J, Liu X, et al. DrwH, a novel WHy domaincontaining hydrophobic LEA5C protein fromDeinococcus radiodurans, protects enzymatic activity under oxidative stress[J]. Scientific Reports, 2017, 7(1):9281.
[15]Yuan M, Zhang W, Dai S, et al.Deinococcus gobiensissp. nov.,an extremely radiation-resistant bacterium[J]. Int J Syst Evol Microbiol, 2009, 59(6):1513-1517.
[16]Dahl JU, Koldewey P, Salmon L, et al. HdeB functions as an acidprotective chaperone in bacteria[J]. J Biol Chem, 2015, 290(1):65-75.
[17]Liu Y, Wang L, Jiang S, et al. Group 5 LEA protein, ZmLEA5C,enhance tolerance to osmotic and low temperature stresses in transgenic tobacco and yeast[J]. Plant Physiology and Biochemistry, 2014, 84:22-31.
[18]Wu Y, Liu C, Kuang J, et al. Overexpression of SmLEA enhances salt and drought tolerance inEscherichia coliandSalvia miltiorrhiza[J]. Protoplasma, 2014, 251(5):1191-1199.
[19]Wang H, Wu Y, Yang X, et al. SmLEA2, a gene for late embryogenesis abundant protein isolated fromSalvia miltiorrhiza,confers tolerance to drought and salt stress inEscherichia coliandS.miltiorrhiza[J]. Protoplasma, 2017, 254(2):685-696.
[20]Haaning S, Radutoiu S, Hoffmann S V, et al. An unusual intrinsically disordered protein from the model legumeLotus japonicusstabilizes proteinsin vitro[J]. J Biol Chem, 2008, 283(45):31142-31152.

