患者全面主观营养评定和营养风险筛查2002在消化系统肿瘤患者营养评估中的应用比较
林 丽,张吉才,谢 飞,彭 峰,黄小明
(1十堰市太和医院检验科,湖北十堰 442000;2十堰市太和医院肿瘤科,湖北十堰 442000;3西南医科大学公共卫生学院营养与食品卫生教研室,四川泸州 646000)
研究显示,肿瘤患者营养不良发生率可达56%~87%,消化系统肿瘤尤甚[1-3]。目前随着医疗技术的进步,肿瘤患者生存时间得以延长,而提高生存质量则是肿瘤临床治疗的重中之重,营养治疗是肿瘤治疗的基本手段之一,尽早了解患者营养状况,合理的营养治疗,有利于提高治疗效果和生存质量甚至延长生存周期。目前国内住院患者营养评估通常使用营养风险筛查工具2002(NRS 2002),但对于肿瘤患者来说,近年来患者全面主观营养评估(PG-SGA)也得到广泛推广和使用[4]。本文利用NRS 2002和PG-SGA作为筛查工具评价消化系统肿瘤患者营养状况,并比较其结果的一致性,为肿瘤患者临床营养评估提供参考依据。
1 资料与方法
1.1 资料来源
于2016年1月—2017年12月收集在十堰市太和医院肿瘤科住院治疗的消化系统肿瘤患者680例,其中男384例、女296例,年龄19~81岁,平均57.2±9.0岁,按年龄段分:40岁以下56人、40~60岁251人、60岁以上373人;按文化程度分:小学及以下184人、初中高中及中专326人、大专及以上170人;按肿瘤类型分:食管癌180例、胃癌146例、肝癌101例、结直肠癌140例、其他113例;TNM分期:Ⅰ期132例、Ⅱ期148例、Ⅲ期203例、Ⅳ期197例。纳入标准:明确诊断为消化系统恶性肿瘤;愿意参与营养评估并能清醒完成调查;知情同意。排除标准:孕产妇;病情危重不能接受评估者;意识不清不能完成调查者。
1.2 调查工具
1.2.1营养风险筛查工具采用欧洲肠外肠内营养学会(ESPEN)推荐的NRS 2002对患者进行营养风险评估,内容包含3部分,即营养状况评分(0~3分)、疾病严重程度评分(0~3分)和年龄评分(0~1分),0~2分为无营养风险,但需每周重测1次,≥3分则为有营养风险,需要进行营养支持。
1.2.2患者全面主观营养评定PG-SGA是在SGA基础上发展起来的,石汉平教授等根据中国肿瘤患者制定了修正版。包括患者自评和医务人员评估两部分,具体内容包括体质量、摄食情况、症状、活动和身体功能、疾病与营养需求的关系、代谢方面的需要、体格检查等7个方面,前4个方面由患者自评(A评分),后3个方面由医务人员完成(疾病B、应激C、体格检查D评分),评估结果可分为2种,定量评估直接以PG-SGA评分描述,定性评估则分为营养良好(0~1分)、可疑营养不良(2~3分)、中度营养不良(4~8分)、重度营养不良(≥9分)4个等级,本研究参考文献[5]以PG-SGA评分≥4分定义为存在营养不良。
1.3 调查方法
所有患者入院时即由经过培训的营养专科护士用NRS 2002和PG-SGA量表进行营养风险筛查和营养状况评估,NRS 2002评分2分以下的还需要每周重复评分1次。同时收集患者入院时营养相关实验室检查指标,包括白蛋白(ALB)、前白蛋白(PA)等,以ALB≤30g/L为营养不良判定标准。
1.4 统计学方法

2 结果与分析
2.1 NRS 2002评分及营养风险比较
680例消化系统肿瘤患者有营养风险者260例,营养风险发生率38.2%,不同年龄段、肿瘤类型和TNM分期NRS 2002评分和营养风险发生率差异有统计学意义(P<0.05),而不同性别和文化程度则差异无统计学意义(P>0.05)(表1)。
2.2 PG-SGA评分及营养不良发生情况比较
用PG-SGA对患者进行营养状况评估,有36.2%患者检出营养不良(PG-SGA≥4分),不同年龄段、肿瘤类型和TNM分期患者PG-SGA评分和营养不良发生率差异均有统计学意义(P<0.05),而不同性别和文化程度差异无统计学意义(P>0.05)(表2)。
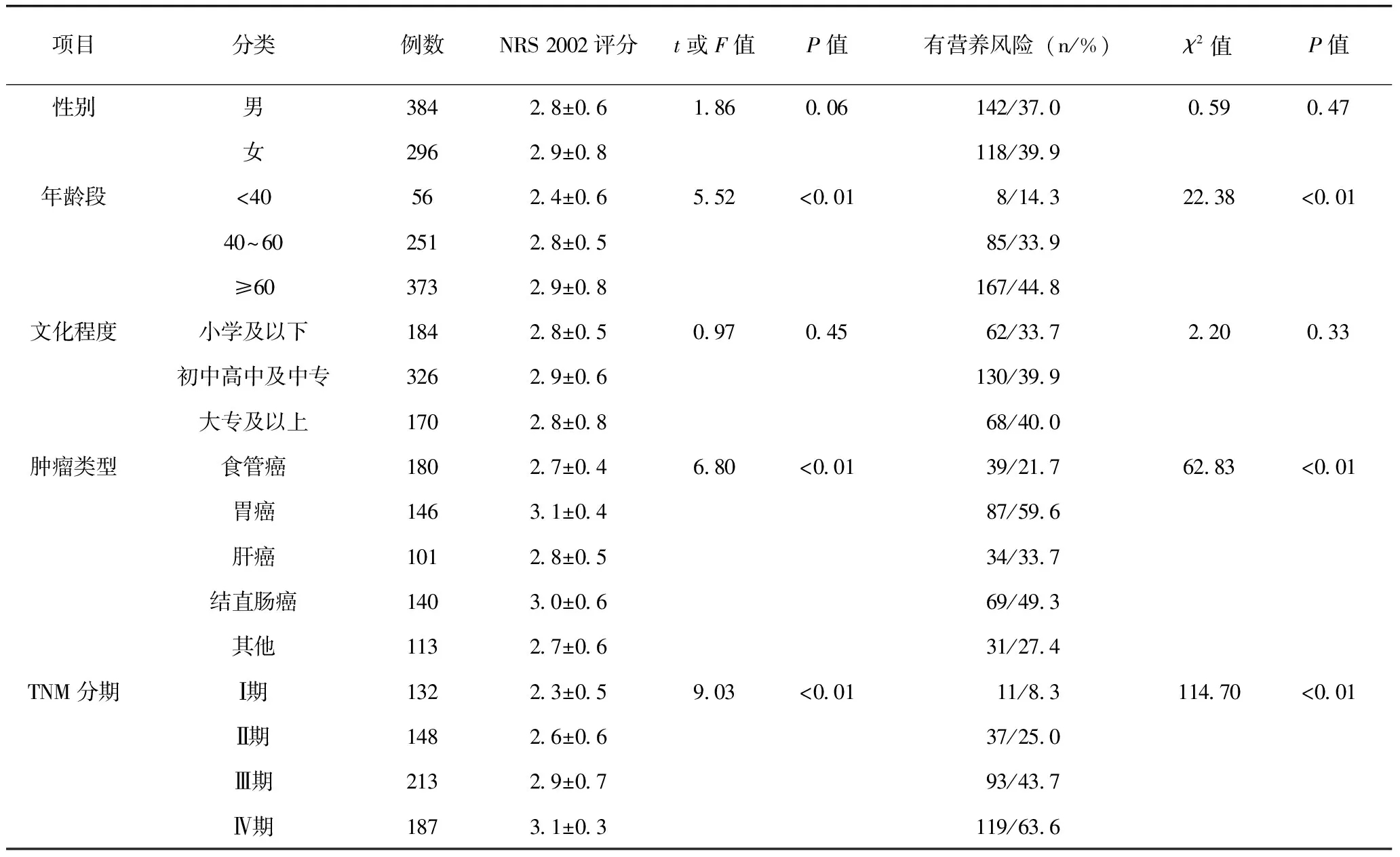
表1 不同情况患者NRS 2002评分及营养风险比较
2.3 NRS 2002和PG-SGA的适用性评价
以ALB<30g/L为界判断营养不良,共检出营养不良242例,营养不良发生率为35.6%,以此为金标准与NRS 2002和PG-SGA诊断结果比较(表3)。
2.4 NRS 2002与PG-SGA判断结果的关联性
以NRS 2002和PG-SGA判断营养风险或营养不良,其共同诊断171例,NRS 2002和PG-SGA诊断结果有关联性(P<0.05),其列联系数r为0.49(表4)。
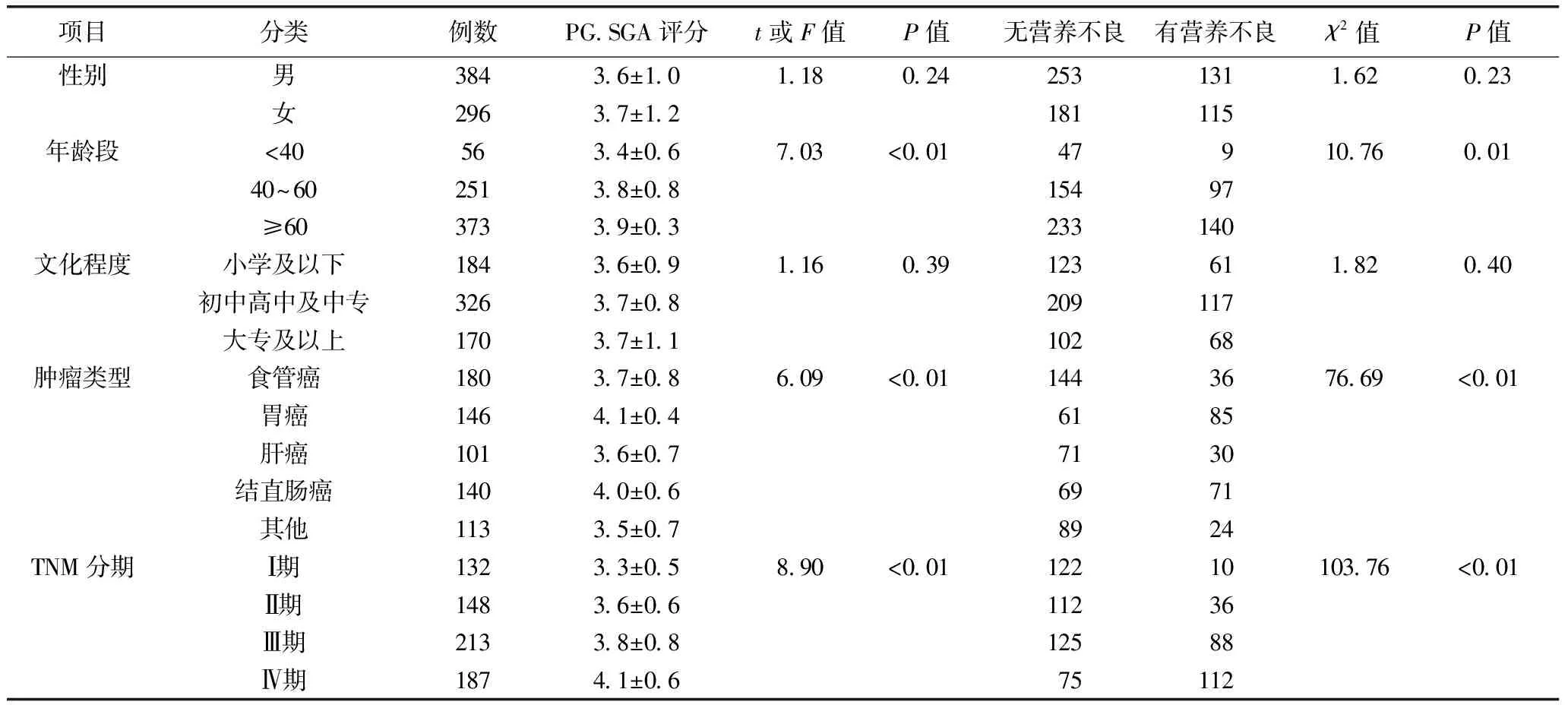
表2 不同情况患者营养不良发生情况比较
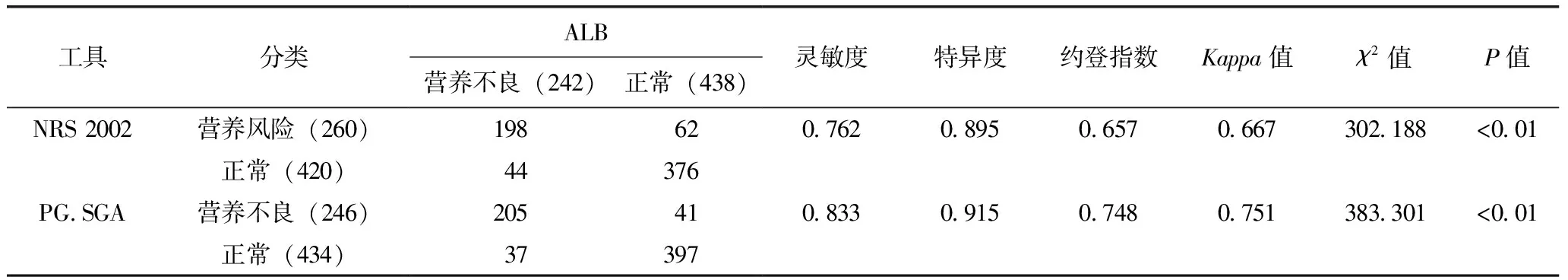
表3 NRS 2002和PG-SGA的适用性评价
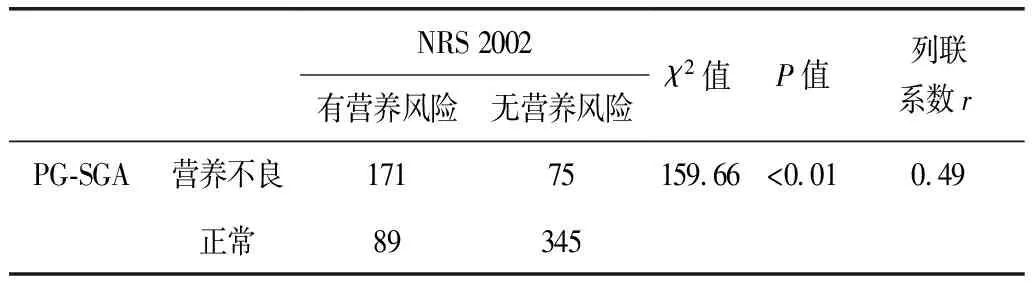
表4 NRS 2002与PG-SGA判断结果的关联性
3 讨论
肿瘤患者发生营养不良风险较大,消化系统肿瘤患者营养不良发生率尤其高,研究发现,消化系统肿瘤患者营养不良发生率可达12.6%~80.6%,营养风险也高达35.7%~45%[6-8]。尽早判断患者营养状况,积极有效的营养支持能提高治疗效果,减少术中术后并发症,对减少远期复发和生存率都有积极意义[9]。由于放化疗等治疗手段会降低患者食欲,会进一步增加营养不良的发生风险[10]。本研究发现,消化系统肿瘤患者营养风险和营养不良发生率分别达38.2%和36.2%,处于较高水平,与相关研究报道相当[5,11]。
目前国际上营养状况评估较常用的工具包括NRS 2002、PG-SGA、营养不良通用筛查工具(MUST)、微型营养评定量表(MNA)等,但适用性有所不同。一般认为NRS 2002应用最广泛,可用于一般住院患者营养风险筛查,但其筛查结果不能认为是营养不良,只能用于指导是否应当对患者开展营养支持[12];PG-SGA是在SGA基础上发展起来的主要适用于肿瘤患者的营养状况评价工具,是美国肠外肠内营养学会(ASPEN)推荐的肿瘤患者营养筛查首选工具[13];MUST是英国肠内与肠外营养学会(BAPEN)推荐的营养评价工具,国内已有学者使用于肿瘤患者营养评估[14];MNA则主要适用于老年人营养状况评价,尤其适用于社区老年人[15]。由于各工具评估要点不一,尚不能认为某个工具是营养评价的“金标准”,但NRS 2002用于判断是否存在营养风险和PG-SGA用于评估肿瘤患者营养状况是得到公认的,临床上也可结合体格检查或实验室检查结果进行综合评估。本研究发现,不同年龄段、肿瘤类型和TNM分期的肿瘤患者NRS 2002评分和营养风险发生率差异有统计学意义。随着年龄增加营养风险发生率越高,这可能是由于:①NRS 2002评分中有一项年龄评分,≥70岁者加1分,使NRS 2002评分增加,营养风险发生率亦随之增加;②随着年龄的增加,机体处于负氮平衡状态,正常人肌肉含量也在减少,加之肿瘤患者长期处于过度消耗状态。消化系统肿瘤包含多种器官肿瘤,因各种原因其营养不良发生率高于一般恶性肿瘤,其中胃癌、结直肠癌营养不良发生率更高[16],本研究结果也类似。肿瘤的临床分期通常采用美国癌症联合会(AJCC)2010年出版的TNM分期系统,即原发肿瘤的范围(T)、区域淋巴结转移情况(N)和远处转移(M),临床上分为4期(Ⅰ、Ⅱ、Ⅲ、Ⅳ),分期越高意味着肿瘤进展程度越高,也意味着发生营养不良风险越高[17]。PG-SGA结果也与NRS 2002结果类似。
血清ALB和PA均是营养状况评价中比较灵敏的实验室指标,临床中得到广泛应用[18],本研究以ALB为营养不良的“金标准”探讨NRS 2002和PG-SGA的适用性发现,NRS 2002、PG-SGA与ALB判定营养不良均有较高的一致性,其约登指数高达0.67和0.75,与吉琳琳等研究结果类似[19]。将NRS 2002和PG-SGA结果进行关联性分析也得出相近结论,这也与刘妮等[20]报道一致,这说明不管是NRS 2002还是PG-SGA,均可用于肿瘤患者营养状况评估,临床医生也可以根据其结果开展营养支持。
综上,消化系统肿瘤整体营养风险和营养不良发生率较高,采用NRS 2002和PG-SGA均可评价患者营养状况,用以指导开展合理的营养支持,由于上述判断结果与ALB有高度一致性,也可选用ALB指导对患者的营养支持或判断营养支持效果。◇
[1]Emmanuel G,Bruno R,Jean-Philippe D,et al.Malnutrition in Patients With Cancer:Comparison of Perceptions by Patients,Relatives,and Physicians-Results of the NutriCancer2012 Study[J]. JPEN,2018,42(1):255-260.
[2]王艳梅,甘振威,张娅婕,等.肿瘤放疗患者身体营养状况及生化指标的分析[J].中国老年学杂志,2013,33(12):2763-2765.
[3]张瑞萍,高云阁,董晓昕,等.127例肿瘤患者的营养状况调查分析[J].现代肿瘤医学,2016,24(5):790-792.
[4]石英英,张晓伟,袁凯涛,等.PG-SGA操作标准介绍[J].中华肿瘤防治杂志,2013,20(22):1779-1782.
[5]杨家君,黄学军,邓俊晖,等.PG-SGA在常见消化道恶性肿瘤患者中的应用研究[J].肿瘤代谢与营养电子杂志,2017,4(2):189-193.
[6]罗智鹏,石华伟,薛瑶纯,等.常见恶性肿瘤住院病人营养状态的调查和分析[J].肠外与肠内营养,2016,23(3):162-169.
[7]贺英,林欣,刘莉,等.重庆市某医院常见恶性肿瘤住院患者营养状况调查[J].肿瘤代谢与营养电子杂志,2017,4(1):45-50.
[8]Fukuda Y,Yamamoto K,Hirao M,et al.Prevalence of malnutrition among gastric cancer patients undergoing gastrectomy and optimal preoperative nutritional support for preventing surgical site infections[J].Ann Surg Oncol,2015,22(3):778-785.
[9]Zheng HL,Lu J,Li P,et al.Effects of preoperative malnutrition on short- and long-term outcomes of patients with gastric cancer:Can We Do Better?[J].Ann Surg Oncol,2017,24(11):3376-3385.
[10]Bicakli DH,Ozveren A,Uslu R,et al.The effect of chemotherapy on nutritional status and weakness in geriatric gastrointestinal system cancer patients[J].Nutrition,2018(47):39-42.
[11]零春润,叶州,白丽芬,等.胃癌患者术前营养相关血液生化指标与PG-SGA评分的相关性研究[J].中国普外基础与临床杂志,2017,24(8):958-962.
[12]Chen R,Xing L,You C.The use of nutritional risk screening 2002 to predict prognosis in hospitalized patients with chronic obstructive pulmonary disease with respiratory failure[J]. Eur J Intern Med,2017(43):e9-e10.
[13]Abbott J,Teleni L,McKavanagh D,et al.Patient-Generated Subjective Global Assessment Short Form (PG-SGA SF)is a valid screening tool in chemotherapy outpatients[J].Support Care Cancer,2016,24(9):3883-3887.
[14]Carolina BT,Mariana C,Isabel MG,et al.Teaching MUST:A Multidisciplinary Tool in Oncology[J].Oncologist,2011(16):239-245.
[15]Hailemariam H,Singh P,Fekadu T.Evaluation of mini nutrition assessment (MNA)tool among community dwelling elderly in urban community of Hawassa city,Southern Ethiopia[J].BMC Nutrition,2016,2(1):11.
[16]王昌平,陈德,黄小明.恶性肿瘤患者营养不良发生率调查及诊断指标探讨[J].安徽医药,2016,20(12):2273-2277.
[17]肖永彪,贺宇琴.结直肠癌各分期的营养风险评分和相应营养支持与术后并发症的关系分析[J].医学临床研究,2016,33(6):1236-1238.
[18]程春来,李辉.胃肠道肿瘤患者围化疗期营养状况的评价及对免疫功能的影响[J].现代肿瘤医学,2015,23(10):1412-1416.
[19]吉琳琳,侯栋梁,宋丽楠,等.营养风险筛查2002、营养不良通用筛查工具和患者主观整体评估在住院肿瘤患者中应用和比较[J].营养学报,2017,39(3):242-246.
[20]刘妮,方玉,李子禹,等.营养风险筛查和主观整体评估在胃肠肿瘤病人围手术期中的应用及临床意义[J].肠外与肠内营养,2016,23(6):346-350.

