Wnt1诱导分泌蛋白-1通过NF-κB通路促进食管鳞癌细胞的增殖和侵袭转移
凌锐,周玲,周月鹏,毛朝明,陈德玉
(江苏大学附属医院1.肿瘤研究中心,2.核医学科,江苏 镇江212001)
食管鳞癌易早期转移,预后较差,5年生存率仅为 20% ~40%[1-2]。我们早前实验证实[3],食管鳞癌进程与异常活化的Wnt信号密切相关。Wnt信号通路中的关键调控因子Wnt1诱导分泌蛋白-1(Wnt1 induced secreted protein-1,WISP-1)通过αvβ3/FAK/c-Src、Ras和 NF-κB等信号通路,活化VEGF、MMP2及MMP9等蛋白表达,调控肿瘤的增殖、侵袭和转移进程[3-5]。本研究探讨在食管鳞癌中WISP-1表达与肿瘤细胞侵袭、转移能力获得之间的联系以及机制。
1 材料与方法
1.1 细胞、试剂与仪器
人食管癌Eca109、TE-8细胞株购于上海生物化学与细胞研究所细胞库;食管正常上皮细胞Het-1a购自广州吉妮欧生物科技有限公司。
RPMI-1640培养液和胎牛血清(Gibco公司);兔抗人 MMP2、MMP9、VEGF-A、VEGF-C、WISP-1抗体(武汉博士德公司),鼠抗人β-肌动蛋白、HRP标记的 IgG、兔抗人 NF-κB、p-NF-κB、IκBα、p-IκBα(Cell Signaling Technology公司);脂质体 Lipo2000(上海英骏生物技术有限公司);WISP-1 siRNA(上海吉玛制药技术有限公司);Trizol试剂、反转录及荧光定量PCR试剂盒(大连TaKaRa公司);WISP-1和GAPDH引物(上海捷瑞生物工程有限公司);细胞恒温培养箱(Thermo Fisher Scientific公司);核酸测定仪 Biomate 3s及 Pierce ECL plus Substrate(Thermo Fisher Scientific公司);Mx3000p实时定量PCR扩增仪(Stratagene公司)。
1.2 方法
1.2.1细胞培养 Eca109、TE-8和 Het-1a细胞株培养于含10%胎牛血清、1%青霉素和1%链霉素混合液的RPMI-1640培养液中,置于37℃、5%的CO2培养箱中,当细胞进入对数生长期再进行传代或者后续实验。
1.2.2荧光实时定量PCR检测WISP-1表达水平提取RNA后通过核酸测定仪确认其D(260 nm)/D(280 nm)在1.8~2.0之间,随后设置反应条件为37℃15 min,85℃5 s,进行反转录得cDNA。引物序列如下:WISP-1上游引物 5′-CTCAGCAGCTTGGGGACAAC-3′,下游引物 5′-GATGCCTCTGGCTGGTACAC-3′;GAPDH上游引物 5′-ACCACAGTCCATGCCATCAC-3′,下游引物 5′-TCCACCACCCTGTTGC TGTA-3′。反应条件:95℃2 min预变性;95℃15 s变性,60℃20 s退火/延伸,共40个循环。最终采用2-△△Ct法计算WISP-1的mRNA相对表达量。
1.2.3转染实验 转染前1天,接种5×105个细胞/孔至60 mm培养皿中,待细胞达到50%~70%后分别设置空白对照组、阴性对照组(空载体组)以及WISP-1 siRNA组。WISP-1 siRNA序列为5′-GACAUCCAUACACUCAUUATT-3′, 5′-UAAUGAGUG UAUGGAUGUCTT-3′;空载体序列为5′-UUCTCCGAACGUGCUCACGUTT-3′,5′-ACCUGACACGUUC GGAGAATT-3′。将1 mL Lipo2000混合不同siRNA或者等体积缓冲液加入预留的2 mL纯RPMI-1640培养皿中,置于37℃、5%CO2培养箱中孵育6 h。之后更换含有血清的普通培养基,分别转染24 h、48 h后提取RNA或者蛋白质以进行后续实验。
1.2.4流式细胞术检测WISP-1 siRNA处理后食管癌细胞株的凋亡取转染后Eca109和TE-8细胞,消化离心种于60 mm皿中,调整细胞密度为4.5×105个/皿。0.25%胰蛋白酶(不含 EDTA)消化、收集细胞,调整细胞密度为2.0×105个/管,先加入5 μL的Annexin V-FITC避光孵育15 min,上机前加入10μL的PI混合,每管加入400μL的PBS通过流式细胞术检测各组细胞的凋亡比例。
1.2.5CCK-8实验检测WISP-1 siRNA处理后细胞增殖能力 取转染后对数生长的食管鳞癌Eca109和TE-8细胞,消化离心后以6 000个/孔种入96孔板内,设定WISP-1 siRNA处理组、空白对照组和阴性对照组(每组5个复孔)。置于37℃、5%的CO2培养箱中孵育24 h、48 h和72 h,于每孔加入10μL的CCK-8溶液,在培养箱中培养1 h后,450 nm检测各组样品的光密度,并计算抑制率。
1.2.6Transwell实验检测 WISP-1 siRNA转染后细胞侵袭能力 用WISP-1 siRNA转染Eca109和TE-8细胞24 h后,消化离心重悬将2×105个细胞用无胎牛血清的培养基重悬接种在24孔板的Transwell(孔径为8μm)上室中,下室中加入10%胎牛血清的培养基。48 h后,将Transwell小室取出,用0.1%的结晶紫染色,显微镜下随机选取5个视野进行拍摄(200倍),统计每个视野的平均细胞数量。
1.2.7蛋白质印迹法检测细胞 WISP-1、MMP、VEGF及NF-κB相关蛋白 上述不同处理组的细胞于48 h后提取总蛋白,测定蛋白质浓度以确保每个加样孔中加入基本等量的总蛋白。电泳后将蛋白转至PVDF膜上,用5%BSA封闭 1 h,分别加MMP2抗体(1∶200)、MMP9抗体(1∶500)、VEGF-A抗体(1∶500)、VEGF-C抗体(1∶400)、WISP-1抗体(1∶400),β-肌动蛋白、NF-κB、p-NF-κB、IκBα、p-IκBα均为1∶1 000,置于4℃中孵育过夜;TBST洗膜8 min×5次后,加HRP标记的山羊抗兔二抗(1∶5 000),室温孵育1 h。TBST再次洗膜8 min×5次,加入ECL化学发光显色液,于成像系统曝光并记录结果;相关实验至少重复3次。
1.2.8ELISA实验检测细胞培养上清液VEGF-C及MMP9的含量 分别收集空白对照组、阴性对照组和WISP-1 siRNA处理组Eca109和TE-8细胞培养上清液各2 mL,1 000 r/min离心 20 min,随后根据ELISA试剂盒(杭州联科生物技术有限公司)操作说明,分别使用酶标仪在450 nm和490 nm处测量VEGF-C及MMP9的浓度。
1.3 统计学分析
应用SPSS 22.0软件进行数据分析,实验数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用 LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 WISP-1在食管鳞癌细胞中的表达
实时定量PCR检测结果显示,与食管正常上皮细胞Het-1a比较,食管鳞癌Eca109及TE-8细胞中WISP-1的 mRNA显著上调(P<0.05,图1),经WISP-1 siRNA干扰后,WISP-1的mRNA表达量明显下调(图2)。蛋白质印迹结果进一步验证了WISP-1蛋白表达的变化。

图1 W ISP-1在食管鳞癌细胞株中的表达
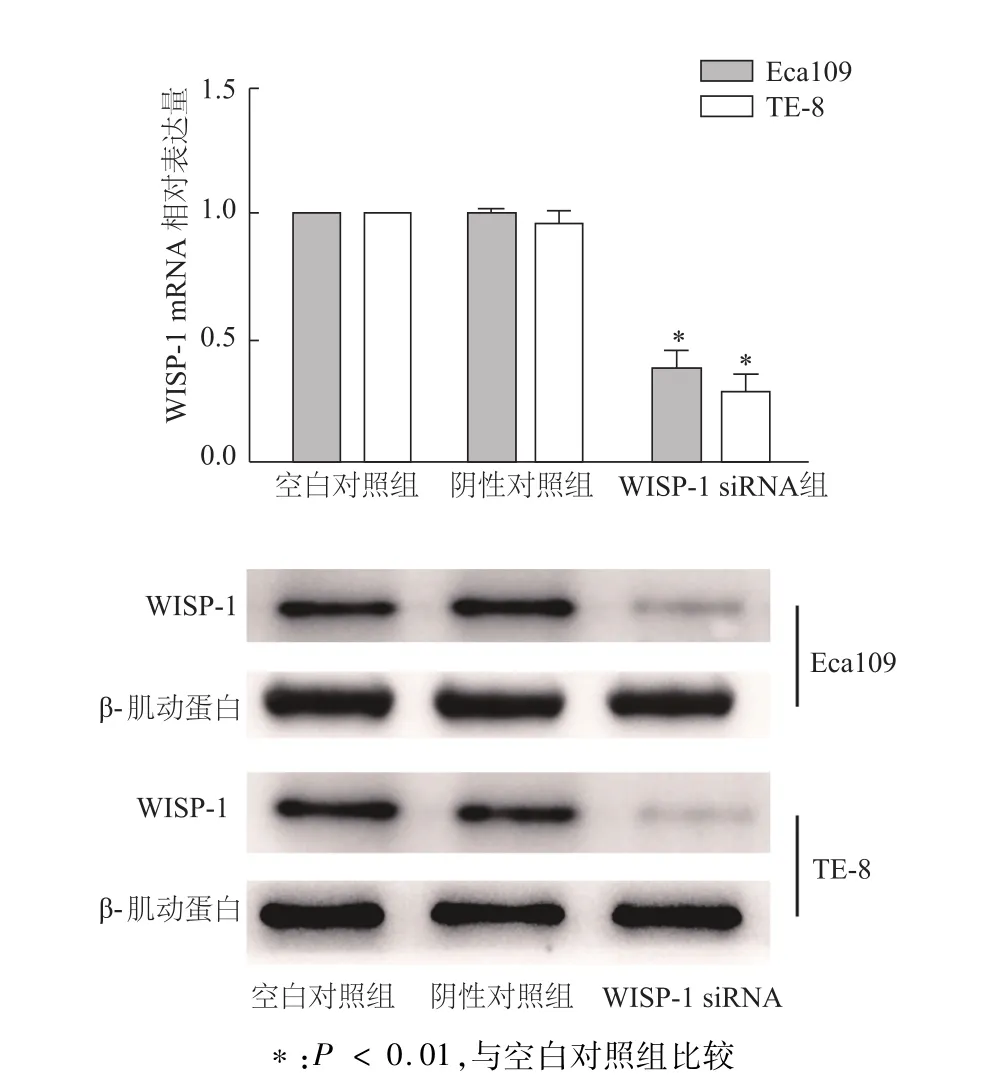
图2 荧光定量PCR和蛋白质印迹检测W ISP-1 siRNA干扰效果
2.2 下调WISP-1抑制食管鳞癌细胞的活性
流式细胞术检测结果显示,在食管鳞癌Eca109、TE-8细胞中下调WISP-1均未引起显著的凋亡率上升,与对照组相比无统计学意义(图3);CCK8检测发现,下调WISP-1可显著抑制食管鳞癌细胞增殖活性(P<0.05或 P<0.01,图4)。

图3 流式细胞术检测食管癌细胞株早期凋亡结果
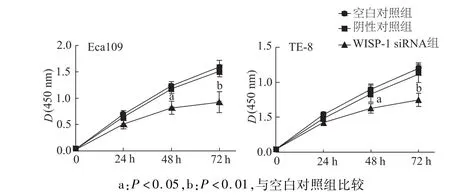
图4 CCK 8检测各组食管癌细胞增殖能力
2.3 下调WISP-1抑制食管鳞癌细胞的侵袭能力
Transwell实验显示,下调WISP-1可以显著地抑制Eca109和TE-8细胞的侵袭能力(P<0.05,图5)。蛋白质印迹结果证实,下调WISP-1可明显抑制食管鳞癌细胞 VEGF-C、MMP9蛋白的表达,而VEGF-A和MMP2蛋白与对照组差异不明显(图6);ELISA结果表明,下调 WISP-1后,Eca109、TE-8细胞培养上清液中的VEGF-C、MMP9外泌量较对照组出现了明显下降(P<0.05,图7)。
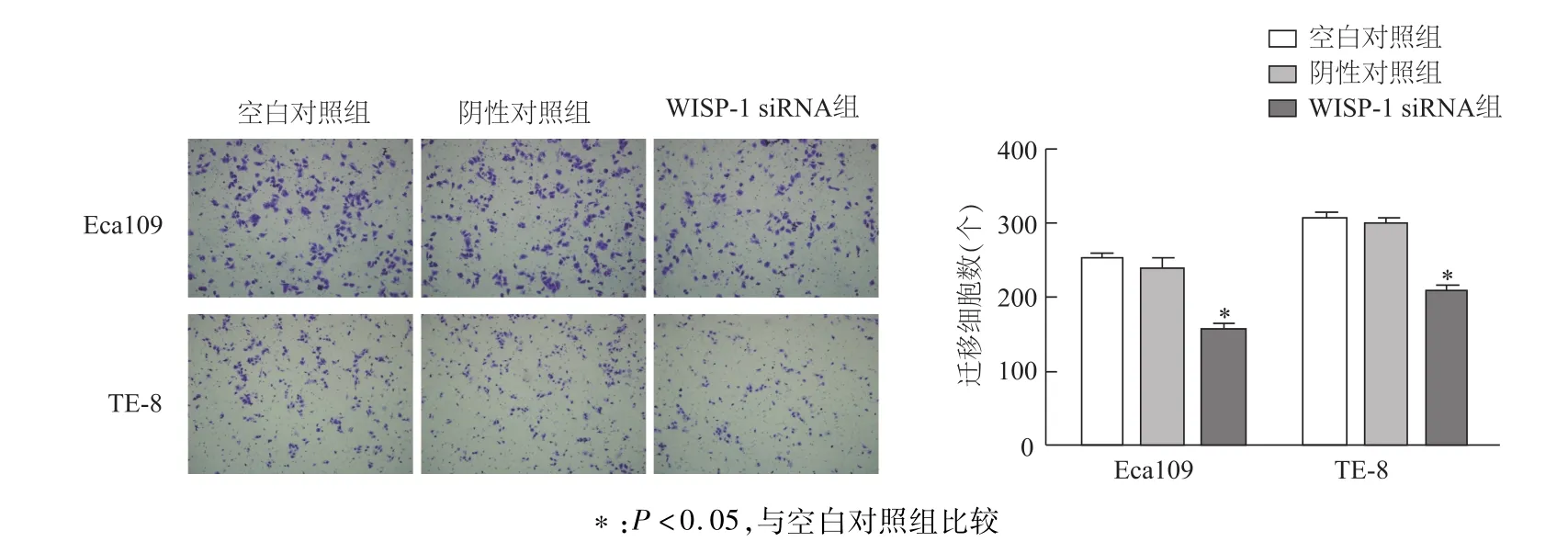
图5 Transwell法检测各组食管癌细胞侵袭能力

图6 蛋白质印迹检测食管癌细胞中VEGF-A、VEGF-C、MMP2和MMP9的表达
2.4 下调WISP-1抑制NF-κB信号通路的活化
与空白对照组细胞相比,下调WISP-1表达均可以抑制食管鳞癌Eca109及TE-8细胞NF-κB-p65的磷酸化并促进 IκBα蛋白的磷酸化进程;对总的NF-κB-p65和 IκBα蛋白表达无明显影响(图8)。
3 讨论
在我国,食管癌以鳞状细胞癌为主,其发病率位居全部肿瘤类型的第5位。目前认为,食管鳞癌的发展多涉及部分关键信号通路的过度活化和MMPs、VEGF蛋白的异常表达,探讨食管鳞癌侵袭转移过程及其分子机制具有重要的临床意义。目前的研究主要集中在 Wnt、Notch、PI3K/Akt和 NF-κB通路,其中,NF-κB信号通路的异常活化与多种肿瘤发生、发展密切相关,例如调控包括细胞周期调节蛋白、VEGF、MMP2、MMP9等基因的表达,促进肿瘤细胞增殖、脉管新生、侵袭和转移,因此对影响NF-κB信号异常活化相关因素的研究显得十分必要[6-9]。

图7 酶联免疫吸附法测定各组食管癌细胞中VEGF-C、MMP9分泌量

图8 蛋白质印迹检测食管癌细胞NF-κB通路相关蛋白表达
近来研究发现,NF-κB信号通路存在着受其他通路的调控因子作用而活化的机制,从而形成复杂的共刺激信号网络,例如Wnt通路中的WISP-1[5]。WIPS-1属于结缔组织生长因子(CTGF)家族,参与许多细胞过程,包括增殖、分化、凋亡、迁移等。研究证实在口腔鳞状细胞癌[4]、前列腺癌[10]、骨肉瘤[5]等中均有WISP-1的高表达,并且其表达强度与肿瘤细胞增殖、侵袭、转移等存在着密切联系。
本研究证实,在食管鳞癌细胞中WISP-1蛋白的表达明显高于正常的食管上皮细胞;干扰Eca109和TE-8细胞的WISP-1表达后,抑制了食管鳞癌细胞持续增殖的能力,而对早期凋亡发生没有显著的影响。食管鳞癌组织中异常表达的WISP-1与淋巴结转移发生紧密相关[11-12]。本研究中,下调WISP-1后,Transwell实验结果证实食管鳞癌细胞的侵袭能力受到了显著抑制,同时与侵袭、淋巴管新生能力直接相关的MMP9和VEGF-C蛋白生成及外泌量均明显下降。蛋白质印迹结果显示,下调WISP-1表达可以抑制NF-κB-p65的磷酸化进程同时促进p-IκBα形成,进而阻止NF-κB信号的持续异常激活,初步证实了食管鳞癌中WISP-1可能参与NF-κB信号的活化。
综上所述,WISP-1可通过影响NF-κB通路活化,促进增殖、侵袭相关蛋白及因子的表达和分泌,在食管鳞癌信号通路共刺激调控、淋巴结转移发生等进程中发挥重要作用。
[参考文献]
[1]Chen W,Zheng R,Baade PD.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]Zeng H,Zheng R,Zhang S,et al.Esophageal cancer statistics in China,2011:Estimates based on 177 cancer registries[J].Thorac Cancer,2016,7(2):232-237.
[3]Chen D,LiW,Liu S,et al.Interleukin-23 promotes the epithelial-mesenchymal transition of oesophageal carcinoma cells via the Wnt/β-catenin pathway[J].Sci Rep,2015,5:8604.
[4]Chuang JY,Chen PC,Tsao CW,et al.WISP-1 a novel angiogenic regulator of the CCN family promotes oral squamous cell carcinoma angiogenesis through VEGF-A expression[J].Oncotarget,2015,6(6):4239-4252.
[5]Wu CL,Tsai HC,Chen ZW,et al.Ras activationmediates WISP-1-induced increases in cellmotility and matrix metalloproteinase expression in human osteosarcoma[J].Cell Signal,2013,25(12):2812-2822.
[6]Zhu G,Huang Q,Huang Y,et al.Lipopolysaccharide increases the release of VEGF-C that enhances cellmotility and promotes lymphangiogenesis and lymphaticmetastasis through the TLR4-NF-κB/JNK pathways in colorectal cancer[J].Oncotarget,2016,7(45):73711-73724.
[7]Tang Y,Lv P,Sun Z,et al.14-3-3βpromotesmigration and invasion of human hepatocellular carcinoma cells by modulating expression of MMP2 and MMP9 through PI3K/Akt/NF-κB pathway[J].PLoS One,2016,11(1):e0146070.
[8]Zhang JF,Wang P,Yan YJ,et al.IL33 enhances glioma cellmigration and invasion by upregulation ofMMP2 and MMP9 via the ST2-NF-κB pathway[J].Oncol Rep,2017,38(4):2033-2042.
[9]Chen ZD,Xu L,Tang KK,et al.NF-κB-dependent transcriptional upregulation of cyclin D1 exerts cytoprotection against hypoxic injury upon EGFR activation[J].Exp Cell Res,2016,347(1):52-59.
[10]Tai HC,Chang AC,Yu HJ,et al.Osteoblast-derived WNT-induced secreted protein 1 increases VCAM-1 expression and enhances prostate cancer metastasis by down-regulating miR-126[J].Oncotarget,2014,5(17):7589-7598.
[11]潘雪,张岩,李向楠,等.Wnt-1诱导分泌蛋白-1在食管癌组织的表达及意义[J].中华实验外科杂志,2016,33(2):509-511.
[12]Nagai Y,Watanabe M,Ishikawa S,etal.Clinical significance of Wnt-induced secreted protein-1(WISP-1/CCN4)in esophageal squamous cell carcinoma[J].Anticancer Res,2011,31(3):991-997.

