人参皂苷Rg1改善小鼠肢体缺血后血管新生
王晓丽,金跃,刘鹭,张凯,杨乃全
(徐州医科大学附属淮安第二人民医院1.检验科,2.心脏内科,江苏淮安223002)
下肢动脉疾病(peripheral arterial disease,PAD)在2型糖尿病患者常见,常常是预后不好的标志[1-2]。有研究发现内皮型一氧化氮合酶(eNOS)功能受损在小鼠血管新生功能降低中发挥重要作用[3]。人参具有很高的医用价值,目前已经从人参中分离鉴定出大量的活性成分,其中人参皂苷Rg1是发挥人参功效的主要成分[4]。近来大量的数据提示Rg1能够促进血管新生以及人脐静脉内皮细胞增殖、趋化、血管发生[5-8]。作为糖皮质激素受体的配体,Rg1能够增加人脐静脉内皮细胞磷脂酰肌醇3激酶(PI3K)、蛋白激酶 B(Akt)及 eNOS的活化[9]。这些研究均提示Rg1具有潜在的促进血管新生作用,也许可以作为一种新的治疗下肢缺血的药物。本研究通过制作小鼠后肢缺血模型,探讨人参皂苷Rg1是否具有促进小鼠缺血后肢血管新生的作用以及可能的机制。
1 材料与方法
1.1 实验分组
人参皂苷Rg1(纯度>96%)购于中国药品生物制品检定所。雄性C57BL/6J小鼠20只随机分为两组:对照组(n=10)腹腔注射生理盐水0.1 mL;Rg1治疗组(n=10)腹腔注射人参皂苷 Rg1(10 mg·kg-1)。每天给药1次,连续2周。
1.2 后肢缺血模型的制作
所有小鼠以戊巴比妥(50 mg·kg-1)腹腔注射麻醉后,在操作显微镜的辅助下在右侧后肢自腹股沟韧带中点至膝上做一个纵形长切口,显露股动脉,小心地将股动脉与股静脉和股神经分离,将股动脉自腹股沟韧带处至膝上部分用7-0线结扎两个结,切断两个结之间的股动脉。左侧后肢作为非缺血对照。
1.3 激光多普勒灌注成像仪检测小鼠后肢血流灌注
结扎股动脉后第14天,用激光多普勒灌注成像仪(PeriScan PIM 3,瑞典)测定小鼠后肢血流灌注恢复程度。以结扎侧/未结扎侧血流比值即LDPI指数比较不同组之间的差别[10]。
1.4 免疫荧光检测缺血肢体毛细血管密度
在手术后2周,小鼠血流检测后立即处死。收集每只小鼠缺血后肢的腓肠肌。腓肠肌包埋于OTC中,液氮速冻后制备成5μm冰冻组织切片。用免疫荧光染色法检测毛细血管密度。每张玻片荧光显微镜(×200倍)随机采集2~3个不同视野的图像,用 Image-Pro Plus软件(Media Cybernetics,Rockville,USA)分别计数每个视野中的CD31及DAPI染色阳性的区域。组织毛细血管密度以CD31阳性区域面积除以DAPI染色阳性区域面积的比值计算[10]。
1.5 比色法检测缺血肢体一氧化氮分泌
手术后14 d,分离缺血肢体内收肌和半膜肌,并用PBS冲洗去除多余的血液,0.1 g肌肉放在2 mL PBS(pH=7.4)中匀浆,匀浆物 5 000×g离心 5 min,提取上清液即刻检测一氧化氮浓度(碧云天生物技术有限公司)[11]。
1.6 TUNEL法检测缺血肌肉细胞凋亡
术后第14天,收集缺血肢体腓肠肌,4%多聚甲醛固定,石蜡包埋,切成5μm切片。按照TUNEL试剂盒(In Situ Cell Death Detection kit,德国 Roche公司)说明书进行细胞凋亡检测。
1.7 统计学分析
应用SPSS 22.0软件包处理数据,计量资料以均数±标准差(±s)表示,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Rg1治疗改善缺血肢体血流
手术后14 d,激光多普勒检测结果显示,Rg1治疗明显地改善了小鼠缺血肢体的LDPI指数(0.65±0.11),而对照组为 0.43±0.08,两者相比差异有统计学意义(t=4.836,P<0.05)。见图1。

图1 Rg1治疗改善缺血肢体血流
2.2 Rg1治疗增加缺血肢体毛细血管密度
免疫荧光定量检测结果表明,Rg1治疗组小鼠缺血肢体血管密度(CD31/DAPI比值)为0.65±0.11,与对照组(0.46±0.15)相比,Rg1治疗使缺血肢体血管密度增加了0.4倍(t=2.278,P<0.05)。见图2。
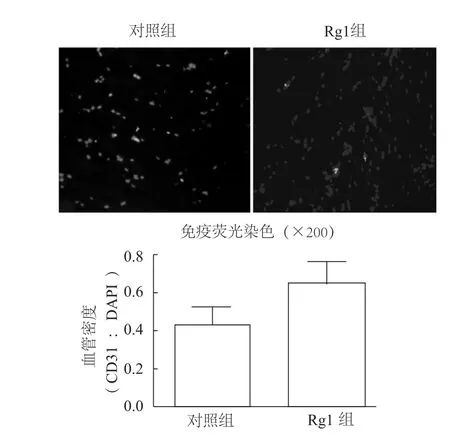
图2 Rg1治疗促进了缺血肢体毛细血管的新生
2.3 Rg1治疗降低缺血肢体细胞凋亡
TUNEL法染色凋亡细胞核为绿色,正常细胞核为蓝色。结果显示,Rg1治疗组小鼠缺血组织细胞的凋亡[(20.3±6.3)%]较对照组显著降低[(30.7±6.4)%,t=3.682,P<0.05]。见图3。

图3 Rg1治疗降低缺血组织细胞的凋亡
2.4 Rg1治疗增加缺血肢体组织一氧化氮的分泌
Rg1治疗组缺血肢体组织一氧化氮的含量为(239.4±98.2)μmol/mL,对照组为(139.5±68.6)μmol/mL,两者相比差异有统计学意义(t=2.637,P<0.05)。
3 讨论
本研究结果显示,人参皂苷Rg1治疗能显著地改善小鼠肢体缺血后血流再灌注以及血管再生,其潜在机制可能为增加一氧化氮的分泌,抑制缺血组织细胞的凋亡。
既往的研究发现小鼠骨髓eNOS活化的下降会导致内皮祖细胞动员的受损[12]。有观察提示NOS衍生的一氧化氮对适应急性严重的肢体缺血,避免发生组织坏死和维持动脉新生是必需的[13]。我们以前的研究表明人参皂苷Rg1提高了糖尿病小鼠及非糖尿病小鼠缺血肢体中磷酸化eNOS的表达[10]。所有这些研究表明,eNOS对促进缺血组织血管新生具有重要作用。
研究已经揭示,基本的细胞凋亡程序导致了不同形式的组织缺血后细胞丢失[14-15],不受控制的细胞凋亡阻止了侧支形成。我们的结果证实了人参皂苷Rg1治疗能够降低小鼠肢体缺血后细胞的凋亡。以前的研究发现Rg1治疗能够通过PI3K及Akt通路促进功能性血管的新生,而PI3K及Akt通路已经被证实在拮抗细胞凋亡中起作用[16-17]。PI3K及Akt通路是否参与了Rg1治疗抑制肢体缺血后细胞凋亡还需要进一步的研究。
本研究的主要局限是我们仅选择了人参皂苷Rg1一种剂量,不同的治疗剂量对小鼠下肢缺血后血管新生的确切作用还需要进一步探讨。
[参考文献]
[1]Aboyans V,Lacroix P,Tran MH,et al.The prognosis of diabetic patientswith high ankle-brachial index depends on the coexistence of occlusive peripheral artery disease[J].JVasc Surg,2011,53(4):984-991.
[2]陈一文,秦明照.糖尿病下肢动脉疾病与微血管病变的相关性[J].中华老年心脑血管病杂志,2016,18(5):551-552.
[3]Dong L,Kang L,Ding L,et al.Insulin modulates ischemia-induced endothelial progenitor cell mobilization and neovascularization in diabetic mice[J].Microvasc Res,2011,82(3):227-236.
[4]Radad K,Gille G,Moldzio R,et al.Ginsenosides rb1 and Rg1 effects on mesencephalic dopaminergic cells stressed with glutamate[J].Brain Res,2004,1021(1):41-53.
[5]Yue PY,Wong DY,Ha WY,et al.Elucidation of the mechanisms underlying the angiogenic effects of ginsenoside Rg(1)in vivo and in vitro[J].Angiogenesis,2005,8(3):205-216.
[6]Liang HC,Chen CT,Chang Y,et al.Loading of a novel angiogenic agent,ginsenoside Rg1 in an acellular biological tissue for tissue regeneration[J].Tissue Eng,2005,11(5/6):835-846.
[7]Sengupta S.Modulating angiogenesis:The yin and the yang in ginseng[J].Circulation,2004,110(10):1219-1225.
[8]Lin KM,Hsu CH,Rajasekaran S.Angiogenic evaluation of ginsenoside rg1 from panax ginseng in fluorescent transgenic mice[J].Vascul Pharmacol,2008,49(1):37-43.
[9]Leung KW,Cheng YK,Mak NK,etal.Signaling pathway of ginsenoside-rg1 leading to nitric oxide production in endothelial cells[J].FEBSLetters,2006,580(13):3211-3216.
[10]Yang NQ,Chen PS,Tao ZW,et al.Beneficial effects of ginsenoside-Rg1 on ischemia-induced angiogenesis in diabetic mice[J].Acta Biochim Biophys Sin,2012,44(12):999-1005.
[11]Wang M,Zhao XR,Wang P,et al.Glucose regulated proteins78 protects insulinoma cells(NIT-1)from death induced by streptozotocin,cytokines or cytotoxic T lymphocytes[J].Int JBiochem Cell Biol,2007,39(11):2076-2082.
[12]Gallagher KA,Liu ZJ,Xiao M,et al.Diabetic impairments in no-mediated endothelial progenitor cellmobilization and homing are reversed by hyperoxia and SDF-1α[J].JClin Invest,2007,117(5):1249-1259.
[13]Park B,Hoffman A,Yang Y,et al.Endothelial nitric oxide synthase affects both early and late collateralarterial adaptation and blood flow recovery after induction of hindlimb ischemia in mice[J].J Vasc Surg,2010,51(1):165-173.
[14]Shyu KG,Wang BW,Hung HF,et al.Mesenchymal stem cells are superior to angiogenic growth factor genes for improvingmyocardial performance in themousemodel of acute myocardial infarction[J].J Biomed Sci,2006,13(1):47-58.
[15]Lim H,Fallavollita JA,Hard R,et al.Profound apoptosis-mediated regionalmyocyte loss and compensatory hypertrophy in pigs with hibernating myocardium[J].Circulation,1999,100(23):2380-2386.
[16]Cheung LW,Leung KW,Wong CK,etal.Ginsenosiderg1 induces angiogenesis via non-genomic crosstalk of glucocorticoid receptor and fibroblastgrowth factor receptor-1[J].Cardiovasc Res,2011,89(2):419-425.
[17]Li Y,Zhang D,Zhang Y,et al.Augmentation of neovascularization inmurine hindlimb ischemia by combined therapy with simvastatin and bone marrow-derived mesenchymal stem cells transplantation[J].J Biomed Sci,2010,17:75.

