大丽轮枝菌弱致病力菌株Vd171对棉花黄萎病的诱导免疫作用及机制
张一豪,冯鸿杰,袁媛,靳羽莹,师勇强,张朝军,李付广
(中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳 455000)
0 引言
【研究意义】棉花是中国重要的经济作物,黄萎病是棉花生产上的一种毁灭性病害,严重影响棉花产量和纤维品质,是发展棉花生产的重要限制因子之一,目前仍无较为有效的防治方法。在缺乏有效的防治药剂、抗病品种匮乏的情况下,探索其他途径来提高棉花品种的抗病性,从而将黄萎病造成的产量损失控制在经济阈值之下,具有重要的理论意义和实际应用价值。【前人研究进展】棉花黄萎病是一种典型的土传维管束病害,其病原菌为大丽轮枝菌(Verticillium dahliae),在土壤中以微菌核或菌丝体形式长期存活,从植株的根部入侵定殖后,沿维管束扩展蔓延。该病具有病原菌寄主范围广、传播途径多、遗传分化复杂,防治难度大的特点。种植抗病品种是防治土传维管束病害最经济有效的措施之一,但目前中国棉花抗黄萎病育种尚未取得显著进展,主要原因是:(a)棉花对黄萎病的抗原匮乏;(b)棉花对黄萎病的抗性是受多基因控制的数量性状,抗病育种难度大;(c)棉田黄萎病菌系是一个复合种群, 而且基因水平也存在差异,变异频繁,品种抗性丧失快[1-3]。目前,通过诱导免疫提高植物的抗病性,成为植物病害防治研究的热点领域。有不少的研究表明,利用弱毒菌株或非致病菌能激活寄主的免疫系统,从而增强寄主的抗病性[4]。但在棉花黄萎病方面的研究报道较少。20世纪70年代 MACE[5]发现弱致病力的大丽轮枝菌可诱导棉花对黄萎病的抗性;吴洵耻等[6]研究认为在棉花上接种棉花黄萎病菌弱菌株可减轻后继感染的强菌株引起的棉花黄萎病的严重度;ZHU等[7]从棉花上分离到一株大丽轮枝菌弱致病力菌株 CVd-WHW(后命名为Vd171),先接种该弱毒菌株之后,再接种强致病力菌株,表现出具有显著的交叉保护作用。【本研究切入点】对Vd171弱毒菌株诱导抗病性的具体机制尚不清楚,有待于进一步明确。【拟解决的关键问题】明确大丽轮枝菌弱致病力菌株Vd171诱导棉花产生抗病性的技术方法,并通过分析该菌株诱导棉花后,病原菌与寄主的亲和性、病原菌在寄主中的扩展和寄主防御相关酶基因的表达及活性变化等,探明Vd171诱导寄主对棉花黄萎病产生抗性的作用机制,从而为进一步揭示病原菌与寄主互作机制和探索棉花黄萎病生物防治新途径提供科学依据。
1 材料与方法
试验于 2015—2017年在中国农业科学院棉花研究所完成。
1.1 供试菌株及棉花品种
大丽轮枝菌弱致病力菌株Vd171(菌株保藏编号:CGMCC No. 5903),于2009年分离自湖北襄樊棉田有黄萎病症状的棉株,大丽轮枝菌强致病力菌株Vd080(菌株保藏编号:CGMCC No. 5904),于2007年分离自河北辛集棉田有黄萎病症状的棉株。两个菌株经形态学和ITS(internal transcribed spacer)序列鉴定,均为大丽轮枝菌。Vd171前期研究已鉴定为弱致病力菌株,而Vd080为强致病力菌株,并表现为落叶型菌株。
本研究中,用Vd171接种以诱导植株抗病性,用Vd080接种以评价诱导抗病性的效果。Vd080GFP为通过农杆菌介导的转化方法将绿色荧光蛋白基因GFP插入Vd080中,经筛选鉴定后其致病力与Vd080无差异。
分生孢子悬浮液制备:供试菌株在棉籽培养基上25℃暗培养7 d后取出,加入灭菌水,充分振荡后,用4层灭菌纱布过滤,收集滤液并将分生孢子浓度调节至1×107个分生孢子/mL备用。
培养滤液制备:供试菌株在查氏培养基上25℃振荡培养7 d后,用滤纸过滤掉菌丝和孢子,收集滤液备用。
试验所用棉花品种为棉花黄萎病感病品种冀棉 11。
1.2 Vd171对棉花黄萎病诱导抗性的测定
棉苗培育方法参照朱荷琴等[8]方法。强致病力菌株Vd080的接种均于棉苗一片真叶平展时(播种后21 d)进行,以分生孢子悬浮液为接种体,采用蘸根接种方法[8],接种浓度均为 1×107个分生孢子/mL,蘸根时间为5 min。
弱致病力菌株Vd171的接种根据试验需要设置了不同的接种时间、接种方法、接种次数和不同接种体的试验设计,主要包括:①用于明确Vd171接种的最佳时间。共设置7个处理,其中,处理1—4分别为先接种Vd171,2、4、6、8 d后接种Vd080;处理5—7分别为先接种Vd080,1、2、4 d后再接种Vd171;以先接种清水,4 d后接种Vd080为对照。Vd171的接种方法同Vd080。②用于明确Vd171的最佳接种方法。设置6个处理,包括Vd171蘸根、灌根、茎部针刺[9]、叶面喷雾、浸种共5种接种方法和清水浸种对照。蘸根、灌根和叶面喷雾为每钵Vd171分生孢子悬浮液10 mL,茎部针刺为每棉株0.2 mL,浸种处理采用Vd171的分生孢子悬浮液浸种12 h。蘸根、灌根和叶面喷雾均于接种Vd080前的4 d进行,浸种处理于播种前进行;5种接种方法 Vd171分生孢子悬浮液的浓度为1×107个分生孢子/mL。以先清水浸种、后接种Vd080为对照。所有处理均在播种后21 d蘸根接种Vd080。③用于明确Vd171的接种次数。设置3个处理,先接种Vd171两次(间隔4 d),第2次接种Vd171后4 d再接种Vd080;接种Vd171一次,接种Vd171后4 d接种Vd080;以接种清水后4 d接种Vd080为对照。接种方法均为蘸根。④用于明确Vd171分生孢子和培养滤液的诱导抗病效果。共设置4个处理,分别为先接种Vd171分生孢子悬浮液、Vd171查氏培养滤液、查氏培养基(对照)及清水(对照),所有处理均4 d后接种Vd080。接种方法均为蘸根。
上述4组试验均为每处理3次重复,每重复留苗不低于30株。
棉苗置日光温室中培养,环境温度控制在 20—32℃,土壤相对湿度控制在60%以上,光照良好。对照棉苗普遍发病后,按5级分级标准进行病害的分级调查[8]。计算病株率、病情指数和防治效果。病株率(%)=病株数×100/总株数;病情指数=(∑级数×每级的病株数)×100/(调查的总株数×4);防治效果(%)=(对照病情指数-处理病情指数)×100/对照病情指数。
1.3 Vd171对黄萎病菌定殖和棉株内扩展的影响
采用营养液水培棉苗,播种后12 d左右,一片真叶初现时,将棉苗根系放入有Vd171分生孢子的营养液中(Vd171孢子终浓度为1×107个分生孢子/mL),浸泡4 d后,取出棉苗,再浸入含Vd080GFP分生孢子的营养液中(Vd080GFP孢子终浓度为1×107个分生孢子/mL),以先接种清水后接种Vd080GFP为对照;每处理3次重复,每重复保证不少于50棵棉苗,棉苗置日光温室中培养,环境温度控制在20—32℃,光照良好。接种Vd080GFP后1、2、3、4 d,每处理随机取5棵棉苗,称取根0.5 g,剪碎,加入2 mL灭菌水,充分振荡后静置10 min,取上清液,在荧光显微镜下,计数分生孢子的数量;接种Vd080GFP后7 d,每处理随机取棉苗10株,将下胚轴分为上、中、下3段进行病原菌的分离鉴定。
营养液的配制:6 mmol·L-1KNO3,4 mmol·L-1Ca(NO3)2,2 mmol·L-1NH4H2PO4,1 mmol·L-1MgSO4,50 mmol·L-1KCl,25 mmol·L-1H3BO3,2 mmol·L-1MnSO4,2 mmol·L-1ZnSO4,0.5 mmol·L-1CuSO4,0.5 mmol·L-1H2MoO4,20 mmol·L-1EDTA,20 mmol·L-1Fe(NH4)2SO4。
1.4 棉花防御基因表达量测定
棉苗培育及Vd171接种方法同1.2第1组试验。试验设置两个处理,接种Vd080前4 d接种Vd171及清水(对照)。每处理30个营养钵,每钵留苗5株。接种Vd171后0、12、24、36、48、72、96 h取样,每处理随机取20棵苗。
棉花总RNA的提取、cDNA第一链的合成和荧光定量 PCR参照张芸等[10]方法。将棉花中高度保守的ubiquitin作为内参,目的基因为4CL(4-香豆酰-CoA连接酶)、CHI(几丁质酶)、POD(过氧化物酶)、PPO(多酚氧化酶)和PAL(苯丙氨酸解氨酶),特异引物见表1。

表1 相关基因的特异性引物序列Table 1 Specific primer sequence of related genes
1.5 防御相关酶的活性测定
棉苗培育、Vd171和Vd080的接种方法同1.2第1组试验。试验设置两个处理,接种Vd080前4 d接种Vd171及清水。每处理30个营养钵,每钵留苗5株。接种Vd080前,每处理随机取20棵苗,用清水冲洗干净后,放入灭菌水中冲洗,分为下胚轴和真叶两部分,分别称取1 g鲜重,0℃保存备用。
将理论模型中参数赋值后即可模拟目标价格变动对市场均衡及社会福利的影响。上述理论模型涉及9个参数,其中3个参数需要使用计量经济学方法估计获得,分别是试点区和非试点区供给弹性以及替代弹性,本文将借鉴前人的研究结果,其他6个参数可以根据变量的初始值计算获得(见表2)。
过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)用 50 mmol·L-1Tris-HCl buffer(pH 7.5)为提取液,每克鲜样加入 0.05 g PVP;多酚氧化酶(PPO)用 0.1 mol·L-1KH2PO4(pH 6.0)为提取液,每克鲜样加入0.05 g聚乙烯基吡咯烷酮;取 2 g鲜样加入 10 mL HAc-NaAc缓冲液,得到几丁质酶(CHI)的粗提液;酶液抽提物均4℃保存备用。POD、PPO、PAL和CHI活性测定分别参照FERRER等[11-14]的方法。
1.6 Vd171诱导棉花活性氧爆发的测定
棉苗培育及Vd171接种方法同1.2第1组试验。试验设置两个处理,接种Vd080前4 d接种Vd171及接种清水(对照)。接种Vd171 48 h后取长势相近的植株的真叶进行活性氧检测,检测方法参照文献[14]。
1.7 Vd171诱导棉花木质部的加厚
棉苗培育及Vd171接种方法同1.2第1组试验。试验设置 4个处理,分别为 Vd171+清水、Vd171+Vd080、清水+清水(对照)、清水+Vd080(对照),两次接种间隔4 d。接种Vd080后2 d取长势相近的棉花,横切下胚轴,将切片置于载玻片上,用10%的间苯三酚染液(溶于无水乙醇中)染色2 min,用浓硫酸孵育片刻,置于光学显微镜下迅速观察拍照[15]。
1.8 数据处理与分析
采用SPSS 22.0软件对各处理的病情指数进行差异显著性分析,对基因表达量及根表黄萎病菌孢子数量进行t检验。
2 结果
2.1 Vd171诱导棉花对黄萎病的抗性作用
2.1.1不同接种时间与诱导抗病效果在冀棉11播种后21 d蘸根接种大丽轮枝菌强致病力菌株Vd080,在接种Vd080前2、4、6、8 d和之后的1、2、4 d,蘸根接种弱致病力菌株 Vd171。接种 Vd080后 15 d的调查结果显示,对照处理的病株率和病情指数分别为65.6%和39.6,达到感病水平;接种Vd080前2、4、6、8 d接种Vd171的4个处理,病情指数为3.2—9.8,极显著低于对照,对黄萎病的防治效果分别为82.8%、91.8%、80.7%和75.0%。接种Vd080后25 d的调查结果表明,对照处理的病株率和病情指数分别为 78.4%和57.6,达到高感水平;接种Vd080之前2、4、6、8 d接种Vd171的4个处理,病情指数为7.5—15.9,极显著低于对照,防治效果分别78.7%、87.0%、78.8%和72.3%;其中,前4 d接种Vd171处理诱导抗性效果最好,对棉花黄萎病的平均防效为 89.4%,依次是2、6和 8 d,平均防治效果分别为 80.8%、79.8%和73.7%。两次调查结果表明,接种Vd080之后1、2和4 d接种Vd171,病情指数与对照没有显著差异,平均防治效果分别为2.1%、3.2%和1.4%和3.0%。表明在接种Vd080之前2、4、6、8 d接种弱致病力菌株Vd171均对棉花黄萎病具有显著的交叉保护作用,以前 4 d接种Vd171效果最好;接种Vd080之后再接种Vd171对棉花黄萎病没有控制作用(表2)。

表2 不同时期接种Vd171对棉花黄萎病的诱导抗性效果Table 2 Induced resistance effects of Vd171 against Verticillium wilt in cotton in different inoculation periods
2.1.2不同接种方法与诱导抗病效果接种 Vd080后15 d,对照处理的病株率和病情指数分别为46.1%和36.2,达感病水平;在5种接种Vd171不同方法的处理中,以蘸根和叶面喷雾效果最好,对黄萎病的防治效果分别为 80.3%和 73.9%,两个处理的病情指数均极显著低于对照,两者之间差异不显著;其次是浸种和灌根,防治效果分别为 60.0%和 47.3%,两个处理的病情指数也均极显著低于对照,两者之间差异不显著;茎部针刺处理效果最差,防治效果只有3.2%,病情指数与对照差异不显著。接种Vd080后25 d,对照的病株率和病情指数分别为69.6%和54.5,达高感水平;5种接种Vd171方法中,仍然以蘸根效果最好,对黄萎病的防治效果为59.7%,病情指数极显著低于对照;其次是叶面喷雾、灌根和浸种,对黄萎病的防治效果为29.9%—34.6%,病情指数均极显著低于对照,三者之间差异不显著;茎部针刺处理效果最差,防治效果只有1.1%,病情指数与对照差异不显著。几种接种方法相比较,蘸根>叶面喷雾、浸种和灌根>针刺(表3)。
2.1.4不同接种体类型的诱导抗病效果采用蘸根接种方法,在接种Vd080前4 d分别接种Vd171分生孢子和培养滤液,探讨Vd171不同组分对黄萎病的诱导抗性作用。接种Vd080后15 d和25 d的调查结果表明,两个接种处理均具有较好的诱导抗性作用,在对照处理病情指数达38.4和55.6情况下,两处理的病情指数分别为3.3—3.5和11.0—16.3,均极显著低于对照,平均防治效果为81.1%—85.6%,二者之间差异不显著;先接种清水和查氏培养基的两个对照之间无显著差异(表5)。

表3 Vd171不同接种方法对棉花黄萎病的诱导抗性效果Table 3 Induced resistance effects against Verticillium wilt in cotton by different inoculation methods of Vd171
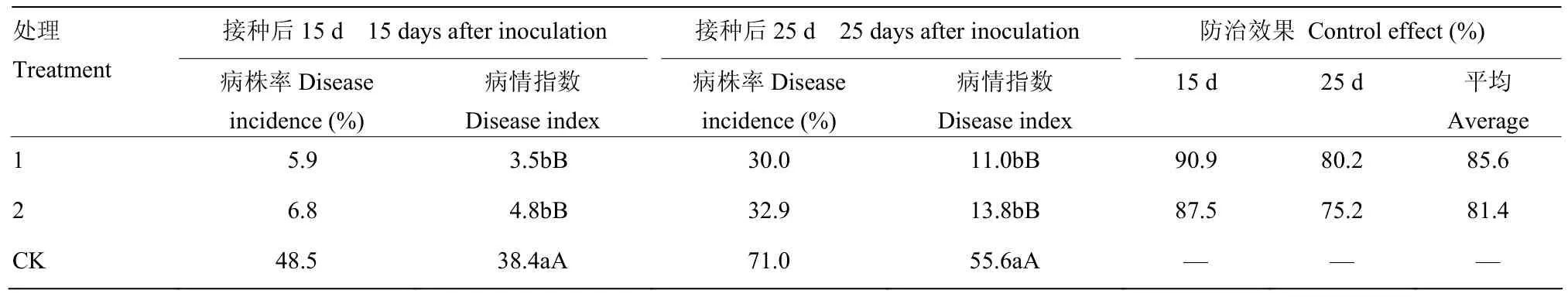
表4 接种Vd171次数对棉花黄萎病的诱导抗性效果Table 4 Induced resistance effects against Verticillium wilt in cotton by different inoculation times of Vd171
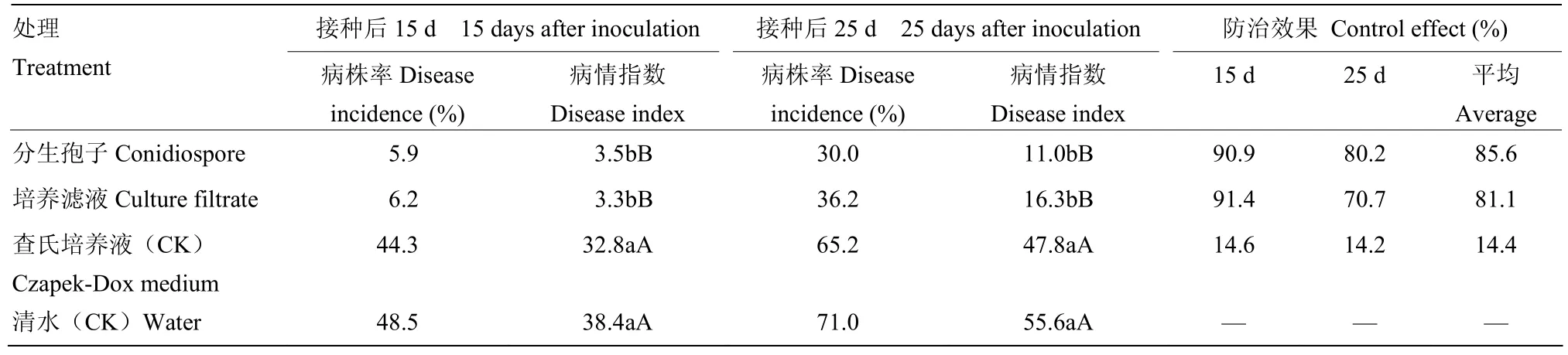
表5 Vd171不同接种体类型对黄萎病的诱导抗性效果Table 5 Induced resistance effects against Verticillium wilt in cotton by different inoculum types of Vd171
2.2 Vd171诱导抗性的作用机制
2.2.1接种 Vd171对黄萎病菌在棉苗根部定殖和棉株体内扩展的影响将水培 12 d的棉苗分别先接种Vd171和清水,4 d后接种Vd080GFP,接种Vd080GFP后1、2、3和4 d观察棉苗根表Vd080GFP分生孢子的数量。结果表明,先接种Vd171处理各时段分生孢子的数量分别为8.0×106、7.9×106、6.6×106和4.4×106/g,均低于清水对照(14.1×106、13.7×106、7.8×106、7.7×106/g),其中1、2和4 d时差异达极显著水平(图 1)。表明先接种弱致病力菌株Vd171降低了之后棉苗根系与强致病力菌株 Vd080GFP分生孢子的结合能力。

图1 接种Vd171对棉苗根表黄萎病菌数量的影响Fig. 1 Effects of Vd171 inoculation on V. dahliae conidia number on the root surface of cotton seedlings
接种Vd080GFP后7 d,两处理分别随机取样15株,分为上、中、下3段,分离棉花黄萎病菌,先接种Vd171处理不同部位均未分离到棉花黄萎病菌(图2-A—C),而接种清水的对照 3个部位均分离到棉花黄萎病病菌,上、中、下3段分离率分别为6.7%、20%和20%(图2-D—F)。所有分离到的病原菌经荧光观察,均产生荧光,确定为Vd080GFP。
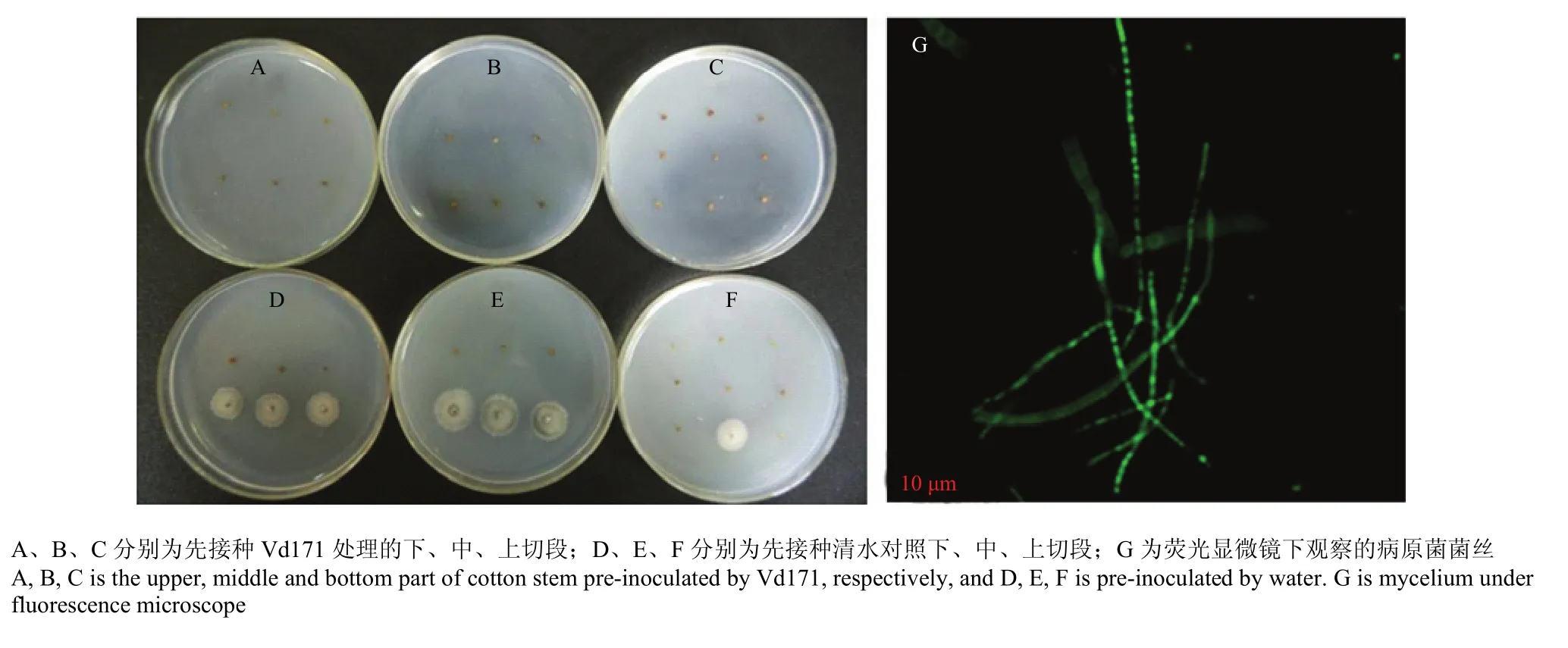
图2 接种Vd171对黄萎病菌在棉株内扩展的影响Fig. 2 Effects of Vd171 inoculation on development of pathogens in cotton stem
2.2.2接种 Vd171对棉花防御相关基因表达量的影响qPCR测定结果表明,与接种清水对照相比,接种Vd171的处理棉花根部GhPOD和GhPPO表达量均没有明显的变化(图3-D、3-E),而GhPAL、Gh4CL和GhCHI的表达量则发生明显变化。接种清水的对照中,0—72 h GhPAL和Gh4CL的表达量均逐渐减少,而接种Vd171的处理中则表现先升高后降低,且均较对照明显提高,其中,GhPAL在接种Vd171 12 h后表达量达到最高,为对照处理的2.2倍(图3-A);而Gh4CL在接菌24 h后表达量达到最高,为对照处理的8.5倍(图3-B)。对照处理中 GhCHI的表达量随时间延长而逐渐降低,与之相比,接种Vd171的处理中GhCHI的表达量为持续高表达趋势,较对照明显提高,在接种后的36 h差异最大,为对照的2.6倍,达差异显著水平(图3-C)。

图3 接种Vd171对防御相关基因表达的影响Fig. 3 Effects of Vd171 inoculation on expression of defense-related genes

表6 先接种Vd171对棉苗防御相关酶活性的影响Table 6 Effect of pre-inoculated by Vd171 on activity of resistance-related enzymes in cotton seedlings
2.2.3先接种Vd171对棉花防御相关酶活性的影响接种 Vd080前测定棉苗下胚轴和真叶中防御相关酶活性的变化,结果表明与对照相比先接种 Vd171处理棉苗下胚轴中PPO、PAL、POD和CHI酶活性均极显著高于对照,分别较对照提高31.9%、131.0%、57.1%和102.1%;子叶中PAL、CHI和POD酶活性显著高于对照,分别较对照提高 22.1%、39.6%和7.1%,PPO酶活性与对照没有显著差异(表6)。该结果与上述基因表达情况一致,表明 Vd171诱导了棉花苯丙烷代谢作用的增强及几丁质酶的表达,提高了棉花抗病性。
2.2.4先接种 Vd171诱导活性氧爆发蘸根接种Vd171分生孢子悬浮液48 h后,在叶片中观察到较多的褐色沉淀,而接种清水的对照中,褐色沉淀较少,表明Vd171引起了棉花叶片活性氧的爆发(图4)。

图4 Vd171引起棉花叶片活性氧爆发Fig. 4 Vd171 triggered ROS in cotton leaves
2.3 Vd171诱导木质部的增厚
显微镜观察结果表明,与只接种清水对照相比,接种Vd171和Vd080的处理木质部均明显增厚;先接种Vd171再接种Vd080的处理,幼苗木质部进一步增厚,表明Vd171能够诱导棉苗维管束细胞发生明显的木质化,以抵御之后黄萎病菌的侵染和扩展(图5)。
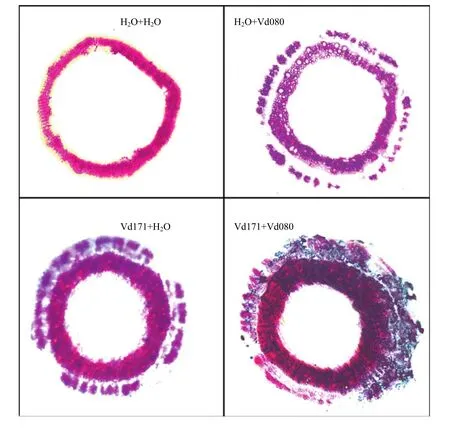
图5 棉花茎部横切面细胞木质化情况Fig. 5 Histochemical analysis of lignin in stem cross-sections of cotton
3 讨论
研究证明,植物具有抵抗各种病害的潜在能力,人们可以采用适当的诱导处理使这种潜能表达出来,使感病植物表现抗病,而且抗性比较稳定,还能抵抗多种病害,它克服了以往一些防治措施存在的不足。目前,这方面的研究已有不少成功的实例[16-18]。在棉花黄萎病方面研究较多的是利用拮抗细菌枯草芽孢杆菌[19-21],也有研究采用棉花内生的蜡状芽孢杆菌[15]、球毛壳真菌[10]、黑白轮枝菌[22]和变黑轮枝菌[6,23]来诱导棉花对黄萎病的抗性,以达到控制病害的目的。把弱毒株系接种到无病健康的植株上,经一段时期后,当同种病原菌的强毒株系再次侵染时,由于该植株已产生免疫能力,抵抗或削弱强毒菌株的侵染,使植株发病减轻或不发病而受到保护,即交叉保护[16]。这种现象在病毒病中研究较多,而真菌性病害研究较少。在棉花黄萎病方面,已有的研究表明弱致病力菌株具有诱导抗性的作用[5-6],至于其具体的使用方法、诱导抗性的机制并不清楚。本研究以一株分离自棉花的致病力极弱的大丽轮枝菌Vd171为对象,不同的接种试验发现在接种Vd080前4 d蘸根接种Vd171的分生孢子悬浮液,对黄萎病的防治效果最好,达到 89.4%,这与现有的研究结果相一致[5-6]。本研究还发现用分生孢子悬浮液叶面喷雾、浸种和灌根,也具有一定的防治效果,Vd171的培养滤液和分生孢子悬浮液具有同样的效果,该试验结果预示可以将Vd171研制成不同剂型,通过滴灌、喷雾和浸种来控制黄萎病。本研究中,接种Vd080后再接种Vd171则不具备交叉保护的作用,这也提示,无论是滴灌还是喷雾,均需要在黄萎病发生之前进行。
前期研究表明,将CVn-WHg(Vd171)与CVd-AYb(大丽轮枝菌强致病力菌株) 1∶1混匀接种棉花,对黄萎病的交叉保护效果显著低于单独的CVn-WHg,由此认为CVn-WHg对棉株根系生态位的竞争在交叉保护作用中具有重要作用[6]。本研究中,先接种Vd171能阻止之后Vd080在棉花根部的定殖,同样支持了上述观点。
除了生态位竞争,诱导免疫是交叉保护的重要作用机制,主要包括产生植物保卫素、抗病相关酶活性的增加、启动植物组织的木质化反应、产生免疫信息物质等[18-20]。ROS(活性氧)不仅是植物有氧代谢的副产物,也是重要的信号分子,参与调控植物的生长发育以及各种胁迫反应,当植物体遭受病原菌侵害时,细胞壁上会产生ROS,进而激活植物体的防御反应[24-25];本研究中也检测到经 Vd171诱导后,棉苗叶片有明显的活性氧产生,这与周京龙等[15]利用蜡状芽孢杆菌诱导棉花产生的免疫反应结果一致。本研究中发现接种Vd171处理的棉苗根部GhPAL和Gh4CL表达量显著升高,酶活性测定也表明下胚轴和真叶中 PAL的活性较对照提高了131.0%和22.1%,PAL和4CL是苯丙烷类衍生物代谢途径的关键酶[26-27],说明Vd171诱导了棉花苯丙烷代谢作用的增强。苯丙烷代谢途径是植物3大次生代谢途径之一,其代谢产物酚类和异黄酮类植保素以及木质素等在植物抗病中起着化学屏障作用[28-30]。本研究中,接种Vd171可以诱导棉苗根部几丁质酶基因CHI的表达,在下胚轴和子叶中的活性也显著提高,Vd171还能够诱导棉苗维管束细胞发生明显的木质化,经Vd171诱导的棉苗茎部分离到的病原菌明显较少;因此,推测苯丙烷代谢作用的增强可能调控了木质素的生物合成,提高了木质素的积累量,增强了棉花机械结构组织,从而提高其抵御病原微生物在棉株内扩展的能力。
4 结论
温室苗期先接种大丽轮枝菌弱致病力菌株Vd171的分生孢子或培养滤液可以有效地诱导棉花对黄萎病产生抗性,其诱导免疫的机制主要是阻止之后棉花黄萎病菌在棉株根部的定殖和植株体内的扩展,诱导棉苗防御相关基因的表达及酶活性的增强,从而减轻黄萎病的发生危害。该研究预示弱致病力菌株Vd171可以作为植物疫苗应用于棉花黄萎病的防治,具有较好的应用前景。
[1]朱荷琴, 简桂良, 宋晓轩. 棉田黄萎病菌致病型群落结构研究. 棉花学报, 2004, 16(3): 147-151.ZHU H Q, JIAN G L, SONG X X. Community structure of pathogenic type of Verticillium dahliae Kleb. in cotton field. Cotton Science, 2004, 16(3): 147-151. (in Chinese)
[2]简桂良, 卢美光, 朱荷琴. 棉田黄萎病菌致病型结构初步研究. 植物保护学报, 2005, 32(1): 109-110.JIAN G L, LU M G, ZHU H Q. A preliminary study on the virulence of pathogenicity of Verticillium dahliae in cotton field. Acta Phytophylacica Sinica, 2005, 32(1): 109-110. (in Chinese)
[3]贾涛, 裴国亮, 杨家荣, 徐进, 简桂良. 棉田土壤中棉花黄萎病菌的致病力分化. 植物保护学报, 2007, 34(5): 519-523.JIA T, PEI G L, YANG J R, XU J, JIAN G L. Pathogenicity differentiation of Verticillium dahliae of cotton in naturally infested soil. Acta Phytophylacica Sinica, 2007, 34(5): 519-523. (in Chinese)
[4]赵蕾, 滕安娜. 木霉对植物的促生及诱导抗性研究进展. 植物保护,2010, 36(3): 43-46.ZHAO L, TENG A N. Research progress in Trichoderma-stimulated plant growth and induced plant resistance. Plant Protection, 2010,36(3): 43-46. (in Chinese)
[5]MACE M E.Contribution of tyloses and terpenoid aldehyde phytoalexins to Verticillium wilt resistance in cotton. Physiological Plant Pathology, 1978, 12(1): 1-11.
[6]吴洵耻, 刘波. 棉花黄萎病菌菌株间交互保护作用的研究(1)两菌株有效间隔天数的试验. 植物病理学报, 1987, 17(4): 215-218.WU X C, LIU B. The interprotection between strains of Verticillium dahlia Kleb (1) Experiment of effective intervals between strains.Acta Phytopathologica Sinica, 1987, 17(4): 215-218. (in Chinese)
[7]ZHU H Q, FENG Z L, LI Z F, SHI Y Q, ZHAO L H, YANG J R.Characterization of two fungal isolates from cotton and evaluation of their potential for biocontrol of Verticillium wilt of cotton. Journal of Phytopathology, 2013, 161(2): 70-77.
[8]朱荷琴, 冯自力, 李志芳, 赵丽红, 师勇强. 蛭石沙土无底纸钵定量蘸菌液法鉴定棉花品种(系)的抗黄萎病性. 中国棉花, 2010,37(12): 15-17.ZHU H Q, FENG Z L, LI Z F, ZHAO L H, SHI Y Q. A new method for identification of cotton resistance to Verticillium wilt with vermiculate and sand in bottomless paper pot dipping in quantitative spores. China Cotton, 2010, 37(12): 15-17. (in Chinese)
[9]姚耀文, 傅翠真, 王文录, 李庆基, 张元恩, 陈璧, 张中义, 穆罕默德·依明·艾沙, 邓先明, 张树琴, 郜树德, 李腾友. 棉花黄萎病菌生理型鉴定的初步研究. 植物保护学报, 1982, 9(3): 145-148.YAO Y W, FU C Z, WANG W L, LI Q J, ZHANG Y N, CHEN B,ZHANG Z Y, MUHAMMED AMIN EYSA , DENG X M, ZHANG S Q, GAO S D, LI T W. Preliminary studies on physiological forms of cotton Verticillium wilt fugus. Acta Phytophylacica Sinica, 1982, 9(3):145-148. (in Chinese)
[10]张芸, 冯自力, 冯鸿杰, 李志芳, 师勇强, 赵丽红, 朱荷琴, 杨家荣.内生球毛壳属真菌 CEF-082对棉花黄萎病的控制作用. 植物病理学报, 2016, 46(5): 697-706.ZHANG Y, FENG Z L, FENG H J, LI Z F, SHI Y Q, ZHAO L H,ZHU H Q, YANG J R. Control effect of endophytic fungus Chaetomium globosum CEF-082 against Verticillium wilt in Gossypium hirsutum. Acta Phytopathologica Sinica, 2016, 46(5):697-706. (in Chinese)
[11]FERRER M A, CALDERÓN A A, MUÑOZ R, BARCELÓ A R.4-Methoxy-α-naphthol as a specific substrate for kinetic, zymographic and cytochemical studies on plant peroxidase activities. Phytochemical Analysis, 1990, 1(2): 63-69.
[12]ROBISON S P, DRY I B. Broad bean leaf polyphenol oxidase is a 60-kilodalton protein susceptible to proteolytic cleavage. Plant Physiology, 1992, 99(1): 317-323.
[13]PODILE A R, LAXMI V D V. Seed bacterization with Bacillus subtilis AF1 increases phenylalanine ammonia-lyase and reduces the incidence of Fusarial wilt in pigeonpea. Journal of Phytopathology,1998, 146(5/6): 255-259.
[14]REISSIG J L, STORMINGER J L, LELOIR L F. A modified colorimetric method for the estimation of N-acetylamino sugars.Journal of Biological Chemistry, 1955, 217(2): 959-966.
[15]周京龙, 冯自力, 冯鸿杰, 李云卿, 袁媛, 李志芳, 魏锋, 师勇强,赵丽红, 孙正祥, 朱荷琴, 周燚. 棉花内生蜡状芽孢杆菌 YUPP-10对棉花黄萎病的防治作用及机制. 中国农业科学, 2017, 50(14):2717-2727.ZHOU J L, FENG Z L, FENG H J, LI Y Q, YUAN Y, LI Z F, WEI F,SHI Y Q, ZHAO L H, SUN Z X, ZHU H Q, ZHOU Y. Biocontrol effect and mechanism of cotton endophytic bacterium Bacillus cereus YUPP-10 against Verticillium wilt in Gossypium hirsutum. Scientia Agricultura Sinica, 2017, 50(14): 2717-2727. (in Chinese)
[16]DODDS J A. Cross-protection and systemic acquired resistance for control of plant diseases//BELLOWS T S, FISHER T W,CALTAGIRONE L E, DAHLSTEN D L, GORDH G, HUFFAKER C B. Handbook of Biological Control. Academic Press, 1999: 549-556.
[17]俞振明, 李家玉, 林志华, 张奇, 何海斌. 植物抗性诱导防御病虫草害的研究进展. 农业科学研究, 2013, 34(2): 69-76.YU Z M, LI J Y, LIN Z H, ZHANG Q, HE HB. Research advances on induced-defense of plant resistance. Journal of Agricultural Science, 2013, 34(2): 69-76. (in Chinese)
[18]BOLLER T, FELIX G. A renaissance of elicitors: perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors. Annual Review of Plant Biology, 2009,60: 379-406.
[19]吴蔼民, 顾本康, 傅正擎, 蒋正峰. 内生菌 73a防治棉花黄萎病机理. 江苏农业学报, 2002, 18(1): 48-51.WU A M, GU B K, FU Z Q, JIANG Z F. Mechanism of controlling cotton Verticillium wilt with entophytic bacterium 73a. Jiangsu Journal of Agricultural Sciences, 2002, 18(1): 48-51. (in Chinese)
[20]李社增, 鹿秀云, 马平, 高胜国, 刘杏忠, 刘干. 防治棉花黄萎病的生防细菌 NCD-2的田间效果评价及其鉴定. 植物病理学报,2005, 35(5): 451-455.LI S Z, LU X Y, MA P, GAO S G, LIU X Z, LIU G. Evaluation of biocontrol potential of a bacterial strain NCD-2 against cotton Verticillium wilt in field trials. Acta Phytopathologica Sinica, 2005,35(5): 451-455. (in Chinese)
[21]田绍仁, 聂太礼, 王梦亮, 杨军. 拮抗细菌C-02防治棉花黄萎病的机理研究. 棉花学报, 2012, 24(5): 420-426.TIAN S R, NIE T L, WANG M L, YANG J. Study on antagonistic mechanism of bacterium strain C-02 against Verticillium wilt of cotton. Cotton Science, 2012, 24(5): 420-426. (in Chinese)
[22]SCHNATHORST W C, MATHRE D E. Cross protection in cotton with strains of Verticillium albo-atrum. Phytopathology, 1996, 56:1204-1209.
[23]VAGELAS I, LEONTOPOULOS S. Cross-protection of cotton against Verticillium wilt by Verticillium nigrescens. Emirates Journal of Food and Agriculture, 2015, 27(9): 687-691.
[24]BORGES A A, JIMÉNEZ-ARIAS D, EXPÓSITO-RODRÍGUEZ M,SANDALIO L M, PÉREZ J A. Priming crops against biotic and abiotic stresses: MSB as a tool for studying mechanisms. Frontiers in Plant Science, 2014, 5: 642.
[25]薛鑫, 张芊, 吴金霞. 植物体内活性氧的研究及其在植物抗逆方面的应用. 生物技术通报, 2013(10): 6-11.XUE X, ZHANG Q, WU J X. Research of reactive oxygen species in plants and its application on stress tolerance. Biotechnology Bulletin,2013(10): 6-11. (in Chinese)
[26]李莉, 赵越, 马君兰. 苯丙氨酸代谢途径关键酶: PAL、C4H、4CL研究新进展. 生物信息学, 2005, 4(5): 187-189.LI L, ZHAO Y, MA J L. Recent progress on key enzymes: PAL, C4H,4CL of phenylalanine metabolism pathway. China Journal of Bioinformatics, 2005, 4(5): 187-189. (in Chinese)
[27]TUAN P A, LI X, PARK N I, LEE S Y, KIM H H, PARK S U.Molecular cloning of 4-coumarate: CoA ligase and total phenolic content in garlic (Allium sativum). Plant Omics Journal, 2011, 4(1):25-28.
[28]欧阳光察, 薛应龙. 植物苯丙烷类代谢的生理意义及其调控. 植物生理学通讯, 1988(3): 9-16.OUYANG G C, XUE Y L. Physiological role and regulation of phenylpropanoid in plant. Plant Physiology Communications, 1988(3):9-16. (in Chinese)
[29]BHUIYAN N H, SELVARAJ G, WEI Y, KING J. Gene expression profiling and silencing reveal that monolignol biosynthesis plays a critical role in penetration defence in wheat against powdery mildew invasion. Journal of Experimental Botany, 2009, 60(2): 509-521.
[30]MOHAMMADI M, ROOHPARVAR R, TORABI M. Induced chitinase activity in resistant wheat leaves inoculated with an incompatible race of Puccinia striiformis f. sp. tritici, the causal agent of yellow rust disease. Mycopathologia, 2002, 154(3): 119-126.

