尖吻蝮蛇凝血酶在大鼠体内的药代动力学*
邓沁,刘宏,苏薇薇,彭维,吴忠,王永刚,姚宏亮
(中山大学生命科学学院∥广东省中药上市后质量与药效再评价工程技术研究中心,广东 广州 510275)
尖吻蝮蛇凝血酶(Haemocoagulase Acutus,简写为Halase)是本团队从尖吻蝮蛇蛇毒中分离纯化的一种类凝血酶,研究表明其具有较强的止血作用,且无毒[1-6]。本文采用125Ⅰ标记的放射性同位素法(RA)、三氯醋酸沉淀结合放射性检测法(TCA-RA)研究尖吻蝮蛇凝血酶在大鼠体内的药代动力学,为临床应用提供参考,现报道如下。
1 材 料
1.1 试剂与仪器
尖吻蝮蛇凝血酶,实验室自制,纯度大于95%。三氯醋酸,上海化学试剂采购供应站。生理盐水,中国大冢制药有限公司。超纯水,用日本密理博公司的纯水器制备。微机多探头γ-计数器:北京核仪器厂,型号:FJ630G/12。
1.2 实验动物
Wistar大鼠,雌雄兼用,体质量200 g左右,由军事医学科学院四所动物实验中心提供,动物生产合格证医动字第005号。
2 方法与结果
2.1 125Ⅰ-Halase的制备
标记:采用氯胺T法进行尖吻蝮蛇凝血酶的125Ⅰ标记。
纯化:使用Sephadex G50凝胶柱分离纯化125Ⅰ标记物,收集125Ⅰ-Halase 测定放射比活性为52.3 mCi/mg (1 935 MBq/mg),质量浓度为0.84 mCi/mL(31.1 MBq/mL),放化纯度>95%。制备125Ⅰ-Halase色谱图见图1。
生物活性:测定125Ⅰ标记后的尖吻蝮蛇凝血酶在标准血浆中的凝血时间,以检验标记后的Halase生物活性。结果表明标记后不影响样品的生物活性。HPLC分析也证明标记前后色谱行为未改变,见图2。

图1 125Ⅰ-Halase色谱图Fig.1 125Ⅰ-Halase chromatogram

图2 Halase标记前后色谱比较Fig.2 Comparison between labeled Halase and unlabeled HalaseA: 标记前的Halase色谱图; B:标记后的Halase色谱图
2.2 测定方法的建立和验证
2.2.1标准曲线的制备以质量浓度为0.24 μg/mL的尖吻蝮蛇凝血酶(含放射性6.28 μCi/mL)配置标准液,以生理盐水为溶剂,配成质量浓度为0.03、0.06、0.12、0.30、0.60、1.20、3.00和6.00 ng/mL的标准液,各取200 μL标准液置于测定管中,在γ-计数器上测定1 min,将质量浓度与计数值(cpm)绘成标准曲线,标准曲线方程为:Y=25.8+5 660.8X(n=8,r=0.999 9)。
2.2.2校正曲线的制备
(1)RA法制备校正曲线:按标准曲线的尖吻蝮蛇凝血酶质量浓度和相应的125Ⅰ-Halase制备测定血清中尖吻蝮蛇凝血酶的校正曲线,结果显示质量浓度与cpm呈直线相关,校正曲线为:Y=56.3+5 479.8X(n=8,r=0.999 9)。质量浓度为0.12、0.60、6.00 ng/mL时,从血清中用RA法直接测定尖吻蝮蛇凝血酶的回收率,结果见表1 ;其日内、日间测定精密度结果见表2;本法最低能检测到0.03 ng /mL。

表1 血清中125Ⅰ-Halase的回收率(Mean±SD, n=5)Table 1 Percent recovery of 125Ⅰ-Halase in serum (Mean±SD, n=5)

表2 血清中125Ⅰ-Halase的测定精密度(Mean±SD, n=5)Table 2 Precision of 125Ⅰ-Halase in serum (Mean±SD, n=5)
同法制备测定心、脑、肝、肾、肌肉组织中125Ⅰ-Halase的校正曲线,以及尿、粪、胆汁的校正曲线,结果分别为:心:Y= 12.5+5 526.0X(n=8,r=0.999 9);肝:Y= 98.3+5 225.3X(n=8,r=0.999 5);肾:Y=61.4+5 350.1X(n=8,r=0.999 7);脑:Y= 13.3+5 542.5X(n=8,r=0.999 7);肌肉:Y= 68.5+5 338.8X(n=8,r=0.999 9);尿:Y=219.8+4 915.1X(n=8,r=0.999 5);粪:Y=138.0+4 882.7X(n=8,r=0.999 9);胆汁:Y= 17.6+5 653.4X(n=8,r=0.999 9)。
(2)TCA-RA法制备血清校正曲线:按上述血清RA法校正曲线的制作方法,然后每管各加入φ=20%三氯醋酸(TCA)0.2 mL,振荡,离心(3 000 r/min, 10 min),弃去上清液,测定沉淀物中尖吻蝮蛇凝血酶的含量,结果表明浓度与cpm呈直线相关,校正曲线为:A=24.7+4 197.7C(n=8,r=0.999 8)。
同法制备测定心、脑、肝、肾、肌肉三氯醋酸沉淀物中125Ⅰ-Halase的校正曲线,结果分别为:心:A= 43.5+3 892.3C(n=8,r=0.999 8);肝:A= 97.2+3 758.2C(n=8,r=0.999 3);肾:A= 70.8+3 811.1C(n=8,r=0.999 5); 脑:A= 45.4+3 994.0 C (n=8,r=0.999 3);肌肉:A= 86.1+3 969.4C(n=8,r=0.999 4)。
2.3 大鼠静脉给药三剂量的药代动力学研究
2.3.1 RA法
(1)总放射性浓度:本试验根据药效试验所用剂量,在安全、有效的剂量范围内,设计了大鼠静脉给药尖吻蝮蛇凝血酶 0.6、1.2和2.4 μg/kg3个剂量组,每100 g体质量给药体积为0.5 mL,每100 g体质量含125Ⅰ-Halase 3.142 μCi。给药后2、5、15、30 min,1、2、3、4、6、8、12、24、36和48 h 采血,分离出血清,2~30 min各取100 μL血清置于测定管中,1~48 h各取 200 μL血清置于测定管中,测定1 min的放射性。每一时间点6只大鼠,3 雌 3 雄。三剂量血药质量浓度-时间变化趋势比较见图3。

图3 用RA法测得的三剂量的血药质量浓度-时间曲线比较(Mean±SD, n=6)Fig.3 Comparison of plasma concentration-time curves of three doses using RA method(Mean±SD, n=6)
(2)药代参数:将实验数据用中国药理学会数学药理专业委员会的3P97实用药代动力学计算程序自动拟合c-t曲线,计算所得药代动力学参数结果见表3。用RA法所测得的iv血清中总放射性的消除半衰期t1/2β8~10 h,AUC与剂量呈正相关,r为0.999 8。
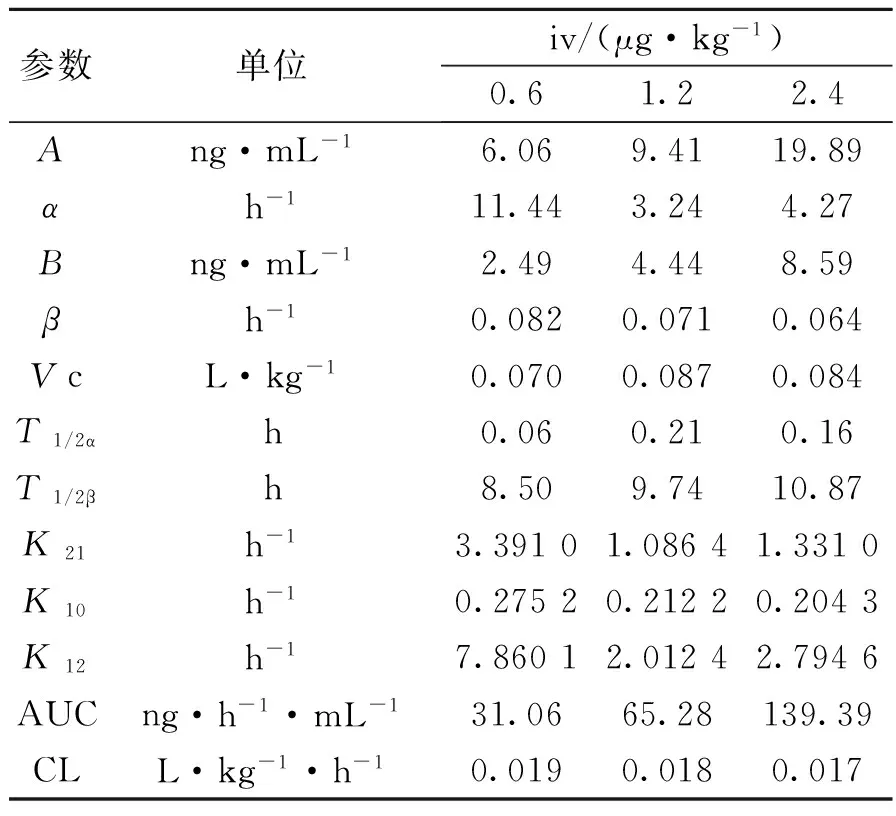
表3 由总放射性测定求得的尖吻蝮蛇凝血酶的药代参数
2.3.2TCA-RA法
(1)血清中尖吻蝮蛇凝血酶质量浓度:本试验设计方案与总放射性测定方案相同,给药剂量与采血时间均同上,采血后取血清200 μL,加等量的φ=20%三氯醋酸,振荡,3 000 r/min,离心10 min,移走上清液,测定1 min沉淀物中的放射性。计算出尖吻蝮蛇凝血酶的质量浓度,每一时间点测定6只大鼠, 3雌3雄。三剂量血药浓度-时间变化趋势比较见图4。结果可见各时间点的尖吻蝮蛇凝血酶质量浓度与剂量相关,质量浓度比总放射性低,消除也比总放射性快。

图4 用TCA-RA法测得的三剂量的血药质量浓度-时间曲线比较(Mean±SD, n=6)Fig.4 Comparison of plasma concentration-time curves of three doses using TCA-RA method(Mean±SD, n=6)
(2)药代参数:将实验数据用中国药理学会数学药理专业委员会的3P97实用药代动力学计算程序自动拟合c-t曲线,计算所得药代动力学参数结果见表4。用TCA-RA法所测得的iv血清沉淀物放射性的消除半衰期t1/2β5~6 h,AUC与剂量呈正相关,r为0.999 0。
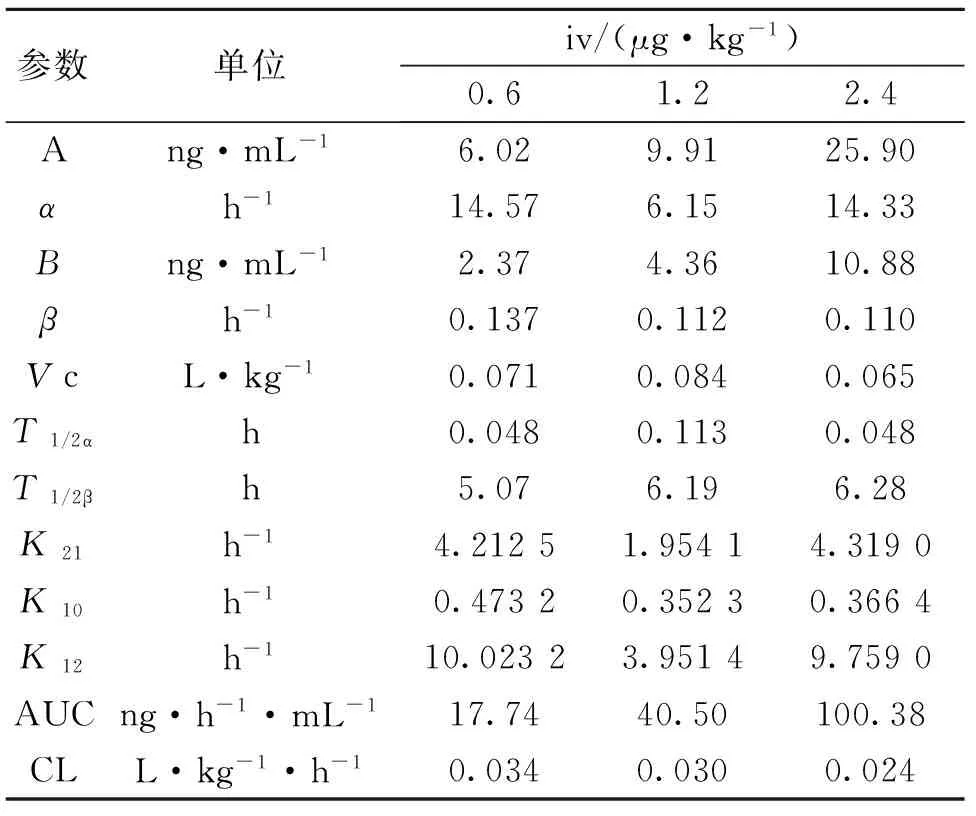
表4 由血清沉淀物含量求得的尖吻蝮蛇凝血酶的药代参数Table 4 Pharmacokinetic parameters of Halase calculated by serum sediments
2.4 组织分布试验
2.4.1RA法测定的总放射性的分布大鼠静脉注射尖吻蝮蛇凝血酶1.2 μg/kg ( 每100 g体质量给药体积为0.5 mL,每100 g体质量含125Ⅰ-Halase 3.142 μCi),给药后5 min、30 min、2 h 、8 h和24 h 处死动物,取全血、脑、心、肺、肝、脾、肾、胃、小肠、肌肉、脂肪、卵巢、子宫和睾丸,每一组织脏器用水按1∶5的比例制成匀浆,取0.4 mL 进行总放射性测定,再根据校正曲线计算出各组织的放射活性含量;每一时间点取样6只动物,雌雄各半。结果见图5,从结果来看: 肝、脾和心在给药后5 min药物含量最高,其他绝大部分组织在给药后 30 min药物含量最高,以后逐渐降低;在各时间点,放射活性以肝组织含药量显著高于其他组织,脾、肺、肾、胃、心等组织含药量较高,脑、脂肪组织含量最低,除肝脏外各组织含药量都小于同期的血药含量。
2.4.2TCA-RA法测定的尖吻蝮蛇凝血酶分布在上述试验的基础上,对组织脏器进行了尖吻蝮蛇凝血酶原型药物的测定。取上述实验所得组织匀浆400 μL,加TCA 400 μL,振荡,3 000 r/min离心10 min,移走上清液,沉淀物进行放射性测定。求得组织中尖吻蝮蛇凝血酶含量。试验结果见图6所列,从结果来看: 肝、脾和心在给药后5 min药物含量最高,其他绝大部分组织在给药后 30 min药物含量最高,以后逐渐降低;在各时间点,放射活性以肝组织含药量显著高于其他组织,脾、肺、肾、胃、心等组织含药量较高,脑、脂肪组织含量最低。此法与RA法所得结果一致。

图5 大鼠静脉注射1.2 μg/kg尖吻蝮蛇凝血酶后用RA法测得的组织分布Fig.5 Tissue distribution detected by RA method in rats injected with 1.2 μg/kg Halase (i.v.)

图6 大鼠静脉注射1.2 μg/kg尖吻蝮蛇凝血酶后用TCA-RA法测得的组织分布Fig.6 Tissue distribution detected by TCA-RA method in rats injected with 1.2 μg/kg Halase (i.v.)
2.5 排泄试验
2.5.1尿排泄Wistar大鼠,雌雄各4只,静脉给药尖吻蝮蛇凝血酶1.2 μg/kg (每100 g体质量给药体积为0.5 mL,每100 g体质量含125Ⅰ-Halase 3.142 μCi ) 后放入代谢笼内,收集给药后0~2、2~4、4~6、6~8、8~12、12~24、24~36、36~48、48~72、72~96 h 的尿样和粪样,尿样稀释并计量,粪样用水制成匀浆后计量。取一定量的尿样置于测定管内,用γ-计数器测定1 min放射活性,见图7。从尿累计排泄量来看,给药后96 h内由尿排出的放射量约占给药剂量的73.52%,表明该药主要是由尿排泄。
2.5.2粪排泄在尿排泄试验收集到的粪样,制成匀浆后,取一定量的粪样置于测定管内, 用γ-计数器测定1 min放射活性,结果见图8,在 96 h 内粪累计排泄量占所给药剂量的 12.13%。
2.5.3胆汁排泄Wistar大鼠6只,雌雄兼用,体质量200 g左右。乌拉坦(1.2 g/kg,ip)麻醉后,胆管插管,iv 给药Halase 1.2 μg/kg ,收集给药后0~2、 2~4、 4~6、6~8、8~12 和12~24 h的胆汁,稀释后计量。取0.2 mL胆汁置于测定管内,用γ-计数器测定1 min放射活性,结果见图9。给药后24 h内由胆汁排出的药量占给药剂量的4.16%。

图7 大鼠静脉注射1.2 μg/kg尖吻蝮蛇血酶后尿排泄曲线Fig.7 Urinary excretion cure of rats injected with 1.2 μg/kg Halase (i.v.)
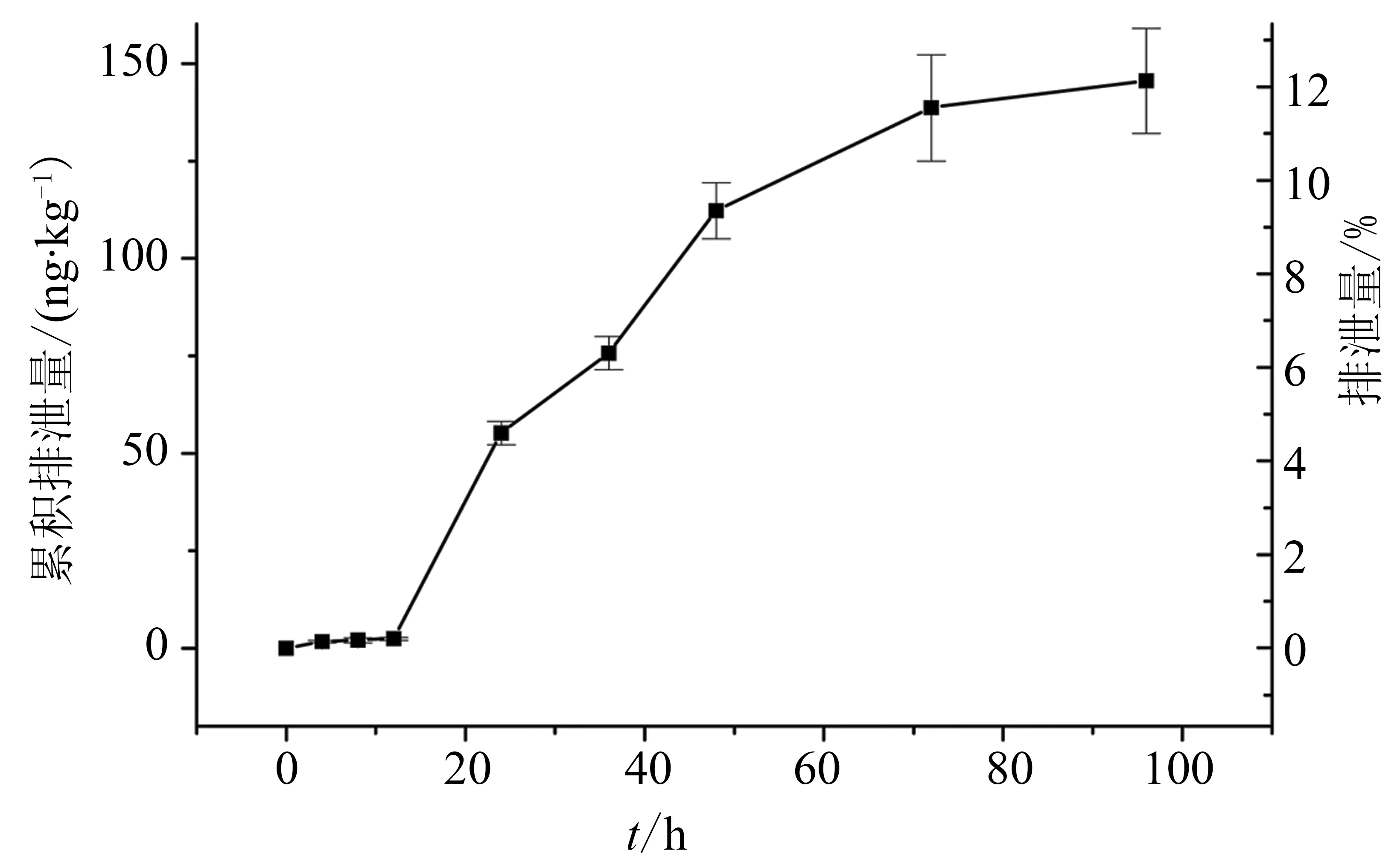
图8 大鼠静脉注射1.2 μg/kg尖吻蝮凝血酶后粪排泄曲线Fig.8 Fecal excretion cure of rats injected with 1.2 μg/kg Halase (i.v.)

图9 大鼠静脉注射1.2 μg/kg尖吻蝮蛇凝血酶后胆汁排泄曲线Fig.9 Bile excretion cure of rats injected with 1.2 μg/kg Halase (i.v.)
3 讨 论
应用放射性同位素法进行药代动力学研究时,测定原型药物是放射性同位素法测定中要解决的关键问题,因为药物进入体内后会被降解,总放射性测定不能代表原型药物,为此采用TCA沉淀蛋白法,使尖吻蝮蛇凝血酶沉淀下来而分解产物及游离125Ⅰ留在上清液中被除去,以使测定结果尽可能接近原型尖吻蝮蛇凝血酶的浓度。
从RA法和TCA-RA法研究的尖吻蝮蛇凝血酶组织分布表明,肝、脾和心在给药后5 min药物含量最高,其他绝大部分组织在给药后 30 min药物含量最高,以后逐渐降低,总放射性与原型药物在各组织分布的大小顺序基本一致。其中在大多数时间肝、脾、肾、肺含药量较高,脑、脂肪含药量较低。
静脉注射给药后96 h内,有给药总量的73.52%由尿中回收,12.13%由粪中回收,这部分可能与分布到胃肠及胆汁排泄有关,24 h内胆汁累积排泄量为4.16%。尿、粪 96 h 的总回收率达到 85.65%,说明尖吻蝮蛇凝血酶的排泄消除去向已较清楚。因此认为尖吻蝮蛇凝血酶排泄较完全,并主要由尿排泄。
尖吻蝮蛇凝血酶是一种糖蛋白,与血浆蛋白无特异性结合,国外文献和新药申报均未见有关蛋白结合报告,而且由于其药效作用(与血浆蛋白的作用)问题,会影响药物与蛋白的分离,不便进行游离药物的测定,因此本研究未测定相关结果。
参考文献:
[1]吴忠. 尖吻蝮蛇凝血酶用作出血性疾病的药物: 中国, CN1218747[P]. 2003-08-14.
[2]吴忠.止血一类新药Halase的药效学研究[J]. 中药材, 2005,28(2): 125-128.
WU Zhong. The pharmacodynamics study of a new hemostatic Halase[J]. Journal of Chinese Medicinal Materials, 2005,28(2):125-128.
[3]苏薇薇.止血一类新药Halase的长期毒性试验[J]. 中药材, 2005,28(3): 211-212.
SU Weiwei. The long-term toxicity test of a new hemostatic Halase[J]. Journal of Chinese Medicinal Materials, 2005,28(3):211-212.
[4]吴忠.止血一类新药Halase的一般药理学研究[J]. 中药材, 2005,28(4): 326-327.
WU Zhong. The general pharmacological study of a new hemostatic Halase[J]. Journal of Chinese Medicinal Materials, 2005,28(4):326-327.
[5]邓沁,吴忠,彭维,等.尖吻蝮蛇凝血酶分离纯化新工艺研究[J].中山大学学报(自然科学版),2016,55(6):161-164.
DENG Qin, WU Zhong, PENG Wei, et al. New process for separation and purification of Haemocoagulase Acutus[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016,55(6):161-164.
[6]邓沁,吴忠,苏薇薇,等.一类新药尖吻蝮蛇凝血酶对SD大鼠围产期生殖毒性试验[J].中南药学,2017,15(6):730-734.
DENG Qin, WU Zhong, SU Weiwei, et al. Perinatal reproductive toxicity of Halase in perinatal Sprague-Dawley rats[J]. Central South Pharmacy, 2017,15(6): 730-734.

