黄花蒿对绿豆种子萌发及幼苗生长的化感效应
, , , , , , ,
(1.贵州师范大学生命科学学院, 贵阳 550001;2.贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室, 贵阳 550001)
黄花蒿(ArtemisiaannuaL.) 又名香蒿、草青蒿、臭青蒿,属菊科艾属一年生草本植物。具有清虚热,除骨蒸,解暑热,截疟,退黄等功效,是我国传统的中草药,也是治疗疟疾药物青蒿素的唯一原料来源[1-3]。黄花蒿植物不仅适应性强、分布广泛、耐贫瘠,还是一种入侵性强的先锋植物,其在山坡、草地、湖边、田间、地里、休闲地皆有生长[4-5],且通过残体分解、根系分泌、地上部分淋溶和挥发作用等逐步将化感物质释放到其周围环境,从而抑制周围植物的生长 (即化感效应),如对黄瓜(CucumissativusL.)、萝卜(RaphanussativusL.)、小麦(TriticumAestivumL.) 及燕麦(AvenasativaL.) 种子及幼苗产生综合抑制效应[6]。将黄花蒿叶片粉碎拌土抑制了红根藜(AmaranthusretroflexL.)、灰菜(ChenopodiumalbumL.)、大豆(GlycinemaxL.) 及玉米(ZeamaysL.) 的种子萌发和幼苗生长[7]。抗疟成分青蒿素是该植物叶片和花蕾中含量较高的成分,研究表明,该化合物对植物种子发芽及生长具有选择性毒害作用[7-9],如青蒿素的乙醇溶液对豇豆和小白菜种子的萌发及幼苗生长发育的抑制作用强于大白菜和菜豆[10]。此外,青蒿素丙酮溶液浸种12 h对绿豆种子的萌发、幼苗生长发育有抑制作用[11]。当然,自然条件下,黄花蒿的化感作用是多种物质综合作用的结果[6],且多以水为介质。其水浸提液对绿豆的化感作用研究甚少,因此,有必要研究黄花蒿的水提取物对该受体的影响。
绿豆(VignaradiataL.) 可在每年的春季或夏季播种,生长周期为70~110 d[12],在贵州常种植于田边、地边,其生长周期与黄花蒿较为一致。因此,本研究采用室内培养,以绿豆为试验对象,通过测定黄花蒿不同部位水浸提液处理后绿豆种子发率、幼苗的根长和苗高及叶片的叶绿素含量,研究其对绿豆萌发及幼苗的化感效应及生理机理,为黄花蒿药材的大面积种植及绿豆的高产管理提供参考。
1 材料与方法
1.1 材 料
黄花蒿采自贵州省贵阳市周边地区。绿豆种子购于当地超市。
1.2 黄花蒿水浸提液的制备方法
野外采集处于现蕾期黄花蒿完整植株,将根、茎、叶分开,根系经冲洗干净,所有样品室内自然风干,粉碎后过100目筛,分装备用。将粉碎后的黄花蒿根、茎、叶样品各称取 80 g,分别放入3个1 000 mL角瓶中,加蒸馏水500 mL,瓶口经密封扎紧后放入振荡器中浸提48 h (振荡温度为 25 ℃,速度为 141 r/min),按浸液样品质量与蒸馏水的比例,即得到浓度为160 mg/mL 的水浸提液,二重纱布过滤,取上清液为水浸提母液,滤液置 4 ℃ 的低温下密封保藏备用[13]。试验时用蒸馏水将各母液分别稀释为设计浓度。
1.3 实验处理及管理
选取饱满、大小一致的绿豆种子,用10% 的H2O2消毒10 min,用蒸馏水冲洗3~5次[14]。黄花蒿根、茎、叶的水浸提液处理均设0,20,40,80,160 mg/mL共 5个浓度梯度,并以蒸馏水作为对照 (即0 g/mL),每处理均重复3次[13]。
在直径为10 cm培养皿中铺3层定性滤纸,分别将不同处理黄花蒿水浸提液10 mL注入培养皿,将上述处理后的绿豆种子均匀放入,每皿播种 40粒种子。25 ℃的光照培养箱中发芽,光照均为 10 h/d ,从第 3天起在25 ℃、光照12 h条件下培养。每天定量补充水浸提液5 mL,保持湿润[13]。
1.4 各项指标测定
种子处理后第2天开始记录种子发芽个数,种子发芽均以芽长大于1 mm 为标准,以后每24 h 调查其发芽种子数。处理后第12天,测量各处理幼苗的根长、苗长[15],并测定叶绿素含量。叶绿素a和叶绿素b含量的测定,每处理分别取0.5 g叶片剪碎研磨,采用分光光度法[16]。
1.5 数据统计
萌发率(%)=规定时间内种子发芽数/供试种子总数×100%。
化感效应数据统计分析方法参照 Williamson G B.(1988) 的方法[17]。即:RI=1-C/T,式中,C为对照值,T为处理值。RI为化感效应指数。RI>0为促进作用,RI<0为抑制作用,负值绝对值的大小与化感强度一致,负值越小或负值的绝对值越大,化感效应越强。通过此公式,可以计算出黄花蒿水浸提液对种子萌发和幼苗生长的RI。
用Excel 进行基础数据统计分析和作图,SPSS软件做多重比较和显著性分析。
2 结果与分析
2.1 黄花蒿水浸提液对绿豆种子萌发率的影响
由图1可知,不同浓度黄花蒿水浸提液处理后,对绿豆萌发率有不同程度抑制作用,均表现为随黄花蒿水浸提液浓度增加,萌发率逐渐降低的趋势。各部位水浸提液处理后,绿豆萌发率也有差异,对绿豆萌发率抑制强弱顺为:叶>茎>根。
表1黄花蒿各部位水浸提液对绿豆幼苗生长的化感效应
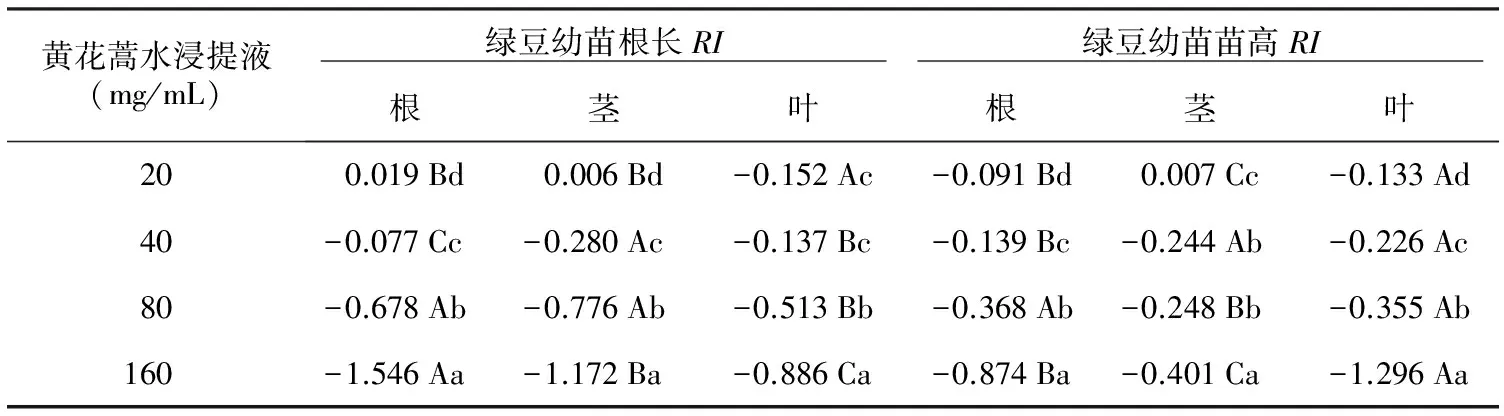
黄花蒿水浸提液(mg/mL) 绿豆幼苗根长RI 绿豆幼苗苗高RI 根茎叶根茎叶200.019Bd0.006Bd-0.152Ac-0.091Bd0.007Cc-0.133Ad40-0.077Cc-0.280Ac-0.137Bc-0.139Bc-0.244Ab-0.226Ac80-0.678Ab-0.776Ab-0.513Bb-0.368Ab-0.248Bb-0.355Ab160-1.546Aa-1.172Ba-0.886Ca-0.874Ba-0.401Ca-1.296Aa
注:表中绿豆幼苗根长和苗高RI分别表示黄花蒿水浸提液对绿豆幼苗的根系长度和幼苗高度的化感效应指数;表中的根、茎、叶表示黄花蒿各部位的水浸提液;RI数值越小或负值的绝对值越大,表明黄花蒿水浸提液对绿豆幼苗生长的化感作用越强;小写字母不同者表示同列不同数值之间的差异显著, 大写字母不同者表示黄花蒿各部位的同一浓度水浸提液对同一幼苗生长指标之间的RI差异显著 (p<0.05)。
由图2可看出,黄花蒿不同部位、不同浓度水浸提液,除20 mg/mL根水浸提液浓度对绿豆种子萌发具有促进作用外,其他各处理均有不同程度的抑制作用,并且随处理浓度增加,RI为负值越小,说明对绿豆种子萌发的化感效应增强。各部位处理浓度,除茎水浸提液浓度为80 mg/mL和160 mg/mL不显著以外,其余各浓度之间差异均显著 (p<0.05)。但是黄花蒿不同部位水浸提液对绿豆化感效应的响应不同,表现为根水浸提液化感作用较小,其次是茎水浸提液,受叶水浸提液的影响最大。

注:图中的根、茎、叶表示黄花蒿各部位的水浸提液。下同。图1 黄花蒿不同浓度水浸提液对绿豆种子萌发率的影响

注:不同大写字母表示不同部位同一浓度之间差异显著(p<0.05);不同小写字母表示同一部位不同浓度之间差异显著(p<0.05)。数值越小或负值的绝对值越大, 表明黄花蒿水浸提液对绿豆种子的化感作用越强。图2 黄花蒿不同部位不同浓度水浸提液对绿豆种子的化感效应
2.2 黄花蒿水浸提液对绿豆幼苗生长的影响
由图3可看出,绿豆幼苗的平均根长,除了根和茎的20 mg/mL水浸提液处理下比对照略有增加以外,其余各处理均随浓度升高,根长有不同程度的减少,可见根和茎的水浸提液表现为对根系生长的低促高抑作用,但叶水浸提液处理的根系明显受到抑制,且随处理浓度增加,抑制作用增强。图3 B显示,绿豆幼苗的平均苗高,除20 mg/mL茎水浸提液比对照略有提高外,其余各处理都表现为抑制作用,且随处理浓度升高,抑制作用增强,与对照相比,根、茎、叶160 mg/mL水浸提液处理的绿豆苗高分别降低了46.29%,47.67%和 56.48%。

图3 黄花蒿不同浓度水浸提液对绿豆幼苗生长发育的影响
从表1可以看出,黄花蒿水浸提液对绿豆幼苗根长的RI值,除了20 mg/mL根、茎水浸提液处理绿豆幼苗根长的RI为正数外 (即为促进作用),其余均为负数,且随处理浓度增加,RI的绝对值增加。黄花蒿水浸提液对于绿豆幼苗高度的RI,除了20 mg/mL茎水浸提液对幼苗苗高的RI为正数,其余为负值,表现与根长的RI相似。表明低浓度处理下对绿豆幼苗生长有促进作用,但随浓度升高化感效应逐步增强。
2.3 黄花蒿水浸提液对绿豆幼苗叶绿素含量的影响
图4显示了黄花蒿水浸提液对绿豆幼苗叶绿素 a 含量的影响。不同浓度黄花蒿水浸提液处理后,绿豆幼苗叶绿素 a 含量都降低,且表现为:随着黄花蒿水浸提液浓度的增加,叶绿素 a 含量逐渐降低的趋势。茎和叶水浸提液对叶绿素a含量的影响比根水浸提液大,与对照相比,在160 mg/mL根、茎、叶水浸提液处理的绿豆苗叶绿素 a 含量降幅分别为:0.76,0.91 mg/g和1.08 mg/g。与对叶绿素 a 含量的变化相似,也随处理浓度增加,黄花蒿水浸提液对绿豆幼苗叶绿素 b 含量的影响程度增大,与对照相比,根、茎、叶水浸提液 80 mg/mL处理的叶绿素 b 含量分别降低了25.29%、19.27%、11.93%,160 mg/mL处理的叶绿素 b 含量分别降低了34.86%,30.28%、18.35%。不同的是,除了20 mg/mL茎水浸提液处理外,对绿豆幼苗叶绿素b含量的影响程度表现为:根>茎>叶。

图4 黄花蒿不同部位水浸提液对绿豆幼苗叶绿素含量的影响
3 结果与讨论
化感效应是自然界中普遍存在的现象。许多植物通过向环境中释放化感物质,抑制周围植物的生长,使自己的生存处于优势地位[18-19]。空心莲子草(Alternantheraphiloxeroide)水浸提液高于0.04 g/mL对生菜和萝卜种子萌发有明显的抑制作用,并影响植物叶片的酶活性[13]。黄顶菊(Flaveriabidentis)水浸提液对油菜和油麦的种子发芽和幼苗生长有抑制作用[20]。甚至番茄根系的分泌物抑制自身生长[21]。黄花蒿通过多种途径向其周围环境释放化感物质,控制周围植物生长[2,5]。本研究表明,黄花蒿水浸提液对绿豆种子萌发均有不同程度的影响,并且随处理浓度增加化感效应增强,但各部位水浸提液对种子萌发的化感效应有明显差异,强弱趋势为:叶>茎>根。因此,建议在生产中,要将黄花蒿的残体彻底清除,以减轻黄花蒿经雨水淋溶或腐解对下茬作物造成的化感抑制作用。同时黄花蒿水浸提液对绿豆幼苗的根系和幼苗生长,除低浓度茎、根水浸提液 (20 mg/mL)外,均表现为抑制作用,且随浓度增加化感效应增强,此结果与前人的研究有相似之处[13,21]。与对照相比,根、茎、叶160 mg/mL水浸提液处理下,绿豆幼苗平均根长缩短了60.51%、53.78%、46.76%,平均苗高最大降幅为46.29%、47.67% 和 56.48%。可见在绿豆种植过程中需加强周边环境管理,清除野生黄花蒿的生长,以确保绿豆植物茂盛生长,利于其产量提高。
入侵植物的化感效应还表现在:使受体植物叶绿素含量降低,光合作用减弱,最终消亡。沈慧敏的研究表明黄花蒿通过释放化感物质,使燕麦的叶绿素a和叶绿素b含量降低,光合作用受到阻碍[6]。本研究黄花蒿各部位不同浓度水浸提液处理后的绿豆幼苗叶绿素a和叶绿素b含量均降低,且随处理浓度增加,抑制作用增强。与对照相比,根、茎、叶160 mg/mL水浸提液处理的绿豆幼苗叶绿素a含量最高降幅分别为17.84%、21.36%、25.35%;叶绿素b含量最高降幅分别为34.86%、30.28%、18.35%。可见黄花蒿可通过抑制受体植物叶绿素的合成,从而使其生长发育受到抑制。
本研究对绿豆的生产管理提供了一定的理论依据,但只是简单的室内试验,而在自然条件下,其化感作用是极其复杂的,光照、土壤、水分等都会对其产生影响[19]。因此,还需盆栽和田间试验进一步论证其影响程度。
参考文献:
[1]国家药典委员会.中华人民共和国药典(第一部)[M].北京:中国医药科技出版社,2015:198.
[2]慕小倩,马燕,王硕,等.黄花蒿化感作用机理的初步研究[J].西北植物学报,2005,25(5):1 025-1 028.
[3]马进,向极钎,杨永康,等.黄花蒿新品种选育现状及其系统选育研究进展[J].湖北农业科学,2014,53(19):4 520-4 524.
[4]王三根,梁颖.中药青蒿的生态生理及其综合利用[J].中国野生植物资源,2003,22(4):47-50.
[5]王硕,慕小倩,杨超,等.黄花蒿浸提液对小麦幼苗的化感作用及其机理研究[J].西北农林科技大学学报,2006,34(6):106-110.
[6]沈慧敏.黄花蒿(ArtemisiaannuaL.)化感物质释放途径及化感作用机理研究[D].甘肃农业大学,2006:51-60.
[7]Lyden J,Teasdale JR,Chen PK.Allelopathic activity of annul wormwood (Artemisiaannua),is a selective Phytotoxin[J].Journal of Weed Science,1997,45(6):807-811.
[8]Chen PK,Leather GR.Plant growth regulatory activities of artemisinin and its related compounds[J].Journal of chemical ecology,1990,16(6):1 867-1 876.
[9]Duke SO,Vaughn KC,Emjr C,et al.Artemisinin, a constituent of annual wormwood (Artemisiaannua),is a selective phytotoxin[J].Weed science,1987,35(4):499-505.
[10]白祯,黄玥,黄建国.青蒿素对蔬菜种子发芽和幼苗生长的化感效应[J].生态学报,2013,33(23):7 576-7 582.
[11]张警方,薛兰兰,来庆捷,等.青蒿素对绿豆种子萌发及幼苗生长发育的影响[J].天津农业科学,2016,22(11):127-129.
[12]屈洋,高小丽,任慧莉,等.关中西部不同绿豆品系的产量和光温水特性[J].干旱地区农业研究,2016,34(6):75-80.
[13]张志忠,石秋香,孙志浩,等.入侵植物空心莲子草对生菜和萝卜的化感效应[J].草业学报,2013,22(1):288-293.
[14]高阳,朱双丽,吴庆珊,等.金钗石斛IAA内生细菌筛选及对干旱胁迫下玉米种子萌发的影响[J].种子,2017,36(4):36-40.
[15]尹秀,邓云天,罗新勇,等.盐胁迫和干旱胁迫对藏药甘青青兰种子萌发的影响[J].种子,2017,36(4):17-20.
[16]白宝璋.植物生理学(实验教程)(第二版)[M].北京:中国农业科技出版社,1998:65-67.
[17]Williamson,GB.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Journal of Chemical Ecology,1988,14(1):181-187.
[18]Gao YM,Li J S,Apahidean ALS.The study opriming of carrot seed on solid medium[J].Buletin University of Agricultural Sciences and Veterinary Medicine,Clu Napoca,Romania,2005,62:31-35.
[19]肖辉林,彭少麟,郑煜基,等.植物化感物质及化感潜力与土壤养分的相互影响[J].应用生态学报,2006,17(9):1 747-1 750.
[20]芦站根,周文杰,郑博颖,等.黄顶菊对两种蔬菜种子和幼苗的化感作用[J].草业科学,2011,28(2):251-254.
[21]刘易,蒋桂英,简健平,等.加工番茄根系分泌物自毒效应的研究[J].西北农业学报,2009(4):106-112.

