不同浓度赤霉素对长果绿绒蒿种子萌发特性的影响
, , , ,
(西南林业大学园林学院,园林植物与观赏园艺省高校重点实验室, 昆明 650224)
长果绿绒蒿为罂粟科绿绒蒿属多年生草本植物,主根圆柱形,上部粗约5 mm,向下延长并渐狭。特产于云南丽江玉龙山至鹤庆,生于海拔2 700~4 000 m的草坡[1]。长果绿绒蒿外形挺拔,紫色花瓣,娇艳美丽,可用于室内盆栽,极具观赏价值[2]。
绿绒蒿属植物具有极高的园林和药用价值,但种子萌发率较低,幼苗补充少,加上生活环境的破坏和过度的采挖,导致绿绒蒿属植物常以小物种群分布于狭小的范围内。引种常年生于高寒山区、生态幅度较小的绿绒蒿时,以种子进行繁殖比移植效果更好[3]。如何有效地打破种子休眠促进种子萌发,促进幼苗生长是亟待解决的问题。因此,研究长果绿绒蒿种子的萌发特性及其在不同浓度的赤霉素(GA3)处理下萌发特性的差异,探寻提高其种子发芽率的有效方法,为保护、引种和驯化这一珍贵的园林植物资源以及今后的推广栽培及应用提供参考[4]。
赤霉素是五大常见激素之一,至今发现100多种,总称赤霉素类(GAs)[5]。赤霉素作为一种高效的植物激素,是植物生长发育过程中的一种重要调节物质,能够代替低温层积打破种子休眠[6-7],影响着植物生长的各个阶段,如种子萌发、茎的伸长、花的诱导和发育、种子和果实的生长化[8-10]等阶段,这已经在很多种植物上得到证实[11]。近年来,有关赤霉素对禾谷类及其他作物种子例如豌豆、烟草等发芽过程中的生物性状植物茎叶生长的影响研究较多[12-13],但不同浓度赤霉素(GA3)对长果绿绒蒿种子萌发差异性的研究尚未见报道[4]。本研究采用不同浓度的赤霉素(GA3)溶液浸泡长果绿绒蒿种子进行比较试验,筛选并确定提高长果绿绒蒿种子发芽率的最佳方案。
1 材料与方法
1.1 植物材料与种源地概况
供试材料为采自云南丽江玉龙雪山的长果绿绒蒿(Meconopsisdelavayi(Fr.)Fr.ex Pram)野生群体(海拔4 221 m)种子,种子充分混合均匀,避免单株植物对种子萌发的影响[4],供试种子均成熟饱满,自然干燥后保存备用。
1.2 形态指标测定
1.2.1形态特征测定
混合取样,随机抽取50粒长果绿绒蒿种子为1个处理,用游标卡尺分别测量种子的长和宽,每个处理重复3次,共计150粒长果绿绒蒿种子,取平均值计算种子的长宽比。
1.2.2种子千粒重的测定
千粒重是在气干状态下1 000粒种子的重量,以g为单位[14]。本实验用千粒法来测种子千粒重。
从干燥好备用的种子中随机抽取3组,每组抽取1 000粒,用万分之一天平分别对各组的种子进行测重,最后取3组平均值计算千粒重。
1.2.3种子含水量的测定
随机抽取100粒种子,称量(m1),放入100 ℃的烘干箱中12 h,取出后在干燥器中冷却至室温后再称重量(m2),计算含水量(%)=(m1-m2)/m1×100%,重复3次,最后取3组的平均值[5]。
1.3 种子萌发及萌发指标测定
1.3.1种子萌发实验
将种子用0.2%的双氧水消毒30 s,然后用蒸馏水漂洗2遍,分别放在不同浓度(50,100,150,200,250,300 mg/L)的GA3溶液中浸泡12 h,以蒸馏水浸泡12 h的种子(ck)为对照[12,15]。然后将处理好的种子放在铺有无菌滤纸的培养皿中,放在温度为20 ℃,湿度为70%,光照强度12.5μmol/(m2·s)的恒温培养箱中进行培养。每个处理重复3次,每次重复均随机选取100粒种子[16]。每天定时观察,并保证滤纸湿润。
1.3.2萌发指标测定
每天统计发芽的种子数,以芽长与种子等长作为发芽标准[4]。
本实验发芽天数为80 d,以80 d内的发芽总数计算发芽率(%)=已发芽种子数/供试种子总数×100%;以种子发芽达到高峰期(第58天,即萌发量最大的时间距试验开始的天数[18])时的发芽率作为发芽速度;以第58天的发芽率作为发芽势,发芽势(%)=第58天发芽种子数/供试种子总数×100%[19];并计算发芽指数,发芽指数=∑(Gt/Dt)(式中,Gt为在t日的发芽数,Dt为相应的发芽日数)[20];计算平均发芽时间=∑(D×n)/∑n(式中,D是指从种子置床起算的天数,n为相应天数的发芽粒数)[4,17,21]。
1.3.3数据分析
对不同种子的千粒重、长宽比、含水量、发芽势、发芽率进行单因素方差分析(One-way,ANOVA)并与GA3浓度进行相关性分析。当统计数据方差具有齐性时,选择LSD(least significant difference)进行比较;当统计数据方差不具有齐性时,选择Games-Howell方法进行比较。所有数据处理均采用SPSS 21.0完成,p<0.05为差异显著,p<0.001为差异极显著[4]。
2 试验结果
2.1 不同浓度GA3处理对长果绿绒蒿种子形态特征的影响
种子的长宽比均处于3.17~3.33范围内,千粒重均在1.27~1.39 g之间,种子含水量均处于5.7%~7.4%范围内(表1)。
表1长果绿绒蒿种子的形态特特征

种名种子长宽比千粒重(g)种子含水量(%)长果绿绒蒿种子3.25±0.081.33±0.066.55±0.85
2.2 不同浓度GA3处理对长果绿绒蒿种子萌发的影响
2.2.1不同GA3浓度对长果绿绒蒿种子发芽率的影响
表2不同浓度赤霉素对长果绿绒蒿影响的各指标比较结果
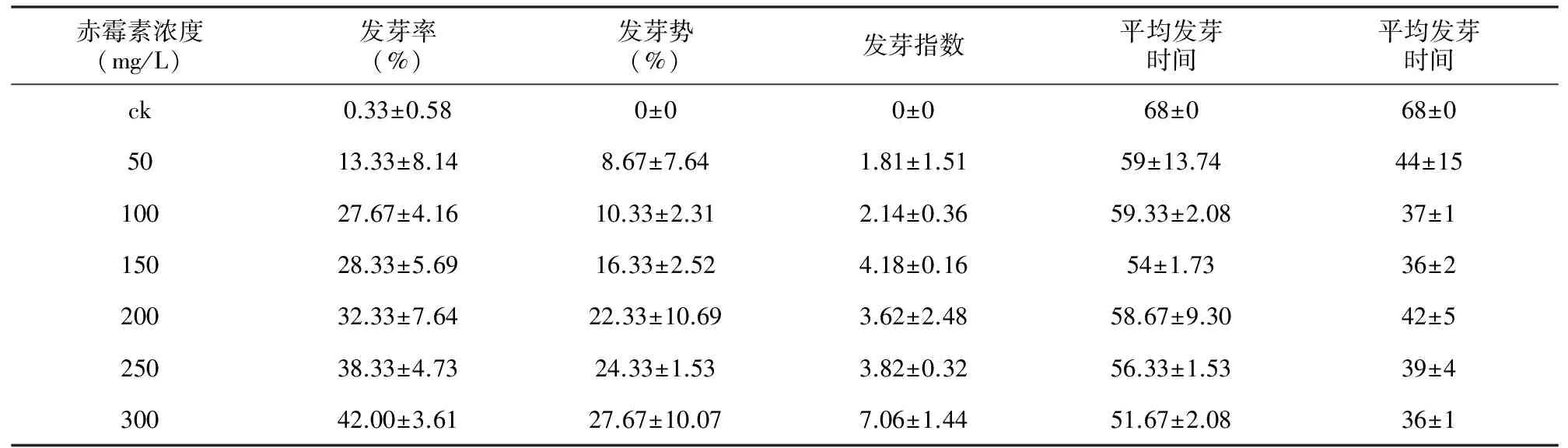
赤霉素浓度(mg/L)发芽率(%)发芽势(%)发芽指数平均发芽时间平均发芽时间ck0.33±0.580±00±068±068±05013.33±8.148.67±7.641.81±1.5159±13.7444±1510027.67±4.1610.33±2.312.14±0.3659.33±2.0837±115028.33±5.6916.33±2.524.18±0.1654±1.7336±220032.33±7.6422.33±10.693.62±2.4858.67±9.3042±525038.33±4.7324.33±1.533.82±0.3256.33±1.5339±430042.00±3.6127.67±10.077.06±1.4451.67±2.0836±1
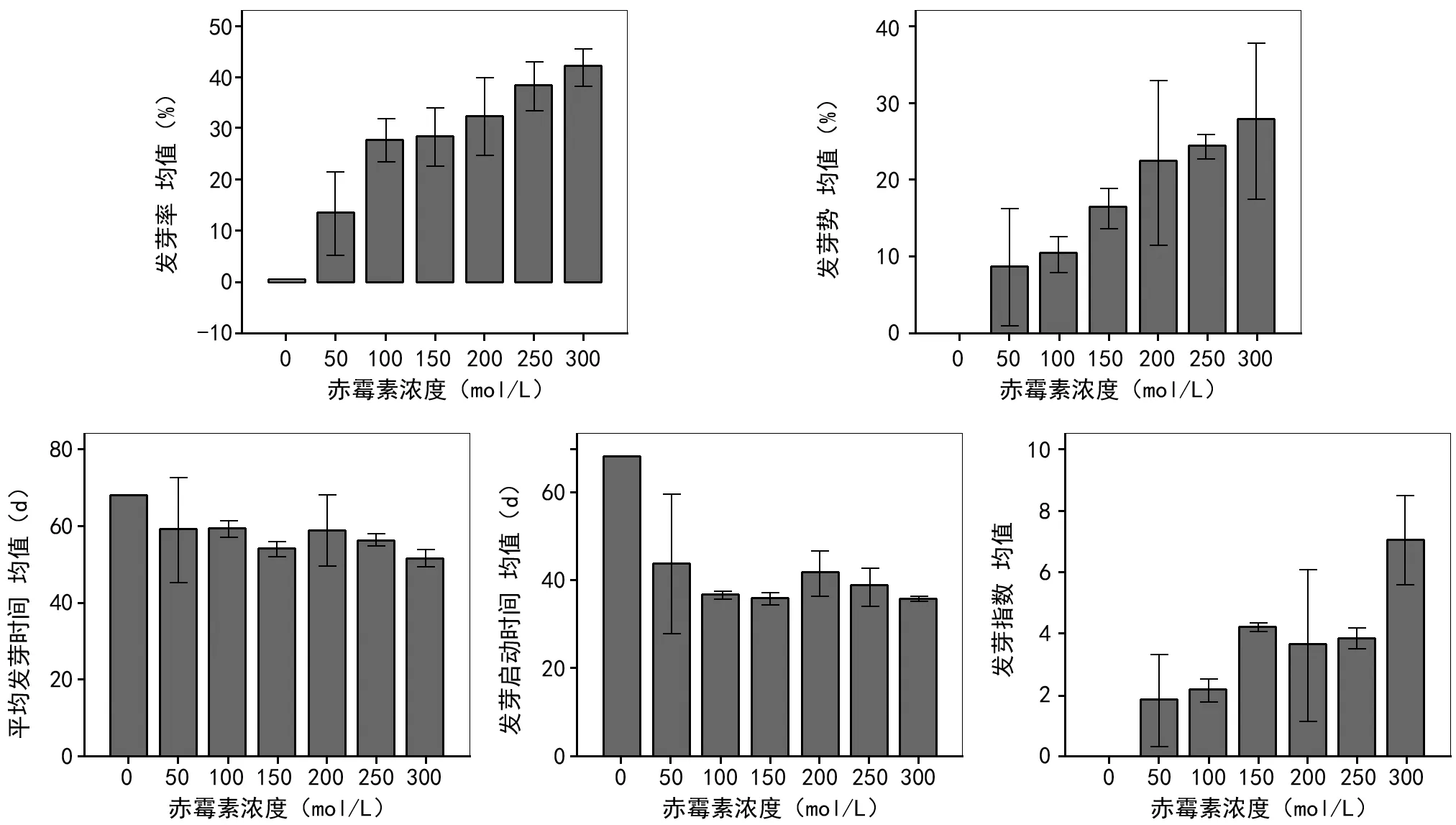
图1 不同浓度赤霉素处理下种子的萌发特性
清水处理(ck)的种子并没有发芽,但经不同浓度的赤霉素(GA3)处理的种子发芽率基本高于对照,且不同处理间差异极显著(F=21.26,p<0.001)。这说明GA3能促进长果绿绒蒿种子的发芽。GA3浓度为0~300 mg/L时,种子的发芽率随GA3浓度的升高而呈上升趋势。GA3浓度为50 mg/L时种子发芽率较低,在50~150 mg/L之间有较少的种子萌发,200~300 mg/L之间种子萌发较多,当赤霉素浓度达到300 mg/L时种子的萌发率达到最高值,这说明长果绿绒蒿种子最适萌发是GA3浓度为200~300 mg/L之间(表2和图1)。
2.2.2不同GA3浓度对长果绿绒蒿种子发芽势的影响
清水处理的情况下,种子发芽势为0。而经过GA3处理的长果绿绒蒿种子发芽势均大于对照,说明GA3处理能显著提高长果绿绒蒿的发芽势。不同浓度处理之间差异显著(F=7.13,p<0.05)。种子的发芽势在GA3浓度为50 mg/L时仅为8.67%;当GA3浓度达到300 mg/L时,种子的发芽势达到最高值(27.67%)(表2和图1)。
2.2.3不同GA3浓度对长果绿绒蒿种子平均发芽时间的影响
清水处理的对照种子平均发芽时间为68 d。经过GA3处理的长果绿绒蒿的平均发芽时间明显短于清水对照组,且不同浓度处理间差异极显著(F=3.29,p<0.05),说明GA3可以显著缩短种子的平均发芽时间。同时,当GA3浓度在150~300 mg/L之间时,长果绿绒蒿种子的平均发芽时间均为60 d以内,当GA3浓度为300 mg/L时,种子的平均发芽时间最短,为51.67 d(表2和图1)。
2.2.4不同GA3浓度对长果绿绒蒿种子发芽启动时间的影响
清水处理的对照种子发芽启动时间是第68天。经过GA3处理的种子发芽启动时间较ck组的种子明显提前,且不同浓度处理间差异显著(F=3.21,p<0.05),这表明GA3显著缩短长果绿绒蒿种子的发芽启动时间。其中赤霉素浓度为150,300 mg/L时,发芽启动时间为第36天,其次是浓度为100 mg/L时,发芽启动时间为第37天,这说明GA3浓度为150,300 mg/L时,种子萌发快,发芽能力较强(表2和图1)。
2.2.5不同GA3浓度对长果绿绒蒿种子发芽指数的影响
清水处理(ck)的种子发芽指数为零,不同GA3浓度处理的长果绿绒蒿种子发芽指数与对照组相比有显著提高, 且不同浓度处理间差异显著(F=9.66,p<0.001)。与对照组相比,GA3为300 mg/L时种子发芽指数最高,达到7.06%;当GA3浓度为50 mg/L时,种子的发芽指数最低,仅为1.81%(表2和图1)。
综上所述,整个发芽期间,与清水处理的对照组相比,GA3浓度为50~300 mg/L时均能有效促进长果绿绒蒿种子的萌发,并加速发芽启动时间,缩短平均发芽时间,其中以200~300mg/L最为理想。使用适量的GA3处理可以大大提高长果绿绒蒿种子的发芽速度和整齐程度。
3 结论与讨论
植物种子的休眠是植物经过长期进化和演变从而获得一种对不利环境及季节变化的生物学适应性[22],不经过处理的新鲜长果绿绒蒿种子休眠时间长且发芽时间很长,发芽速度慢、整齐度差[4]。
赤霉素是植物常用的一种生长调节剂,可以提高种子水解酶的活性,使贮藏物质大量分解[23],不同浓度的GA3处理种子,对种子的萌发以及幼苗都有非常明显的促进作用[19,24-26],但不一定浓度越高越好,浓度太高既增加成本,且效果也不一定好[27]。较高浓度(200~600 mg/L)GA3处理欧洲百里香能显著提高欧洲百里香种子的发芽势、发芽率和发芽指数,较低浓度(100 mg/L)的GA3处理能显著促进欧洲百里香幼苗的生长,≥600 mg/L的高浓度赤霉素处理会显著抑制欧洲百里香幼苗根的生长,但对其芽长无显著影响[28]。因此选择合适的GA3浓度处理是长果绿绒蒿育苗成功的关键。
很多研究表明,GA3浓度对种子的影响会随着物种的不同而有差异。研究发现,苦瓜种子经10 mg/L的GA3浸泡12 h的发芽率最高,对苗高生长影响最大[29];GA3浸种可显著提高醉蝶花种子的发芽率和发芽指数,最佳的浸种浓度为150 mg/L,但对其发芽时间并没有影响[20];用浓度为250 mg/L的GA3处理蜡梅种子,种子发芽势和发芽率高达41.7%和95.8%[30];研究表明,绿绒蒿大部分种类都存在相似的休眠方式,在10 h/d的光照以及(20±2)℃的条件下,用100 mg/L的GA3处理能有效提高锥花绿绒蒿和单叶绿绒蒿种子萌发率[17]。而采用浓度为100~250 mg/L的GA3对总状绿绒蒿进行浸种处理12 h可明显提高总状绿绒蒿各居群种子的发芽率和发芽势,但对于各居群种子的平均发芽时间无显著影响[4]。本研究发现,使用适宜的GA3溶液对长果绿绒蒿进行浸种处理,都可以提高长果绿绒蒿种子的发芽率,尤其是浓度为200~300 mg/L的GA3浸种处理12 h时,可明显提高长果绿绒蒿各组种子的发芽率、发芽势和发芽指数,缩短平均发芽时间。但GA3浓度是否对物种的萌发指标产生选择性影响还有待进一步研究[4]。
总之,种子的形态及萌发特性是植物长期适应环境的表现[4]。赤霉素能够抑制种子的过氧化氢酶,增加自由生长素含量,提高细胞膜透性,促进细胞生长,加快同化物和储藏物的流动从而提高种子的发芽势,可加快育苗进度增加经济效益[31]。但用不同浓度GA3对长果绿绒蒿种子进行浸种处理对种子的形态特点以及萌发特性产生的差异性影响是否与遗传机制有关,还有待进一步研究。
参考文献:
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999,32:41.
[2]吴征镒,庄璇.绿绒蒿属分类系统的研究[J].云南植物研究,1980,2(4):371-381.
[3]董晓东,赵宏,马玉心.云南绿绒蒿植物种质资源及评价[J].大理师专学报(自然科学版),1995(1):42-46.
[4]屈燕,区智,尤小婷,等.赤霉素对总状绿绒蒿三个居群种子萌发特性的影响[J].植物生理学报,2014,50(9):1 374-1 378.
[5]Hedden P,Kamiya Y.GIBBERELLIN BIOSYNTHESIS:Enzymes,Genes and Their Regulation.[J].Annual Review of Plant Physiology & Plant Molecular Biology,1997(48):431.
[6]陈云风.赤霉素和NaCl对棉花种子萌发的影响研究[J].种子,2015,34(11):97-99.
[7]冯斐,温苏雅勒图,李钢铁,等.GA3对酸枣种子发芽率与出苗率的影响[J].内蒙古林业科技,2017,43(1):23-25.
[8]朱建荣,赵丽萍,姚丽,等.不同浓度赤霉素对甘蔗实生苗产量性状的影响[J].安徽农业科学,2016,44(36):19-20.
[9]申惠翡,赵冰,黄文梅,等.温度和赤霉素对金背杜鹃种子萌发和幼苗生长的影响[J].江苏农业科学,2016,44(6):281-282,283.
[10]付远洪,钱沉鱼,李朝婵,等.不同浓度赤霉素对伴娘山月桂种子萌发的影响[J].种子,2017,36(2):5-8.
[11]张旺凡,沈素贞,梁文斌,等.七叶一枝花种子萌发特性研究[J].中国野生植物资源,2013,32(5):16-20.
[12]余海云,石元值,马立锋,等.茶树树冠不同冠层叶片光合作用特性的研究[J].茶叶科学,2013,33(6):505-511.
[13]高春智,何炎红,田有亮,等.不同浓度赤霉素浸种对樟子松种子萌发和幼苗生长的影响[J].内蒙古农业大学学报(自然科学版),2012(33):67-72.
[14]成林,张志红,方文松,等.干热风对冬小麦灌浆速率和千粒重的影响[J].麦类作物学报,2014,34(2):248-254.
[15]代勋,李忠光,龚明,等.赤霉素、钙和甜菜碱对小桐子种子萌发及幼苗抗低温和干旱的影响[J].植物科学学报,2012,30(2):204-212.
[16]宋发军,罗忠,黄珍,等.赤霉素处理对重楼种子萌发相关生理指标的影响[J].中南民族大学学报(自然科学版),2016,35(3):30-34.
[17]屈燕,区智.绿绒蒿属植物国内外研究进展[J].北方园艺,2014,50(9):191-194.
[18]罗登攀,刘道凤,马婧,等.蜡梅种子休眠原因浅析及赤霉素对种子萌发的影响[J].北方园艺,2015(1):83-86.
[19]蹇黎.赤霉素对喀斯特山区野生燕麦种子萌发的影响[J].种子,2016,35(10):102-104.
[20]刘春风,刘玉华,王磊,等.赤霉素与低温处理对短柱铁线莲种子萌发的影响[J].种子,2016,35(12):83-86.
[21]杨阳,刘秉儒,贾倩民,等.赤霉素对干旱胁迫下沙冬青种子萌发的影响[J].江苏农业科学,2014,42(5):271-275.
[22]吴海波,宋博洋,张烁,等.种子休眠与萌发研究中若干问题的探讨[J].种子,2017,36(1):76-81.
[23]王得贤.几种药剂处理对甘草种子萌发的影响[J].种子,2004,23(1):23-24.
[24]刘美茹,李金还,牛建行,等.赤霉素与化学试剂提高羊草种子萌发率及活力的比较研究[J].西南农业学报,2014,27(6):2 687-2 691.
[25]李义强,宋桂龙,郭宇.水浸与赤霉素处理对荆条种子萌发影响研究[J].种子,2012,31(3):10-13.
[26]徐小玉,张凤银,曹阳.赤霉素和乙烯利对美女樱种子萌发及幼苗生长的影响[J].种子,2014,33(6):72-74.
[27]于延球,杨谦.赤霉素处理对西瓜种子发芽率的影响[J].安徽农业科学,2013,41(6):2 422,2 428.
[28]闫芳,张春梅,王勤礼,等.赤霉素浸种对欧洲百里香种子萌发和幼苗生长的影响[J].种子,2012,31(12):74-76.
[29]李刚,刘晓明,郎德山,等.不同处理方法对苦瓜种子萌发的影响[J].安徽农业科学,2015,(26):38-39,42.
[30]罗登攀,刘道凤,马婧,等.蜡梅种子休眠原因浅析及赤霉素对种子萌发的影响[J].北方园艺,2015(1):83-86.
[31]庞士铨.赤霉素浸种对促进种子萌发和幼苗生长的作用[J].东北农学院学报,1978(3):48-56.

