棕榈雌雄花发育过程中内源激素的变化
, ,
(1.贵州大学林学院, 贵阳 550025; 2.贵州省森林资源与环境研究中心, 贵阳 550025)
棕榈(Palm) 属于棕榈科(Palmae) 棕榈属(Trachycarpus)常绿乔木,在我国该植物主要分布于秦岭以南和长江中下游的温暖、湿润、多雨地带[1]。棕榈花单性,淡黄色,花序粗壮,花期4—5月。棕榈为重要的经济树种和优良的观赏植物,其根、茎、叶、花、种子含有多种对人体有益的化学物质,多年生的树干可用作建材;棕纤维可制造天然、无害的棕垫[2]。其未开放的花苞可做蔬菜,蓓蕾期的棕榈花苞病虫害少,几乎不用农药,是具有较高开发价值的无公害特种蔬菜[2]。野外调查发现,雄株花苞的产量明显高于雌株。有研究表明,棕榈种子含油率为14.6%,其中不饱和脂肪酸的含量为66.51%[3],所以棕榈种子具有一定的经济价值。贵州省将要大力发展棕榈产业,对于以收获花苞为栽培目的,可以以雄株为主要栽培树种;以收获棕榈种子为栽培目的,在人工栽培种植过程中主要以雌株为主,只需要配置少数授粉树以满足授粉要求。
棕榈为典型的雌雄异株植物,目前对于棕榈植物的研究主要集中在棕榈种子良种的选育、棕片经济价值以及花苞营养成分分析等方面,未见对于其性别分化相关研究的报道[4]。对于棕榈早期实生苗性别鉴定仍然是未解决的难题,本实验旨在了解棕榈性别分化的生理和分子机制,为实生苗早期性别的鉴定以及棕榈抚育管理提供一定的参考。植物性别的表现包括性别决定和性别分化两部分,性别决定是由受精决定的,性别分化是在性别决定的物质基础上,经过一定的内外环境条件相互作用发育成一定性别的表型的过程[5],性别分化的最后结果是性别的表达[6]。在许多植物中,各种植物激素在花发育中起重要的调节作用和影响性别分化[7],一种植物激素对不同植物具有雌性化或雄性化的作用,一些植物性别分化是由多种植物激素共同作用的结果[8]。植物内源激素是植物性别分化过程中的一种诱导信号,积极参与性别分化过程,影响着植物的开花过程与性别表达[9]。
本研究通过对棕榈雌雄花花期内4种内源激素在不同发育时期的含量进行动态测定和分析,且对不同种类的激素进行比值分析,从生理水平上研究不同种类的内源激素调控雌雄花发育过程,为棕榈雌雄株性别分化机制的研究提供一定的指导资料。
1 材料与方法
实验地点位于海拔1 200 m、年平均气温15 ℃及年降雨量1 143 mm的贵州省贵定县;选用树龄相当、长势基本一致的健康、无病虫害的10年生棕榈雌雄株各3棵混合样本作为实验材料,分别于花蕾期、初花期、盛花期、盛花末期和终花期采集花,并放于液氮罐中,带回实验室。植物激素IAA、GA、ABA和ZR含量的测定是采用酶联免疫法(ELISA)测定[10]。
2 结果与分析
2.1 棕榈雌雄株花期内内源激素含量的变化
2.1.1生长素(IAA)含量的变化
由图1可知,在整个花期内,棕榈雌雄花IAA含量具有相似的变化模式;棕榈雄花花蕾期,IAA含量处于整个花期内最低水平,为30.63 ng/g,随着花蕾的进一步发育,IAA含量的变化表现为先上升后下降的趋势,在盛花期达到一个最高水平,为52.03 ng/g。棕榈雌花花蕾期,IAA含量处于较低水平,为30.63 ng/g,是同花期雄花的IAA含量的1.61倍,随着花蕾的进一步发育,IAA含量的变化表现为先上升后下降的趋势,在盛花期达到一个最高水平,为103.01 ng/g,是同花期雄花的IAA含量的1.98倍,在盛花末期IAA含量出现整个花期内最低值,为41.30 ng/g;且在花的每个发育期雌花的IAA含量都高于雄花的IAA含量。

图1 棕榈雌雄花不同发育时期IAA含量的变化
2.1.2赤霉素(GA3)含量的变化
由图2可知,在整个花期内棕榈雌雄花GA3含量差异不大;在花蕾期,雌花GA3含量为4.041 ng/g,雄花GA3含量为4.143 ng/g,雄花GA3含量略高于雌花;由花蕾期到初花期雌花GA3含量相对于雄花上升快,出现第1个峰值,为4.722 ng/g,由初花期到盛花期雌花GA3含量呈下降趋势,雄花呈上升趋势,在盛花期雄花GA3含量达到整个花期内的一个最高峰值,为4.898 ng/g,此时期雄花GA3含量高于雌花任一时期GA3含量;盛花期到盛花末期,雌花GA3含量呈上升趋势,在盛花末期出现第2个峰值,为4.868 ng/g,此时期GA3含量是整个雌花期最大含量;由盛花末期到终花期雌花GA3含量呈下降趋势,雄花GA3含量保持在一定水平。由此可见,2种性别棕榈花GA3含量在各个花期都有一定的差异。
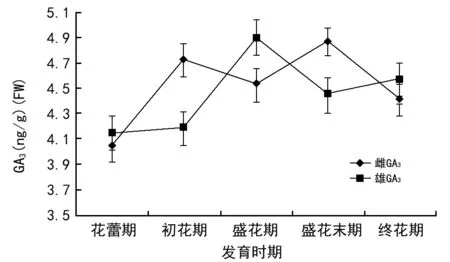
图2 棕榈雌雄花不同花期GA3含量的变化
2.1.3脱落酸(ABA)含量的变化
由图3可知,ABA含量在雌雄花发育的整个花期内有一个显著的波动,雌雄花发育过程中ABA含量的变化具有相似的波动趋势,整体的变化规律表现为先下降后上升再下降,雌雄花在盛花期都出现一个最大峰值,分别为8.510 ng/g和5.458 ng/g;盛花期后雌雄株ABA含量均呈下降趋势,且都维持在较低水平,但是终花期雌花ABA含量低于初花期,雄花ABA含量高于初花期。在花的每个发育期内雌花的ABA含量都高于雄花的ABA含量。
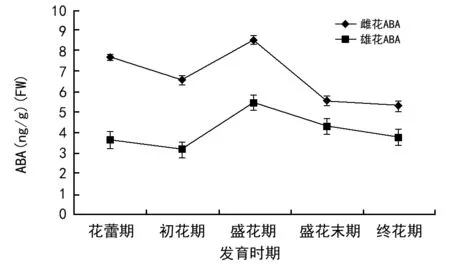
图3 棕榈雌雄花不同发育时期ABA含量的变化
2.1.4玉米素核苷(ZR)含量的变化
由图4可知,在棕榈雌雄花发育过程中,在花的每个发育时期,雌花的ZR含量都高于雄花的ZR含量,在整个花期内,雄花ZR含量的变化相对于雌花比较平缓;花蕾期棕榈雌花的ZR含量为194.65 ng/g,雄花的ZR含量为123.56 ng/g,雌花ZR含量明显高于雄花;由花蕾期到初花期雌花ZR含量呈下降趋势,雄花ZR含量呈缓慢上升趋势;初花期到盛花期雌雄花ZR含量均呈上升趋势,在盛花期同时出现整个花期内的最大峰值,分别为240.20 ng/g和177.37 ng/g;由盛花期到终花期雌雄花ZR含量均呈下降趋势,雄花ZR含量相对于雌花下降平缓。

图4 棕榈雌雄花不同花期ZR含量的变化
2.2 雌雄花内源激素含量比值的变化
由图5可知,在整个花期内,雌花的IAA/ABA、IAA/GA3、ZR/GA3和 ABA/GA3的比值变化规律相似,比值增高有利于雌花的成熟;雄花IAA/ABA、ZR/IAA和ZR/ABA比值变化规律相似,比值降低有利于花粉的发育成熟;雄花IAA/ABA比值在初花期明显高于雌花,在盛花期比值降低,有利于花粉的脱落;雌花IAA/ABA比值在盛花期高于雄花,在其他发育时期该比值均低于雄花;雌花IAA/GA3的比值在整个花期内均高于雄花的比值,且比值变化明显;雄花IAA/GA3的比值在整个花期内变化趋于平缓,可能IAA/GA3的比值对雄花的发育影响不大;雌花与雄花的ZR/IAA与IAA/GA3比值在整个花期内具有相似的变化规律,在整个花期内,雄花的ZR/GA3比值与雌花的ZR/ABA的比值具有相似的变化规律。
3 讨 论
雌雄异株植物是研究植物性别分化的重要材料,植物激素对植物性别分化以及生长发育起着重要的调控作用[7],棕榈为典型的雌雄异株植物,其在育种过程中实生苗早期性别鉴定仍是未解决的难题。本研究通过分析棕榈雌雄花花期内几个重要时期激素含量的动态变化,初步探讨了激素与雌雄花发育的关系;能否通过激素调控延长花蕾期以提供食用花苞,需要进一步研究。
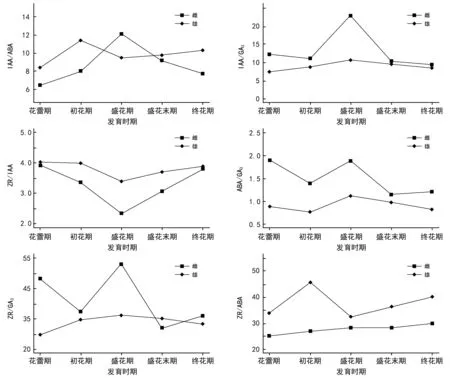
图5 不同发育时期棕榈雌雄花激素含量的比值
赤霉素被认为是性别分化的一种重要激素,通常情况下被当做是一种雄性激素,如利用赤霉素处理黄瓜、菠菜雌株,在雌株上会产生雄性表达[11];对番木瓜喷施赤霉素抑制剂,能使雄株上产生心皮发育[12];也有研究结果表明,植物激素赤霉素具有促进植物雌花性别分化的作用[13-14],如利用外源喷施赤霉素处理麻疯树花序芽,结果显示雌雄花比例明显增加[15];本研究中雌雄花不同发育时期赤霉素含量均存在一定的差异,但是没有明显的变化规律。生长素也是影响性别分化的一个因子,有研究表明,在许多植物中,生长素具有雌性效应,如生长素对荔枝[16]、大麻[17]、仙人掌[18]等的影响,但同时也有研究者发现,生长素具有雄性效应,其雄性效应在蛇麻草中得出结论[19]。在本研究中,整个花期内雌花IAA含量都高于雄花,且在花蕾期雌花的IAA含量高于雄花,说明高含量的IAA更有利于雌花的生长发育,这与IAA具有促雌作用的观点相一致。也有研究者得出,植物的性别分化受生长素与细胞分裂素共同作用来调节[20]。调控植物性别分化的主要激素是赤霉素与细胞分裂素,而其他种类的激素对性别的调控是通过影响这两种类型的激素活性来实现的[10]。对麻疯树花序喷施细胞分裂素的研究表明细胞分裂素具有明显的促雌作用,同时还诱导形成了两性花[21]。本研究中,在棕榈雌雄花整个花期内,雌花的ZR含量都高于雄花,雌花出现两次峰值,分别是花蕾期和盛花期,雄花出现一次峰值,在盛花期。所以认为,高水平的ZR含量有利于雌花的发育。脱落酸在花的多个发育阶段都参与了调控作用,包括花发育的开始、分化、衰老。脱落酸对植物性别表达的作用,不同研究者有不同的观点。脱落酸影响植物性别表达的作用没有足够的证据,不同的研究者得出不同的结论[22]。大多数研究中,ABA趋向于诱导种子植物和蕨类植物的单性同株和单性异株的雌性表达[23]。本研究中,不同发育时期棕榈雌花的ABA含量一直高于雄花,说明高水平的ABA含量更有利于雌花的发育。
不同种类激素之间存在两种生理效应,即为相互促进和相互拮抗,因此植物激素间的平衡关系对植物生长发育的调节作用更为重要[22]。高水平的IAA/ABA和ZR/ABA比值更有利于棕榈雄花的生长发育,且在整个花期内雄花比值的波动相对比较大,雌花的比值波动相对比较平缓;IAA/GA3和ABA/GA3比值的增高有利于雌花的生长发育;IAA/ZR比值的增高在盛花期对雄花的生长发育影响比较大。此研究结果表明,不同激素含量的变化以及不同激素比值的变化在棕榈雌雄花发育过程中起一定的调控作用。而对于棕榈性别分化的研究需要利用分子生物学的方法进行深入的研究,解析棕榈性别分化的分子机制及激素基因相互作用来影响性别分化系统。
4 结 论
本研究对棕榈雌雄花从花蕾期到终花期整个花期内4种内源激素含量动态变化进行了分析,得出棕榈雌雄花在整个花期内激素含量水平存在明显差异。高水平的IAA、ABA、ZR有利于雌花的生长发育,高水平的GA3有利于雄花花粉的成熟;在激素平衡中,IAA/ABA比值的增加,有利于雌花的发育和雄花花粉的成熟;低水平的ZR/IAA比值,有利于雄花花粉与雌花的成熟;高水平的ABA/GA3和ZR/GA3比值更有利于雌花与雄花花粉的发育成熟;在整个花期内,ZR/GA3比值的变化比对雄花的发育影响不大;ZR/ABA的比值的变化在整个花期内对雌花的生长发育影响不大。
参考文献:
[1]康洪灿.无公害特种蔬菜棕苞及其栽培技术[J].农业科技通讯,2006(1):37.
[2]赵淑秋,马瑞芬,余小领.棕榈的食用和药用价值及加工展望[J].江苏调味副食品,2011(2):42.
[3]刘世彪,陈珮珮,易春华,等.棕榈树种仁油的超临界CO2流体萃取及GC-MS分析[J].食品科学,2008(11):347.
[4]张军,范海阔,孙程旭.棕榈科植物资源研究现状与建议[J].农业研究与应用,2013(6):52-54.
[5]徐耀辉.遗传学[M].武汉:华中师范大学出版社,1994.
[6]沈桂芳,丁仁瑞.走向后基因组时代的分子生物学[M].杭州:浙江教育出版社,2005.
[7]段娜,贾玉奎,徐军,等.植物内源激素研究进展[J].中国农学通报,2015(2):159-165.
[8]汪俏梅,曾广文.高等植物性别分化的诱导信号[J].植物生理学通讯,1997(2):147-151.
[9]Chiara A,Airoldi.Determination of sexual organ development[J].Sex Plant Reprod,2010(23):53-62.
[10]吴颂如,陈婉芬,周燮.酶联免疫法(ELISA)测定内源植物激素[J].植物生理学通讯,1988(5):53-57.
[11]Chailakhyan M K.Genetic and hormonal regulation of growth,flowering,and sex expression in plants[J].American Journal of Botany,1979,66(6):717-736.
[12]Kumar A,Jaiswal V S.Sex reversal and fruit formation on male plants of Carica papaya L by ethrel and chlorflurenol[J].Proceedings:Plant Sciences,1984,93(6):635-641.
[13]Gupta R,Chakrabarty S K.Gibberellic acid in plant: still a mystery unresolved[J].Plant Physiol,2003,8(9):25 504.
[14]肖华山,吕柳新,陈志彤.荔枝花发育过程中雌雄蕊内源激素的动态变化[J].应用与环境生物学报,2003(1):114-115.
[15]惠文凯,杨舒贻,陈涵斌,等.赤霉素诱导麻疯树雌雄花分化的研究[J].南京林业大学学报(自然科学版),2016(6):175-179.
[16]Huang S,Cerny R E,Qi Y L,et al.Transgenic studies on the involvement of cytokinin and gibberellin in male development[J].Plant Physiol,2003,131(3):1 270-1 282.
[17]Heslop-Harrison.Auxin and sexuality in Cannais sativa.Physiol Plantarum,1956,9(4):588-597.
[18]Orozco-Arroyo,S.Vázquez-Santana,A.Camacho,J.G.et al.Cruz-García.Inception of maleness:auxin contribution to flower masculinization in the dioecious cactus Opuntia stenopetala Planta,2012,236(1):225-238.
[19]Hamdi,G.Teller,J.P.Louis.Master regulatory genes,auxin levels,and sexual organogeneses in the dioecious plant Mercurialis annua Plant Physiol.,1987,85(2):393-399.
[20]Erin E.Irish,and Timothy Nelson.Sex determination in monoecious and dioecious Plants Plant Cell,1989,1(8):737-744.
[21]Pan B Z,Chen M S,Ni J,et al.Transcriptome of the inflorescence meristems of the biofuel plan Jatropha curcas treated with cytokinin[J].BMC Genomics,2014,15(1):974.
[22]李晓艳,王振兴,秦红艳,等.软枣猕猴桃雌雄株花蕾发育过程中内源激素的动态变化[J].吉林农业大学学报,2016(3):285.
[23]孔冬梅.激素对高等植物性别分化的调控研究进展[J].安徽农业科学,2009 (12):5 378.

