低强度脉冲超声对大鼠牙本质损伤修复过程中钙离子转运相关蛋白表达的影响
左静 甄佳秀 杨正艳 李月恒 罗俊
第三期牙本质是牙齿萌出后在不断受到各种内源性及外源性病理刺激后牙本质-牙髓复合体产生的防御修复反应,包括反应性牙本质及修复性牙本质2 种[1-2]。由于第三期牙本质的形成可增加剩余牙本质厚度[3],且其新形成的牙本质小管明显弯曲、数目较少,可有效减少外部刺激向髓腔内传导,对于保存健康牙髓、缓解牙本质过敏症状等方面有重要意义。
低强度脉冲超声(low intensity pulsed ultrasound,LIPUS)是一种非侵入性的理疗方法,因其对骨组织独特的生物学效应,被广泛应用于新鲜骨折及骨不连等的临床治疗[4]。由于牙体硬组织与骨组织结构的相似性,且有报道认为早期形成的第三期牙本质具有某些骨样特征[5],我们推测LIPUS可能对牙体硬组织的修复也有一定作用。有研究发现体外培养的牙齿经LIPUS辐照后有修复性牙本质形成,且可观察到DMP1、DSPP等牙本质基质蛋白表达增加[6],说明LIPUS可能对牙本质基质形成及早期矿化诱导有一定作用,但对于其是否会调节钙盐转运,促进第三期牙本质的矿化成熟尚无任何研究。因而本实验希望通过检测LIPUS 辐照后牙本质-牙髓复合体上钙离子转运主要蛋白Cav1.2及NCX1表达变化,探讨LIPUS是否对钙离子转运具有调节作用及其可能的作用机制。
1 材料与方法
1.1 实验动物,分组及模型建立
成年雄性SD大鼠[(360±13) g, 12~13 周,n=40],由重庆医科大学动物实验中心提供。将40只SD大鼠10%水合氯醛腹腔内注射麻醉(0.3 ml/100 g)在右侧上颌第一磨牙面采用改良备洞法建立牙本质损伤模型[7-8]。随机选取其中20只大鼠对备洞牙予以超声辐照,剩余20只大鼠对未备洞的左侧上颌第一磨牙予以超声辐照,最终形成备洞组、备洞+LIPUS组、LIPUS组及空白对照组4 个研究组。所有操作均由一名经验丰富的实验技术员完成。本动物实验计划获得重庆医科大学附属口腔医院医学伦理委员会批准。
1.2 超声设备、参数设定及辐照方式
本实验超声设备为低强度脉冲超声仪(重庆海扶),使用前已通过超声功率计UPM-DT-1重新调试并校正了强度,设定超声波输出频率1.5 MHz,功率30 mW/cm2, 脉冲信号长度200 us,重复率1 KHz。超声换能器探头为10 mm×5 mm的长方形,形似牙刷,使用时表面涂布一层超声耦合剂,将其纵向轻置于磨牙咬合面(图 1),每天连续辐照20 min。空白对照组及LIPUS组采用超声假照处理。
分别在持续作用1、 3、 7 d及14 d后处死SD大鼠,并即刻将SD大鼠上颌磨牙连同周围牙槽骨一并取下,用于后续处理分析。
1.3 组织病理学分析
取出的上颌磨牙区组织40 g/L甲醛液固定48 h,充分冲洗,10%EDTA脱矿液中脱矿3~4 周,修整组织块,石蜡包埋,层厚4 μm连续切片,HE染色,光镜下观察。显微病理图文分析软件(Olympus DP80 YC.YX-2050,日本)采集图片,进行对比分析。
1.4 免疫组化
上述石蜡切片常规脱蜡至水,3%H2O2去离子水避光条件下孵育10~20 min消除内源性过氧化物酶活性,胃蛋白酶37 ℃条件下消化15~30 min进行抗原修复,正常山羊血清工作液封闭, 37 ℃孵育10~30 min后倾去封闭液,以封闭非特异性抗原,分别滴加Cav1.2, NCX1单克隆抗体(1∶200, Abcam, UK), 4 ℃孵育过夜,滴加二抗,室温孵育30 min,滴加SABC,镜下控制使用DAB工作液显色,苏木素复染1~2 min。上述每步后均用PBS冲洗5 min×3,阴性对照用PBS代替一抗,其余步骤相同。显微病理图文分析软件采集图片,Image Pro Plus 6.0图像分析软件对图片的IOD SUM及area进行测量,计算平均吸光度值(MOD,mean density),MOD=IOD SUM/area,绘制MOD值变化曲线,观察比较各蛋白表达变化。

图 1 低强度脉冲超声仪及超声辐照示意图
1.5 统计学分析

2 结 果
2.1 组织病理学观察
2.1.1空白对照组成牙本质细胞呈柱状紧密排列于牙本质内侧,髓腔内细胞形态正常,排列层次清楚,由外向内分为乏细胞层、多细胞层及固有牙髓层,多个小血管散在分布于髓腔内(图 2)。
2.1.2LIPUS辐照组与空白对照组相比,髓腔内细胞形态及层次结构无明显变化,仅近辐照侧多细胞层牙髓细胞少许增多,有向成牙本质细胞层迁移的趋势(图 3)。
2.1.3备洞组1 d时成牙本质细胞层排列紊乱,近牙尖处部分成牙本质细胞消失,有较多炎症细胞浸润,多细胞层细胞增多,髓腔内血管扩张充血, 3 d时病理改变与1 d相似。 7 d时炎症缓解,牙髓细胞增多,有少量长梭型细胞向牙本质迁移形成成牙本质细胞样细胞,有少量修复性牙本质形成, 14 d时成牙本质细胞样细胞增多,乏细胞层不明显,多细胞层细胞增加(图 3)。
2.1.4LIPUS+备洞组1 d及3 d时炎症明显,髓腔内细胞表现与备洞组相似,但7 d及14 d时迁移而来的成牙本质细胞样细胞数目相对而言更多,且修复性牙本质形成更加明显(图 3)。
2.2 免疫组化图像分析
2.2.1Cav1.2定位与表达变化免疫组化染色显示Cav1.2蛋白在各组均有表达,染色阳性呈现为黄色-棕黄色, 定位于深入牙本质内的成牙本质细胞突起上。
备洞组、备洞+LIPUS组各时间点及LIPUS组1 d时MOD值均较空白对照组大(P<0.05),差异有统计学意义。备洞+LIPUS组在1 d(P=0.008)及3 d(P=0.017)MOD值比备洞组明显升高(图 4),而7 d及14 d时差异无统计学意义(P<0.05),MOD值曲线总体表现为缓慢下降趋势(图 5A)。

D: 牙本质; PD: 前期牙本质; P: 牙髓; OD: 成牙本质细胞层; Cf: 乏细胞层; Cr: 多细胞层
图 2空白对照组(HE,×400)
D: Dentin; PD: Predentin; P: Pulp; OD: The odontoblastic cell layer; Cf: Cellular few layer; Cr: Cellular rich layer
Fig 2Sections of the control group(HE,×400)
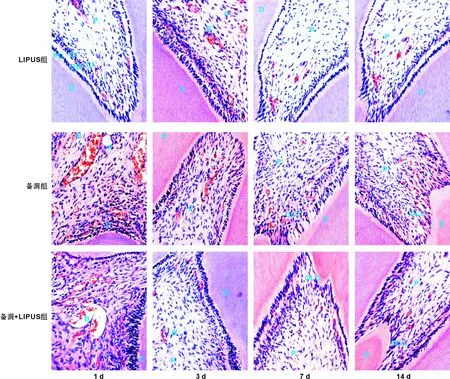
图 3牙髓牙本质病理组织学观察(HE,×400)
Fig 3Paothological observation of dental pulp and dentin(HE,×400)
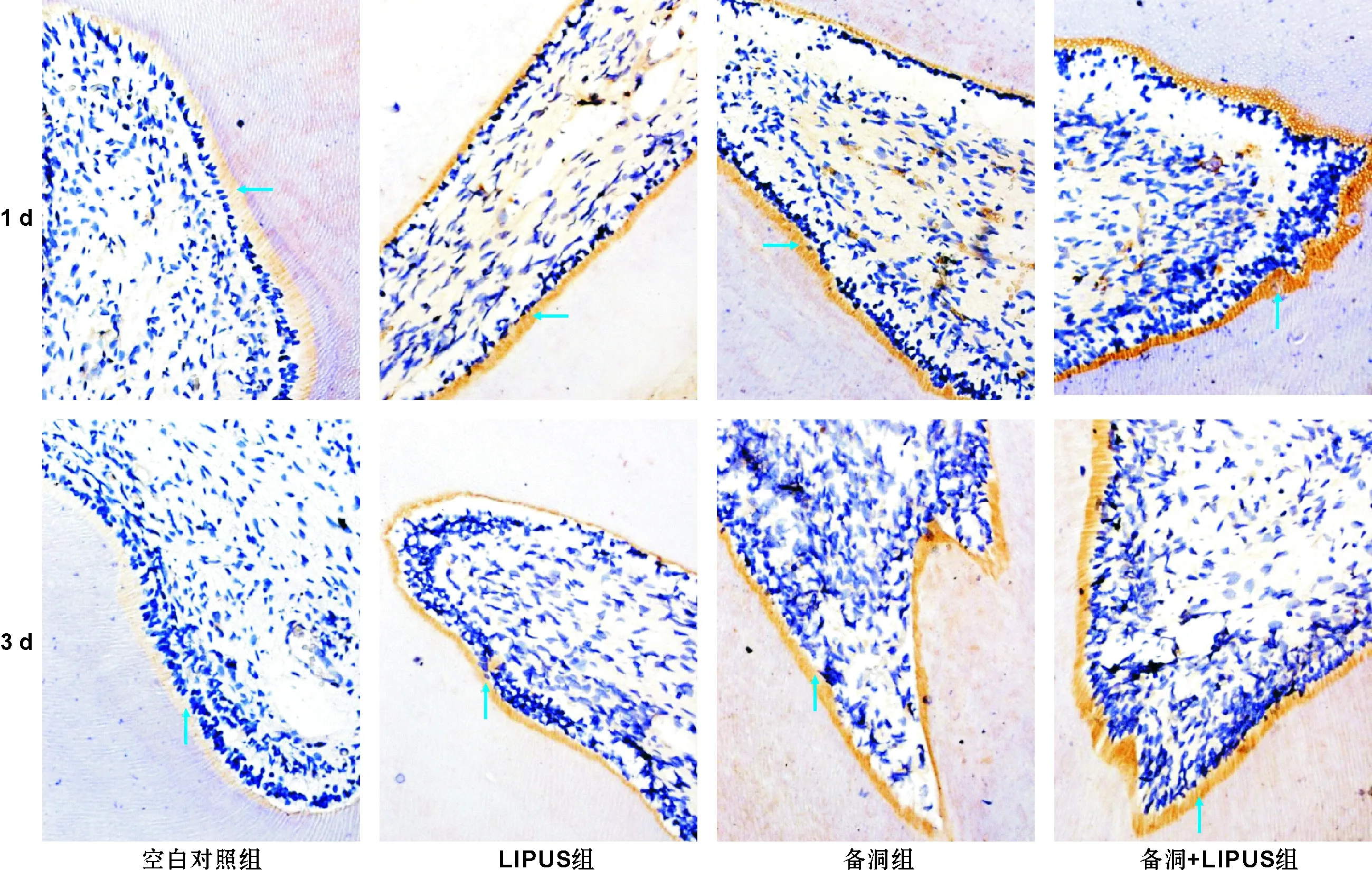
图 4Cav1.2蛋白的表达(→: 指黄棕色区域为蛋白表达区域)(免疫组织化学染色,×400)
Fig 4Cav1.2 expression(Arrow: Positive staining areas)(IHC,×400)
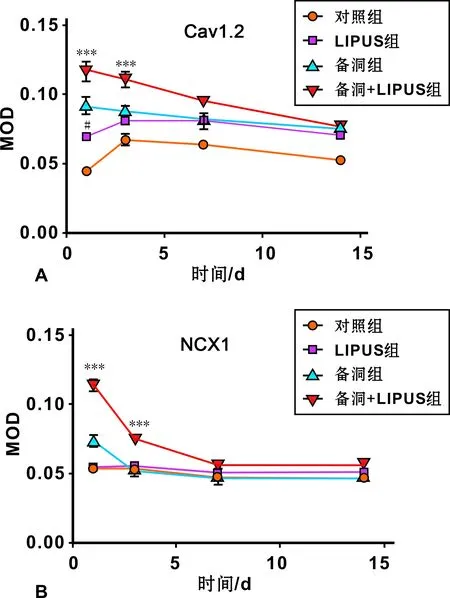
图 5 各组阳性染色平均吸光度值变化曲线
2.2.2钠钙交换体NCX1蛋白定位与表达变化免疫组化染色显示NCX1在各组均有表达,染色阳性呈现为棕黄色-深棕色,主要定位于髓腔内各种牙髓细胞胞膜及细胞质,其中在成牙本质细胞胞体及突起上表达更明显。
备洞组1 d(P=0.002)及备洞+LIPUS组1 d(P=0.000 3)、 3 d(P=0.001)时MOD值较空白组显著升高,其余组别MOD值较空白对照组无明显统计学差异。备洞+LIPUS组MOD值与备洞组相比在1 d(P=0.000 4)及3 d(P=0.008)时明显升高(图 6), 7 d及14 d则无明显差异,MOD值曲线总体表现为缓慢下降趋势(图 5B)。
3 讨 论
本实验通过建立牙本质损伤的动物模型,探讨低强度脉冲超声是否对牙本质-牙髓复合体及钙离子转运相关蛋白具有调节作用。组织学观察发现牙本质损伤后牙本质-牙髓复合体会产生一系列炎症修复反应,这证明了牙本质-牙髓复合体自身的修复再生潜能,而这种修复过程是与炎症反应密切相关的,并非一种完全独立的生命活动[9]。备洞+LIPUS组形成的修复性牙本质及成牙本质细胞样细胞均较备洞组更明显,由此推测低强度脉冲超声可能诱导了牙髓细胞向损伤区域迁移分化,参与并促进了第三期牙本质的形成, 这与Al-Daghreer 等[10-11]的研究结果一致。然而有趣的是单纯超声辐照正常牙齿并不能观察到有修复性牙本质形成或其他明显的病理变化。因而我们推测超声可能是在牙齿损伤修复开启后对修复反应具有协同强化作用。
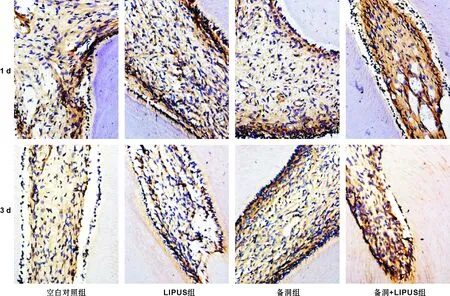
图 6NCX1在髓腔的表达情况,→所指黄棕色区域为蛋白表达区域(免疫组织化学染色,×400)
Fig 6The expression of NCX1, Arrow: Positive staining areas(IHC,×400)
Cav1.2为成牙本质细胞上主要的L-型钙离子通道蛋白基因型,可将循环血液中的钙离子转运进成牙本质细胞内,NCX1是牙髓组织上钠钙交换体的主要基因型,是成牙本质细胞内钙离子向矿化前沿定向外排系统的重要组成部分,二者对于促进牙本质矿化成熟及维持细胞内外钙离子稳态具有重要作用,Cav1.2-NCX1途径是目前学术界认可的牙本质矿化时钙离子的主要转运方式[12-14]。本实验发现Cav1.2及NCX1在牙本质损伤后表达明显增加, 1 d时最高,后逐渐下降, 14 d时基本降至空白对照组水平,提示Cav1.2、NCX1在损伤早期即被迅速激活,推测其可能参与了损伤的早期感知与修复过程。而备洞+LIPUS组在1天及3天的蛋白表达量又明显高于单纯备洞组,提示超声可能在损伤早期对Cav1.2及NCX1的表达具有明显促进作用,后期则不明显,超声的这一现象在促进骨折愈合方面已有相关报道[15],但在牙齿修复尚无研究。与空白对照组相比,Cav1.2 在LIPUS辐照1 d时明显提高,可能是由于超声的机械刺激所致,谢亚佳 等[16]的研究发现Cav1.2在张应力刺激12 h时基因表达明显增加,但24 h后表达水平即下调,这种现象可能解释了Cav1.2蛋白在1 d时表达明显升高的原因,但也不能完全排除是实验误差所致。其余时间点单纯超声刺激并没有观察到有明显的蛋白表达增加,结合HE染色显示的LIPUS组的形态学表现,这可能提示本实验所设超声辐照较安全,并不会诱导正常组织发生明显明显生理及病理改变,但其具体安全阈值及促进修复性牙本质形成的最适阈值仍需要进一步研究。
综上所述, 低频脉冲超声可能会促进牙本质损伤早期钙离子转运主要蛋白的表达,加快第三期牙本质修复进程,对牙体硬组织的防御修复具有一定的临床意义。
[1]Goldberg M, Smith A. Cells and extracellular matrices of dentin and pulp; A biological basis for repair and tissue engineering[J]. Crit Rev Oral Biol Med, 2004, 15(1): 13-27.
[2]Goldberg M, Kulkarni AB, Young M, et al. Dentin: structure, composition and mineralization[J]. Front Biosci (Elite Ed), 2011, 3: 711-735.
[3]Murray PE, About I, Lumley PJ, et al. Cavity remaining dentin thickness and pulpal activity[J]. Am J Dent, 2002, 15(1): 41-46.
[4]Padilla F, Puts R2, Vico L, et al. Stimulation of bone repair with ultrasound: A review of the possible mechanic effects[J]. Ultrasonics, 2014, 54(5): 1125-1145.
[5]谢晓华, 赵芳, 王丽杰, 等. 骨涎蛋白在大鼠磨牙第三期牙本质形成过程中的表达[J]. 现代生物医学进展, 2014, 14(28): 5451-5453.
[6]Al-Daghreer S, Doschak M, Sloan AJ, et al. Short-term effect of low-intensity pulsed ultrasound on an ex-vivo 3-d tooth culture[J]. Ultrasound Med Biol, 2013, 39(6): 1066-1074.
[7]李梦洁, 柏祥娥, 张娟, 等. 牙本质牙髓复合体损伤修复大鼠动物模型的建立[J]. 口腔医学研究, 2013, 29(3): 238-240.
[8]陈智, 樊明文, 边专, 等. 修复性牙本质形成的大鼠模型[J]. 牙体牙髓牙周病学杂志, 2000, 10(3): 139-142.
[9]Goldberg M, Njeh A, Uzunoglu E. Is Pulp inflammation a prerequisite for pulp healing and regeneration?[J]. Med Inflam, 2015, 2015: 347649.
[10]Al-Daghreer S, Doschak M, Sloan AJ, et al. Long term effect of low intensity pulsed ultrasound on a human tooth slice organ culture[J]. Arch Oral Biol, 2012, 57(6): 760-768.
[11]El-Bialy T, Lam B, Aldaghreer S, et al. The effect of low intensity pulsed ultrasound in a 3D ex vivo orthodontic model[J]. J Dent, 2011, 39(10): 693-699.
[12]Westenbroek RE, Anderson NL, Byers MR. Altered localization of Cav1.2 (L-type) calcium channels in nerve fibers, Schwann cells, odontoblasts, and fibroblasts of tooth pulp after tooth injury[J]. J Neurosci Res, 2004, 75(3): 371-383.
[13]Tsumura M, Okumura R, Tatsuyama S, et al. Ca2+extrusion via Na+-Ca2+exchangers in rat odontoblasts[J]. J Endod, 2010, 36(4): 668-674.
[14]李玉成, 朱文忠, 赵守亮. 牙本质矿化过程中的钙离子转运[J]. 牙体牙髓牙周病学杂志, 2003, 13(7): 403-410.
[15]Tobita K, Matsumoto T, Ohashi S, et al. Effect of low-intensity pulsed ultrasound stimulation on gap healing in a rabbit osteotomy model evaluated by quantitative micro-computed tomography-based cross-sectional moment of inertia[J]. J Orthop Sci, 2012, 17(4): 470-476.
[16]谢亚佳, 余晶, 赵守亮. 周期性张应变对人牙髓细胞L型钙离子通道基因表达的影响[J]. 牙体牙髓牙周病学杂志, 2009, 19(8): 435-437.

