腺病毒介导的“睡美人”转座子与IL-10共表达对NOD小鼠Th17/Treg细胞平衡的影响
庞春艳,王 慧,王志华,冯秀媛,王永福
(1.包头医学院第一附属医院风湿免疫科 包头医学院风湿免疫研究所,内蒙古 包头 014010;2.内蒙古自治区自体免疫学重点实验室,内蒙古 包头 014010)
干燥综合征(Sjögren’s syndrome,SS)是一种以淋巴细胞浸润为特征的自身免疫性疾病,由于外分泌腺分泌减少,临床上主要表现为口、眼干燥等症状,常可累及多个脏器。但目前对于SS确切的发病机制尚不清楚。非肥胖糖尿病(non-obese diabetes,NOD)小鼠可自发地出现外分泌腺淋巴细胞的浸润,血清中可检测到多种自身抗体和炎性细胞因子,如抗SSA抗体、抗SSB抗体、抗M3R抗体、白细胞介素17(IL-17)和白细胞介素23(IL-23)等,进而出现相应的分泌功能减弱[1],与人类的SS症状极其相似。因此,NOD小鼠是目前公认的SS动物模型。国内外研究[2-3]显示:SS患者血清中白细胞介素10(IL-10)的表达水平较健康对照者下降,提示SS患者IL-10表达水平较低。房星星等[4]研究人脐带间充质干细胞(mesenchymal stem cells,MSCs)对SS患者CD4+T细胞增殖的影响发现:MSCs通过促分泌转化生长因子β1(TGF-β1)、白细胞介素16(IL-6)和IL-10从而抑制SS患者CD4+T细胞的活化增殖。Heoa等[5]研究发现:IL-10可以抑制Th17细胞的活化,诱导Treg细胞比例的增加,提示IL-10作为一种抗炎因子,对自身免疫性疾病起重要的治疗作用。因此,IL-10可能是治疗SS的靶点。
“睡美人”(sleeping beauty,SB)转座系统属于Tcl/mariner转座子家族,是第一个应用于高等哺乳动物细胞相关研究的转座子,是目前所知的在脊椎动物中转座效率最高的转座系统。SB转座系统在转基因、基因治疗和基因标签等方面均具有十分广阔的应用前景[6]。本研究将IL-10基因和转座子序列整合到腺病毒载体以及含有转座酶的腺病毒载体共同感染C57BL6小鼠脾细胞,将携带腺病毒载体的脾细胞种植到NOD小鼠皮下,观察种植脾细胞后NOD小鼠脾细胞中CD4+IL-10+、CD4+IFN-γ+、Th17和Treg的变化以及Th1/Th2和Th17/Treg的平衡,为IL-10对SS的治疗机制研究提供新的思路。
1 材料与方法
1.1实验动物、主要试剂和仪器NOD小鼠购自南京大学-南京生物医药研究院,动物合格证号:201705875。兔抗小鼠的APC标记的IL-10、PE标记的IFN-γ、PE标记的IL-17A、FITC标记的CD4、PE 标记的CD25和APC标记的FOXP3一抗购自美国Abcam公司,Alexa Fluor 488山羊抗兔IgG购自美国Oregon公司,ELSIA试剂盒购自武汉新启迪生物科技有限公司。流式细胞仪购自美国BD公司。
1.2含有IL-10基因的腺病毒载体的构建化学合成转座子、IL-10和转座酶的序列,转座子和IL-10序列插入同一腺病毒穿梭质粒,IL-10序列位于转座子序列的中间,转座酶插入另一个腺病毒穿梭质粒,将上述2个腺病毒穿梭质粒分别与包装质粒共转染HEK293细胞,通过Cre/loxP重组酶系统的作用实现重组,产生重组腺病毒。成功构建含有IL-10基因的腺病毒载体和转座酶的腺病毒载体。同时构建不含IL-10只含有转座子的腺病毒载体和无转座酶的腺病毒载体作为阴性对照。上述腺病毒载体由上海吉凯基因公司构建。经测序发现插入的序列准确无误,每个病毒的滴度均为:1×1011PFU·mL-1。
1.3腺病毒载体感染C57BL6小鼠脾细胞实验分为对照组、空载体组和治疗组。含有IL-10基因和转座子的腺病毒载体与含有转座酶的腺病毒载体共同感染治疗组中的C57BL6小鼠脾细胞;只含有转座子的腺病毒载体和无转座酶的阴性腺病毒载体共同感染空载体组的C57BL6小鼠脾细胞;对照组C57BL6小鼠脾细胞不做任何处理。将上述3组细胞处理48 h后收集,PBS洗涤2次,采用Trizol提取RNA,RT-PCR法检测各组小鼠脾细胞中IL-10 mRNA表达水平,计算2-ΔΔCt,每组3个复空,重复5次。ΔCt=目的基因Ct值-内参基因Ct值,ΔΔCt=实验组Ct值-对照组Ct值。
1.4NOD小鼠皮下种植C57BL6小鼠脾细胞将上述3组细胞处理48 h后收集,PBS洗涤2次,100 μL PBS重悬细胞沉淀,分别注射于对照组、空载体组和治疗组NOD小鼠右后腿的腘窝皮下,每组6只小鼠,每周1次,共6次。
1.5ELISA法检测NOD小鼠血清中IL-10表达水平注射后4周处死NOD小鼠,心脏采血,离心分离血清,-80℃保存,ELISA法检测NOD小鼠血清中IL-10表达水平。步骤如下:分别将100 μL标本和不同浓度的标准品加入孔中,37℃孵育90 min,洗板3次;加抗体工作液100 μL,37℃孵育60 min,洗板3次;加酶结合物工作液100 μL,37℃孵育30 min,洗板5次;然后加100 μLTMB显色液,37℃孵育10~20 min;最后加100 μL终止液,450 nm检测吸光度(A)值。根据标准品的浓度值和A值绘制标准曲线,再根据标准曲线计算血清中IL-10表达水平。
1.6NOD小鼠脾细胞中CD4+IL-10+、CD4+IFN-γ+、Th17和Treg细胞比例注射后4周处死NOD小鼠,无菌条件下取NOD小鼠脾脏,PBS洗涤3次,注射器研磨,细胞筛过滤,1 500 r·min-1离心10 min,红细胞裂解液裂解10 min,1 200 r·min-1离心6 min,RPMI-1640悬细胞沉淀。将细胞悬液移至细胞培养皿中,加5 mL含10%FCS的完全培养基RPMI-1640,5%CO2、37℃培养。加PMA、ionomycin和monensin培养4 h,收集细胞,100 μL的Flow Staining Buffer 悬细胞,每一个检测项目分6管,1管不加任何抗体,另外5管加0.125 μg anti-mouse CD4抗体,检测Treg时再加0.06 μg 的CD25抗体,4℃避光孵育30 min;加预冷的Flow Cytometry Staining Buffer 1 000 r·min-1离心5 min,加1 mL新鲜配制的Fixation/Permeabilization工作液,4℃避光孵育30 min;Permeabilization buffer洗涤细胞2次,在已加抗体的其中4管中分别加0.5 μg的anti-mouse FoxP3、anti-mouse IL-17A、anti-mouse IL-10和anti-mouse IFN gamma抗体,4℃避光孵育30 min;Permeabilization buffer洗涤细胞2次,Flow Cytometry Staining Buffer悬细胞沉淀,流式细胞仪检测。

2 结 果
2.1C57BL6小鼠脾细胞中IL-10 mRNA表达水平腺病毒载体共同感染C57BL6小鼠脾细胞48 h,治疗组脾细胞中IL-10 mRNA的2-ΔΔct为24.10±9.96,空载体组为2.18±2.53,对照组为1.00±0.00;治疗组IL-10 mRNA表达水平,高于对照组和空载体组(F=72.71,P<0.01)。
2.2各组NOD小鼠血清中IL-10表达水平注射结束后4周处死NOD小鼠,对照组、空载体组和治疗组IL-10表达水平分别为(173.04±103.14)、(175.00±222.21)和(559.07±200.02)ng·L-1,治疗组NOD小鼠血清中IL-10表达水平明显高于对照组和空载体组(F=8.89,P=0.003)。
2.3各组NOD小鼠脾细胞中CD4+IL-10+细胞和CD4+IFN-γ+细胞比例治疗组CD4+IL-10+细胞比例明显高于对照组和空载体组(F=72.09,P<0.05)。CD4+IFN-γ+细胞比例3组间比较差异无统计学意义(F=2.72,P>0.05)。治疗组中IFN-γ+/IL-10+细胞比值明显低于对照组和空载体组(F=23.50,P<0.05)。见表1。
2.2各组NOD小鼠脾细胞中Th17细胞和Treg细胞比例治疗组NOD小鼠脾细胞中Th17比例(12.33±0.71)明显低于对照组(16.40±2.19)和空载体组(15.93±1.29)(F=6.39,P<0.05);治疗组Treg细胞比例(2.13±0.25)明显高于对照组(1.33±0.25)和空载体组(1.40±0.10)(F=12.98,P<0.05)。见图1。
表1各组NOD小鼠脾细胞中CD4+IL-10+和CD4+IFN-γ+细胞比例及IFN-γ+/IL-10+细胞比值
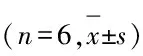
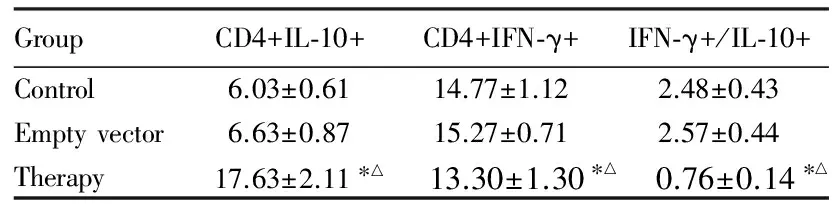
GroupCD4+IL⁃10+CD4+IFN⁃γ+IFN⁃γ+/IL⁃10+Control6.03±0.6114.77±1.122.48±0.43Emptyvector6.63±0.8715.27±0.712.57±0.44Therapy17.63±2.11∗△13.30±1.30∗△0.76±0.14∗△
*P<0.05 compared with control group;△P<0.05 compared with empty vector group.

图1 各组NOD小鼠脾细胞中Th17细胞(A)和Treg细胞(B)比例
2.3各组NOD小鼠脾细胞中Th17/Treg比值治疗组Th17/Treg细胞比值为5.82±0.34,与对照组(12.39±0.92)和空载体组(11.46±1.71)比较明显下降,差异有统计学意义(F=29.33,P<0.05)。
3 讨 论
SS是一种常见的自身免疫性疾病,常有口干、眼干等症状。研究[7-8]发现:IL-10是一种抗炎因子,在炎症性疾病和自身免疫性疾病中具有重要的保护作用。Verhenne 等[9]将SB100X系统尾静脉注射ADAMTS13-/-小鼠发现:ADAMTS13可以持续高表达25周,稳定表达ADAMTS13的小鼠未出现严重的血小板减少或器官损伤,提示SB转座子介导的治疗方法可作为血小板减少性紫癜的基因治疗方法,说明SB转座子系统可作为治疗SS的一种手段。
Inoue 等[10]研究发现:白藜芦醇可以增加NOD小鼠唾液腺中IL-10的表达,从而对SS的唾液腺功能的失调起到治疗作用。因此,本研究将含有IL-10和SB转座子系统感染C57BL6小鼠脾细胞,再将这些脾细胞注射到NOD小鼠的右后腿的腋窝下,体内外检测均发现IL-10表达水平明显升高,提示SB转座子系统不论在体外还是体内均可以高效表达IL-10,从而为IL-10治疗SS的作用机制研究提供理论依据。
Th1和Th2细胞及其比值的失衡在SS的发病中起重要的作用。Wu等[11]研究白芍总苷(TGP)治疗SS的分子机制结果发现:将SS的动物模型小鼠分为对照组、羟氯喹(HCQ)组、TGP组和联合(TGP+ HCQ)组,对照组IFN-γ、IL-4、Fas和FasL水平明显高于其他3组;此外,与HCQ组比较,联合组上述4种因子表达水平降低。与对照组比较,TGP组和联合组IFN-γ和IL-4比值下降。上述结果表明:TGP可以通过影响Th1/Th2细胞因子平衡,同时降低IFN-γ、IL-4、Fas和FasL表达水平,从而起到治疗SS的作用。本研究结果显示:含有IL-10的SB转座子系统可以使NOD小鼠脾细胞中CD4+IL-10+细胞比例明显升高,而CD4+IFN-γ+细胞略有下降,IFN-γ+/IL-10+比值明显下降,提示含有IL-10 的SB转座子系统可以平衡Th1和Th2细胞的比值,进而对SS起到治疗作用。
Th17和Treg细胞及其分泌的细胞因子在自身免疫性疾病的发生和发展过程中起重要作用。Nanke等[12]检测了15例SS患者唾液腺组织中IFN-γ+细胞和IL-17+细胞比例的结果发现:SS患者唾液腺组织中可以检测到上述细胞的表达,提示Th1/Th17在SS的病理过程中起重要的作用。多项研究[13-14]表明:SS患者泪液中IL-17表达水平升高,与泪膜破裂时间(tear film breakup time,TBUT)和基础泪液分泌实验(Schirmer Ⅰ test)有密切关联,提示IL-17参与了具有干眼症的SS患者的发病过程。Lin等[15]采用唾液腺蛋白免疫野生型小鼠可出现SS的典型症状,在唾液腺的淋巴细胞病灶中可检测Th17细胞的增加,免疫IL-17基因敲除的小鼠则不会出现SS的症状,过继免疫Th17细胞后IL-17基因敲除的小鼠则会出现SS的典型症状,唾液的分泌明显下降,血清中出现自身抗体,进而出现明显的炎症反应和组织损伤。Szodoray等[16]检测了51例未分化结缔组织病(undifferentiated connective tissue disease,UCTD)患者外周血Th17和Treg细胞分布的结果发现:与对照组比较,UCTD组Th17细胞增加,若最终发展为系统性自身免疫性疾病(systemic autoimmune diseases,SAIDs)时,Th17细胞的比例进一步增加。从对照到UCTD患者Th17/Treg比值逐渐升高,如发展为SAID患者将会出现最高值。Th17/Treg的失衡可能有助于疾病进展,因此Th17/Treg可以作为评估预后的指标。Wang等[17]研究发现:环孢素(Cys A)能抑制Th17细胞的表达,提示Cys A可以治疗SS和其他自身免疫性疾病。本研究结果显示:含有IL-10的SB转座子系统可以降低NOD小鼠脾细胞中Th17细胞比例,升高Treg细胞比例,明显降低Th17/Treg比值,提示含有IL-10 的SB转座子系统可以通过调节Th17和Treg细胞比例及其平衡,从而对SS起到一定的治疗作用。
综上所述,通过SB转座子系统在体内体外均可以高表达IL-10。IL-10高表达后NOD小鼠脾细胞中CD4+IL-10+细胞比例明显升高,CD4+IFN-γ+细胞下降,IFN-γ+/IL-10+比值明显下降,Th17细胞比例下降,Treg细胞比例上升,Th1/Th2和Th17/Treg比值明显下降,提示含有IL-10 的SB转座子系统可以通过调节Th1、Th2、Th17和Treg细胞比例以及逆转Th1/Th2和Th17/Treg平衡对SS起到一定的治疗作用。
[参考文献]
[1] Lavoie TN,Lee BH,Nguyen CQ.Current concepts: mouse models of Sjögren’s syndrome[J].J Biomed Biotechnol,2011,2011:549107.
[2] Szodoray P,Gal I,Barath S,et al.Immunological alterations in newly diagnosed primary Sjögren’s syndrome characterized by skewed peripheral T-cell subsets and inflammatory cytokines[J].J Rheumatol,2008,37(3): 205-212.
[3] 牛广华,张艺凡,高玉洁,等.外周血T细胞亚群及IL-17、IL-10在原发性干燥综合征的表达[J].检验医学与临床,2015,12(18):2664-2665.
[4] 房星星,路臻豪,汤建平,等.MSCs通过促分泌TGF-β1、IL-6和IL-10抑制干燥综合征患者CD4+T细胞的活化增殖[J].同济大学学报:医学版,2016,37(4):31-35.
[5] Heo YJ,Joo YB,Oh HJ.et al.IL-10 suppresses Th17 cells and promotes regulatory T cells in the CD4+T cell population of rheumatoid arthritis patients[J].Immunol Lett,2010,127(2): 150-156.
[6] Swierczek M,Izsvák Z,Ivics Z.The Sleeping Beauty transposon system for clinical applications[J].Expert Opin Biol Ther,2012,12(2):139-153.
[7] Sabat R,Grütz G,Warszawska K,et al.Biology of interleukin-10[J].Cytokine Growth Factor Rev,2010,21(5):331-344.
[8] Schulze-Tanzil G,Zreiqat H,Sabat R,et al.Interleukin-10 and articular cartilage: experimental therapeutical approaches in cartilage disorders[J].Curr Gene Ther,2009,9(4):306-315.
[9] Verhenne S,Vandeputte N,Pareyn I,et al.Long-term prevention of congenital thrombotic thrombocytopenic purpura in ADAMTS13 knockout mice by sleeping beauty transposon-mediated gene therapy[J].Arterioscler Thromb Vasc Biol,2017,37(5):836-844.
[10]Inoue H,Kishimoto A,Ushikoshi-Nakayama R,et al.Resveratrol improves salivary dysfunction in a non-obese diabetic (NOD) mouse model of Sjögren’s syndrome[J].J Clin Biochem Nutr,2016,59(2):107-112.
[11]Wu G,Wu N,Li T,et al.Total glucosides of peony ameliorates Sjögren’s syndrome by affecting Th1/Th2 cytokine balance[J].Exp Ther Med,2016,11(3):1135-1141.
[12]Nanke Y,Kobashigawa T,Yago T,et al.Detection of IFN-γ+IL-17+ cells in salivary glands of patients with Sjögren’s syndrome and Mikulicz’s disease: Potential role of Th17oTh1 in the pathogenesis of autoimmune diseases[J].Nihon Rinsho Meneki Gakkai Kaishi,2016,39(5):473-477.
[13]Lee SY,Han SJ,Nam SM,et al.Analysis of tear cytokines and clinical correlations in Sjögren syndrome dry eye patients and non-Sjögren Syndrome dry eye patients[J].Am J Ophthalmol,2013,156(2):247-253.
[14]Tan X,Sun S,Liu Y,et al.Analysis of Th17-associated cytokines in tears of patients with dry eye syndrome[J].Eye (Lond),2014,28(5):608-613.
[15]Lin X,Rui K,Deng J,et al.Th17 cells play a critical role in the development of experimental Sjögren’s syndrome[J].Ann Rheum Dis,2015,74(6):1302-1310.
[16]Szodoray P,Nakken B,Barath S,et al.Altered Th17 cells and Th17/regulatory T-cell ratios indicate the subsequent conversion from undifferentiated connective tissue disease to definitive systemic autoimmune disorders[J].Hum Immunol,2013,74(12):1510-1518.
[17]Wang K,Shi L,Yu Z,et al.Cyclosporine A suppresses the activation of the Th17 cells in patients with primary sjögren’s syndrome[J].Iran J Allergy Asthma Immunol,2015,14(2):198-207.

