纳米技术在物理刺激诱导肿瘤治疗中的应用探索
宋雪娇,刘 庄
苏州大学功能纳米与软物质研究院,江苏 苏州 215123
1 引言
癌症是本世纪威胁人类健康的主要因素1。目前临床上常用的癌症治疗策略主要有手术治疗,放射治疗以及化学疗法。其中,手术治疗是将肿瘤从病人身体上切除,这种侵入式的治疗方法很难完全根除肿瘤尤其是针对已经发生转移的肿瘤。
另一方面,化学疗法与放射治疗也具有很多局限性,比如严重的毒副作用,有限的治疗效果,易产生耐药性以及造成免疫系统的损伤2–5。综上所述,发展一种新型肿瘤治疗方法势在必行。在过去几十年里发展的各种新型肿瘤治疗方法中,物理刺激如光,磁场,超声,射频或者X-射线诱导的肿瘤治疗策略在纳米医学领域受到广泛关注6–12。
物理刺激诱导的治疗在很多临床前期的动物实验中表现出增强的治疗效果并且可以有效降低副作用。尽管这种治疗策略目前还处于研究早期,但是和传统化疗相比,物理刺激诱导治疗表现出很多独特的优势,如(1) 很多物理刺激诱导的治疗可以通过将刺激源特定作用与病灶部位从而有效调控治疗效果同时降低正常组织的损伤;(2) 一些物理刺激如磁场可以提高治疗试剂在肿瘤部位的富集量,从而增强治疗疗效;(3) 一些物理刺激可以促进肿瘤细胞对药物的摄取量,或者刺激药物在病灶部位的释放,这些机制可以实现增强化疗药物的疗效的同时降低药物的系统毒性的目的;(4) 物理刺激诱导的治疗策略自身不仅可以杀死肿瘤细胞,还可以与其他治疗手段联合,通过不同的机制达到协同治疗的效果。
利用纳米材料独特的物理性质,各种物理刺激被用于肿瘤治疗的研究中。光学治疗是一类利用外在物理光源与纳米材料相结合从而杀死肿瘤细胞的策略。在光学治疗中,利用近红外吸收的试剂或者光敏剂,光能可以被转化为热能或者单线态氧/活性氧自由基,从而摧毁肿瘤细胞13–19。磁场是另外一类较为广泛使用的物理外力。磁性纳米试剂不仅可以在外在振荡磁场作用下产生热, 还可以在磁场作用下被吸附到肿瘤部位20–23。超声作用是利用微气泡技术实现治疗药物在病灶部位的输送与释放24,25。此外,在特定的纳米试剂的帮助下,波长比光学波长长很多的射频以及波长比可见光的波长更短但能量很大的X射线可以用于肿瘤的物理刺激诱导治疗中26,27。
将物理刺激诱导的治疗与纳米医学结合到一起需要利用纳米诊疗试剂作为桥梁。诊疗是一个很热门的概念,它是指利用一个纳米体系同时实现诊断与治疗28,29。尽管相关的研究备受关注,但是将成像与治疗功能融于一个体系中是否比单独进行诊断和治疗更具有治疗优势还是一个备受争议的问题。简单的将药物分子与成像探针复合成纳米颗粒是否可以弥补单独治疗与成像的不足还值得深入研究30。对于传统的化疗,同时实现成像与治疗的效果并不显著。因此,通过简单的混合药物分子和成像探针的方式实现的诊疗一体相比于传统治疗手段的优势并不是很清晰。
诊疗在物理刺激诱导的治疗中具有独特的优势:(1) 传统的化疗中,化疗药物通常分布在全身各个部位。然而,物理刺激诱导的治疗可以实现选择性的在肿瘤部位加入外界刺激作用。因此,精确的成像信息在这个过程中就显得特别重要,因为它可以提供肿瘤的位置,尺寸,形状以及与周边组织的关系。这些信息可以保障最佳效果的治疗,同时对周边组织损伤降到最低;(2) 实现治疗效果的最大化通常要在刺激相应性纳米材料在肿瘤部位的富集达到最大时进行治疗。因此,利用成像实时监测纳米试剂在活体内尤其是在肿瘤部位的分布可以确定进行治疗的最佳治疗时间;(3) 成像还可以用于监控物理刺激的治疗反应,从而实时调控外部刺激的剂量。
虽然实时监控治疗试剂在传统化疗中的意义有限,但是诊疗的概念在物理刺激诱导的治疗策略中具有独特的优势。考虑到这些因素,研究人员投入了大量的精力研究了对不同物理刺激相应性的纳米诊疗试剂。在这篇综述中,我们总结了最近在纳米诊疗试剂在物理刺激诱导的治疗中取得的最新进展,同时我们讨论了该方法在多学科领域中未来的发展空间。

刘庄,1982年8月生。苏州大学功能纳米与软物质研究院教授,国家杰青,Biomaterials杂志副主编,从事纳米生物材料与纳米医学领域研究。
2 纳米诊疗试剂在光引发的治疗中的应用
光热治疗和光动力治疗是两种不同的肿瘤光学治疗方法。光热治疗是利用在近红外有光学吸收的试剂在光照下吸收光能转化为热能,杀死肿瘤细胞的策略18。光动力治疗是利用光敏分子在合适光源的照射下被激发产生的单线态氧以及活性氧自由基杀死肿瘤细胞的方法16。很多纳米诊疗试剂被广泛的用于光引发的治疗中。
2.1 纳米诊疗试剂在光热治疗中的应用
为了实现安全有效的光热治疗,光热试剂通常要具有良好的生物相容性,在近红外有较好的光学吸收,并且有良好的肿瘤靶向能力。在过去的几十年里,各种各样在近红外有光学吸收的纳米材料被用于光热治疗。其中,无机纳米材料如金纳米材料,碳纳米材料,过渡金属硫化物及氧化物等通过适当的表面修饰后可以在光热治疗中取得良好的效果31–35。但是无机纳米材料的长期毒性问题仍不容忽视。
有机近红外吸收的共轭高分子如聚苯胺、聚吡咯等在光热治疗中的应用十分广泛。尽管共轭聚合物在近红外区域具有较强的光学吸收,同时在动物实验中取得了良好的治疗效果,但是共轭聚合物的生物降解性还有待深入研究14,36–38。包含近红外小分子染料的纳米自主装体系如胶束、脂质体、卟啉体以及基于蛋白的光热试剂具有生物相容性和生物可降解的特征,因此近年来取得了安全有效的治疗效果39,40。尽管光热治疗在临床前期的动物水平取得了良好的治疗效果,但是在临床上还没有得到正式批准。
为了取得更好的治疗效果,纳米诊疗试剂被用于成像引导的光热治疗中。近红外染料不仅可以作为光热试剂,它本身的荧光常被用做活体荧光成像。吲哚菁绿(ICG)已经被美国食品药品监督局批准用于临床。ICG可以包载在胶束或者脂质体内,也可以与蛋白结合,同时实现荧光成像以及光热治疗39。
在荧光成像中,为了达到良好的成像效果通常要求探针具有较高的荧光量子产率。然而,高效的光热转化效率则要求较低的量子产率。为了解决这个矛盾,我们最近的工作发现一种新型的近红外染料七甲川吲哚菁绿(IR825)与人血清白蛋白(HSA)相结合后形成的HSA-IR825复合物在600 nm波长激发下具有一个高达40%的量子产率,然而在808 nm波长下,该纳米复合物具有较强的光学吸收同时其量子产率只有1%。这种纳米复合物可以同时用于理想的荧光成像和光热治疗。静脉注射HSA-IR825后,活体水平的荧光成像引导的光热治疗有效地抑制了肿瘤的生长41。
除了荧光成像外,光声成像也是一种常用的用于引导光热治疗的成像手段。很多光热试剂都可以用作光声成像的造影剂。与传统光学成像技术相比,光声成像具有较高的组织穿透深度以及空间分辨率42,43。
另外一些用于全身成像的成像技术如磁共振成像,计算机断层成像(CT成像),超声成像以及核素成像也被用于成像引导的光热治疗中。近年来,各种类型的融合了磁共振成像的纳米诊疗光热试剂被开发出来,比如将近红外纳米材料与磁性纳米颗粒结合,或者标记上顺磁性金属离子如Gd3+、Mn2+,利用上述方法可以实现磁共振成像引导的光热治疗44–48。我们课题组采用原位聚合的方法得到了共轭高分子聚吡咯包裹的超小四氧化三铁的纳米复合物,该纳米复合物通过层层包裹的高分子修饰后,接上聚乙二醇后具有良好的稳定性。该纳米颗粒不仅可以作为光声成像的造影剂,同时还具有磁共振成像的功能,在多种成像技术的引导下,体内光热治疗取得了优异的治疗效果,如图1所示19。一些无机光热试剂,如金纳米材料,二硫化钨以及硒化铋纳米片不仅具有较高的近红外吸收,还具有较好的X射线吸收的性质,因而可以实现CT成像引导的光热治疗34,49–52。一些微气泡常用作超声造影剂,在微气泡表面包覆一层金或者聚吡咯便可以同时实现超声成像与治疗53,54。核素成像包括正电子放射断层显像与单光子发射计算机断层显像,它具有高灵敏度,并且具有全身定量成像的功能。标记了放射性同位素的光热试剂,如64Cu标记的硫化铜或者硫化钼可以用于核素成像引导的光热治疗35,49,55–59。
在上述的成像模式中,核素成像具有最好的灵敏度,但是不能提供解剖学信息;CT成像具有良好的空间分辨率,但是灵敏度较低。磁共振成像不仅具有良好的灵敏度,同时也可以提供高分辨率的解剖学信息,因而在物理刺激诱导的治疗中具有独特的优势。临床上,多种成像手段联合使用可以取长补短。
2.2 纳米诊疗试剂在光动力治疗中的应用
与光热治疗相比,光动力是临床上相对成熟的光学治疗手段。光动力包含三个主要因素:光源、氧气和光敏分子15。在光动力中,光敏分子在适当的光源照射下会产生单线态氧或者活性氧自由基从而杀死细胞16。各种光敏分子如卟啉、亚甲基蓝和二氢卟吩e6等被广泛用于基础研究以及临床应用中。但是,这些光敏分子存在普遍的缺陷,即其水溶性差并且肿瘤靶向能力非常弱60。为了克服这些缺点,研究人员利用各种各样纳米颗粒作为光敏分子载体,从而提高光动力治疗效率。有机纳米材料如脂质体、胶束、多糖、蛋白、树枝状大分子以及中空的聚合物微囊等被广泛用作光敏剂载体61–69。此外,各种独特有趣的无机纳米材料如硅材料、金属材料、磁材料、量子点以及碳纳米材料也被用于装载光敏剂或者自身作为光动力试剂65,70–73。
由于光敏剂通常本身带有荧光,因此荧光成像常用于引导光动力治疗。此外,研究发现卟啉环可以螯合金属离子,并用作磁共振成像或者核素成像的造影剂。以 Zheng课题组74–78开发的卟啉体为例,脂质与卟啉结合后可以在水溶液中自主装作用形成类似脂质体的纳米结构。在这个纳米体系中,该自主装纳米颗粒可以作为光热试剂,其解离状态时又可以作为光动力试剂。卟啉体还可以螯合Mn2+和64Cu,并可以分别用于T1加权的磁共振成像以及正电子放射断层成像79。
包含卟啉的神经酰胺脂质体纳米复合物是另外一种有趣的光动力试剂。Dai与其同事80合成了porphyrin-organoalkoxysilylated脂质,并将其用于装载卟啉的神经酰胺脂质体的合成中,如图2所示。
在这个体系中,由于卟啉是共价接到神经酰胺脂质体上,因此可以有效降低光敏剂过早释放的量,并且药物装载率可以达到33.46%,明显高于脂质体装载光敏剂的装载率。该结构中存在的双烷基链可以在空间上阻止卟啉相互接触,因此可以避免造成聚集以及自淬灭现象。此外,类似硅一样的表面赋予了神经酰胺脂质体良好的稳定性,同时内在的多孔性也可以让氧气在神经酰胺脂质体内自由扩散。卟啉体规整的排列可以保证高效的单线态氧的产生量。其中心的亲水核心还可以装载化疗药物并用于发展化疗与光动力联合治疗的纳米体系81。综上所述,装载卟啉的体系可以作为一种有效的光动力纳米诊疗试剂。
目前用于激发光敏剂的通常是可见光,但可见光的组织穿透深度有限,因此光动力在治疗内在肿瘤或者较大尺寸的肿瘤时治疗效率有限。含有稀土元素的上转化纳米材料可以实现近红外光激发的光动力治疗。Zhang课题组82首次利用包载光敏剂的多孔硅包覆上转化纳米颗粒并实现了体外近红外光激发的光动力治疗。我们课题组首次实现了活体水平的近红外光激发的光动力治疗。在这个工作中,光敏剂二氢卟吩e6装载在聚乙二醇包裹的上转化纳米颗粒(UCNP),合成了UCNP-Ce6纳米复合物并可以用于活体水平的近红外激发的光动力治疗。与传统的采用可见光激发的光动力治疗相比,我们开发的UCNP-Ce6在活体治疗中显示出明显增强的组织穿透深度,如图3所示11。此后,基于上转化纳米颗粒光动力治疗被很多课题组所报道,并且在活体治疗中取得了显著的治疗效果。值得关注的是,UCNPs本身可以作为上转化发光成像,磁共振成像,CT成像等优异的纳米探针,可以作为良好的成像引导的光动力治疗试剂83–87。

图1 聚吡咯包裹的超小四氧化三铁纳米复合物在多功能成像引导下的肿瘤光热治疗中的应用
2.3 光触发的联合治疗

图2 卟啉偶联到神经酰胺脂质体上形成的纳米复合物用于肿瘤的光动力诊疗
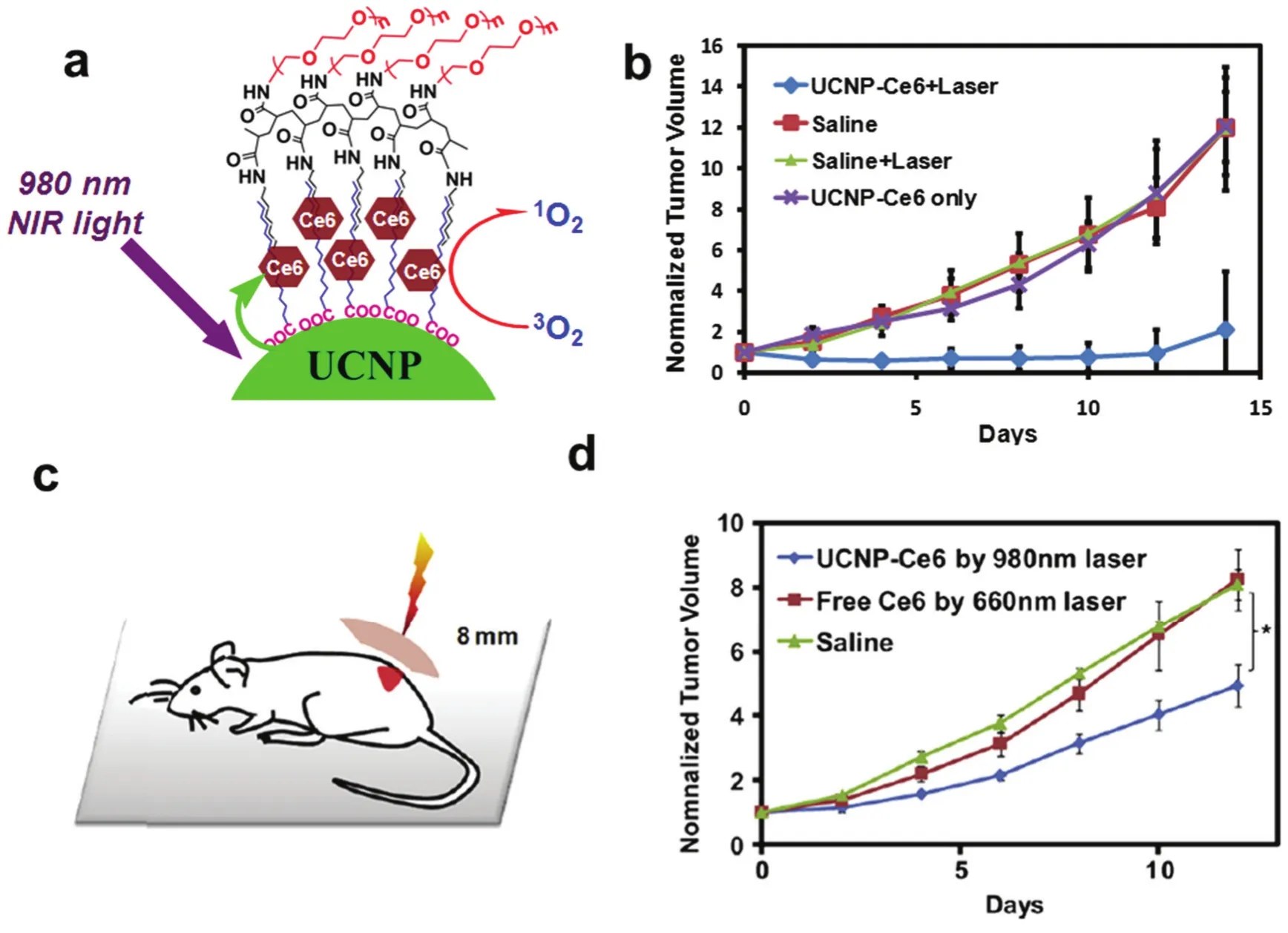
图3 UCNPs在近红外激发的活体光动力治疗中的应用
光学治疗通常会与其他治疗方法如化疗、放疗、基因治疗、手术治疗以及免疫治疗结合以实现肿瘤协同治疗的效果。近些年来,很多近红外吸收的纳米载体被用来装载化疗药物以达到光热治疗与化疗的联合治疗的目的。例如金纳米棒、石墨烯、碳纳米管、硫化铜纳米颗粒以及其他一些纳米颗粒包覆了多孔硅后可以用来装载化疗药物88–92。另外,一些光热试剂如碳纳米材料和共轭聚合物自身可以通过疏水作用以及π-π堆积作用装载药物分子93,94。在我们最新的工作中,我们采用三种临床批准的试剂-人血清白蛋白(HSA),紫杉醇(PTX)以及吲哚菁绿(ICG)通过自主装形成了类似Abraxane的纳米诊疗试剂。得到的HSA-PTX-ICG纳米颗粒可以用于荧光成像引导的光热治疗与化疗的联合治疗,不仅可以治疗皮下肿瘤,同时对肺部转移的肿瘤模型也有良好的治疗效果95。在我们最新的一个工作中,我们还采用这种药物诱导的自主装策略开发了具有主动靶向功能的用于光热治疗和光动力联合治疗的纳米诊疗试剂96,如图4所示。在这些要去诱导的体系中,通常采用的方法非常简单。另外由于所采用的药品均为临川批准的,相比于传统的化疗药物具有更好的治疗效果,因此具有较大的临床转化潜力。
光热治疗与其他治疗相结合达到协同效应有不同的机制,如(1)当纳米载体进入细胞后,光热试剂产生的光热效应可以刺激药物的释放97,98;(2)近红外光热试剂的热效应还可以促进细胞对纳米载体的摄取量,这种途径可以促进化疗药物、光敏剂以及DNA或者小干扰RNA等进入细胞,并提高化疗、光动力治疗以及基因治疗的疗效89,99,100;(3)当肿瘤的温度超过50 °C时,细胞会被“烧死”,但是当温度低于45 °C时,微热作用可以改善肿瘤微环境如增加血流量,肿瘤内部氧气含量以及肿瘤血管灌注和渗透性,这些改变可以有效增强材料在肿瘤部位的富集量101,102。
光热治疗除了与上述提到的治疗联合外,最新的报道发现光热治疗可以与外放疗或者内放疗联合,可以达到协同治疗的效果101,103。Shi课题组利用硅包覆含有超小硫化铜纳米颗粒的上转化纳米材料实现了光热治疗与放射治疗的肿瘤联合治疗104。在我们最近的工作中,我们合成了多功能的MnSe@Bi2Se3核壳结构的纳米材料,该纳米材料可以用于多功能成像引导的光热与放疗的联合治疗中102。我们发现纳米材料在肿瘤部位较高的富集量可以有效集中放射能量,此外温和的光热效应可以有效提高肿瘤内部的氧气含量,从而改善乏氧,这些机制解释了光热治疗与放疗联合治疗的协同效应产生的原因。
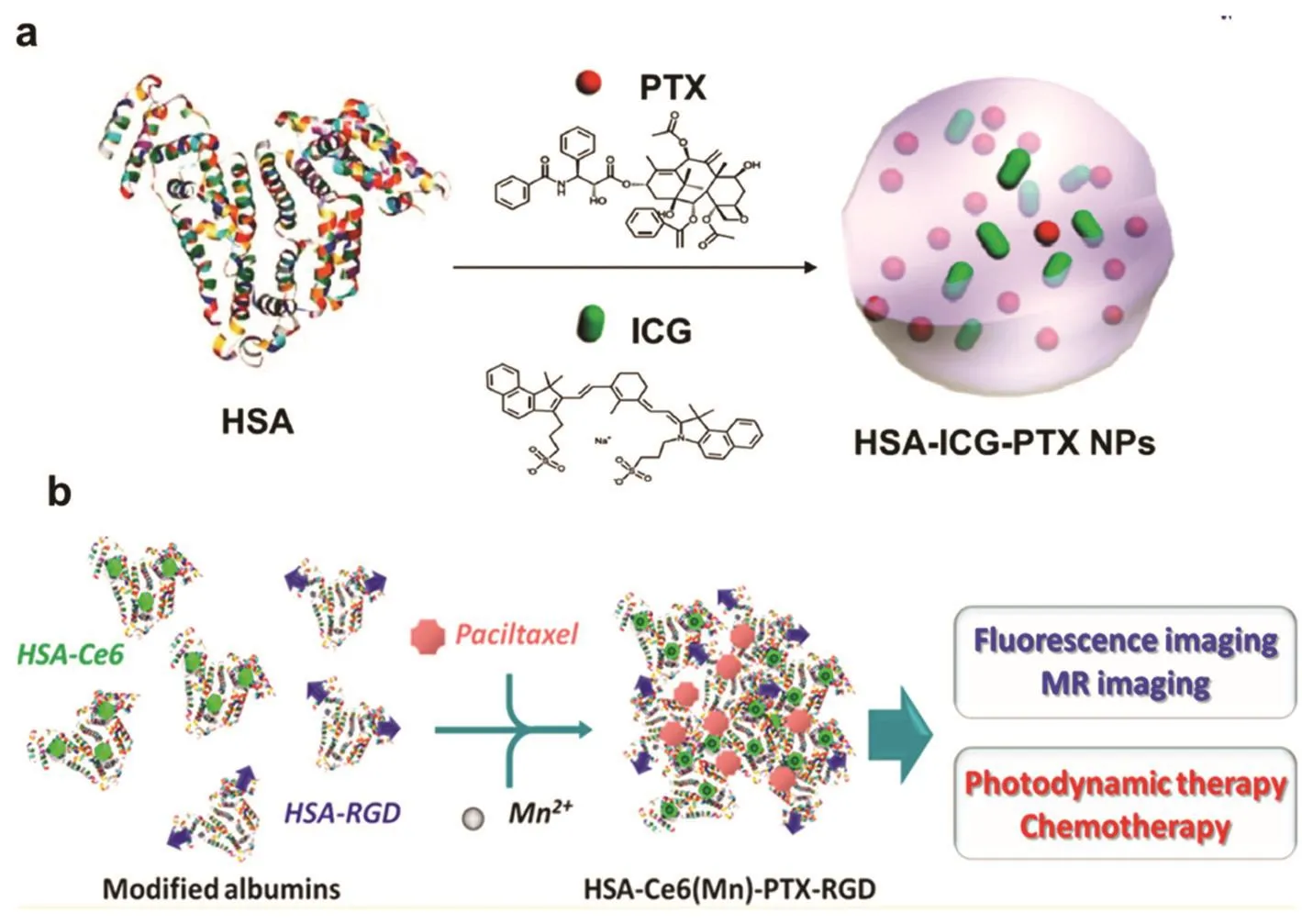
图4 药物诱导的纳米自组装药物载体用于肿瘤的联合治疗
在我们最近的工作中发现光热治疗还可以作为手术治疗的辅助治疗手段。在肿瘤转移的早期阶段,原位肿瘤附近的哨位淋巴结是肿瘤细胞的首选靶向位置。白蛋白纳米颗粒注射到原位肿瘤后可以在淋巴结有较好的富集,利用这种基于蛋白的诊疗试剂,我们证明了手术切除原位瘤后,光热治疗可以有效清除淋巴结中转移的癌细胞。这种方法可以有效抑制癌细胞的转移并有效延长小鼠的生长周期105。综上所述,光热辅助的手术治疗使得光热治疗具有一定的临床转化价值。
除了上述提到的效应外,在我们最近的一个工作中,我们发现聚乙二醇修饰的单壁碳纳米管(SWNTs)不仅可以作为光热试剂消除肿瘤,还可以作为一种良好的免疫佐剂106。光热消除肿瘤会产生肿瘤相关免疫抗原,这些抗原在纳米佐剂SWNTs的作用下产生强大的免疫效应。然而这些抗肿瘤效应会受调节T细胞限制。当我们采用临床批准的可以抑制调节T细胞的作用的肿瘤免疫治疗药物抗CTLA-4抗体与SWNTs的光热作用联合时,可以有效抑制距离原始肿瘤较远的第二个肿瘤的生长以及肺部转移瘤的生长,获得了一个非常优异的肿瘤联合治疗效果。综上所示,采用纳米试剂作为光热试剂产生的肿瘤治疗效果可以产生额外的抗肿瘤免疫效果,这一点用传统的手术治疗是达不到的。

图5 交变磁场作用下磁热响应性的纳米颗粒在肿瘤治疗中的应用
3 纳米诊疗试剂在磁场响应的治疗中的应用
磁场是另一种常用的用于引发或者增强肿瘤治疗的外部物理刺激。磁性纳米颗粒,如不同尺寸形貌的四氧化三铁纳米颗粒进过表面修饰后不仅可以作为磁共振成像的造影剂,还可以作为治疗试剂或者药物载体用于装载治疗试剂107–109。
3.1 磁热效应
磁热治疗是指铁磁性或者超顺磁性的材料在交变磁场作用下产生热能杀死肿瘤细胞的策略21,110,111。磁热治疗在各种肿瘤如前列腺癌、胶质瘤、胆管癌、口腔癌等中有良好的治疗效果。磁热效应不仅可以直接杀死肿瘤细胞,还可以用来刺激药物释放112–114。2012年,Lee和他的同事115开发了响应性的药物输送和装载体系。他们利用化疗药阿霉素(DOX)、Ad-PAMAM、CD-PEI、Ad-PEG以及6 nm的具有超顺磁性的Zn0.4Fe2.6O4,通过自组装方式形成超大分子Dox@SMNPs。Dox@SMNPs在交变磁场作用下可以产生热并刺激药物释放。利用这个策略,活体水平的肿瘤治疗取得了显著的治疗效果,如图5所示。
与光热治疗中用的光相比,磁热效应中磁场具有明显增强的组织穿透深度。但是磁热的效率通常会低于光热,因而磁性颗粒需要在肿瘤部位有非常高的富集量才能达到消除癌细胞的目的。但是通过静脉给药方式很难在肿瘤部位达到有效的剂量。此外,光源更便于集中在病灶部位,而磁场较难控制,因而会对周边正常组织造成损伤。
3.2 磁场诱导的肿瘤靶向
磁靶向是增强纳米材料在肿瘤部位富集并提高肿瘤治疗效率的一种独特的策略。上世纪六十年代,Freeman等114提出在外界磁场作用下,磁性纳米颗粒可以靶向到特定部位。在后来的几十年间,很多磁性纳米材料被用于肿瘤的磁靶向研究中。在我们最近的研究中,我们利用聚乙二醇修饰的四氧化三铁纳米簇实现了肿瘤的磁靶向并取得了显著的光动力治疗与光热治疗疗效。在外界磁场的作用下,纳米颗粒在肿瘤部位的富集量明显增强,从而可以提高治疗效率116。在我们课题组另外一个工作中,利用四氧化三铁纳米颗粒修饰后的红细胞装载化疗药物和光敏剂得到多功能诊疗试剂。在外界磁场作用下可以实现肿瘤的联合治疗并在非常低的药物剂量下取得显著增强的治疗效果,如图6所示117。
总的来说,为了达到良好的磁靶向效果,纳米载体需要对外部磁场快速响应并且具有较长的血液循环时间。与在纳米颗粒表面偶联具有靶向功能的配体的主动靶向策略相比,磁靶向是借助外界磁场的作用,因而不会受到肿瘤靶向受体种类的限制,从而可以用于靶向不同类型的肿瘤。虽然磁靶向对于皮下肿瘤模型的靶向效果明显,但是对于深层肿瘤,很难在肿瘤位置加入磁场作用。因此,这种磁靶向的策略要向临床转化还需要解决很多技术上的问题。

图6 不同磁性药物载体在外界磁场增强肿瘤靶向中的应用
4 纳米诊疗试剂在超声响应治疗中的应用
超声成像具有独特的优势如可进行实时成像,价格低廉并且安全性高。在超声造影剂的辅助下,临床上超声成像的分辨率和灵敏度都可以大幅度提高118–121。典型的超声造影剂是包裹气体的微米级气泡。包裹气体的材料如蛋白122,123、表面活性剂124,125、聚合物126或者脂质127,128用来保护内在的气体核如空气、氮气、六氟化硫或者全氟碳气体125,128–132。利用这些造影剂可以实现超声引导的治疗。除了诊断功能外,超声还可以通过非热效应和热效应实现肿瘤部位的药物释放和其他治疗功能133–136。
当超声造影剂在超声作用下,他们开始产生空穴效应。当超声强度足够大时,会产生微气流和冲击波,从而导致装载在超声造影剂上的药物定点释放。同时,超声产生的声孔效应会增强细胞对药物的摄取量。此外,超声产生的空穴效应有利于打开生物屏障。Lammers等137利用装载了超小超顺磁性的四氧化三铁纳米颗粒的微气泡在超声作用下打开了血脑屏障。另一方面,高强度聚焦超声可以产生热效应从而直接杀死癌细胞并且可以增强药物释放138,139。
装载药物,基因或者功能性纳米材料的纳米超声造影剂可以作为超声响应性的药物输送体系。Rapoport课题组利用生物可降解的PEG-PLLA嵌段共聚物作为稳定剂合成了装载 DOX的全氟正戊烷(PFP)纳米乳剂140。该纳米乳剂的沸点为29 °C,注射到小鼠体内后在生理温度条件下会很快气化成微米级的气泡,从而可以作为超声造影剂。静脉注射后,DOX-PFP纳米乳剂可以富集在肿瘤部位并且可以产生长时间的超声造影功能。同时,在超声作用下,DOX可以释放从而达到良好的化疗效果。同样的策略也用于紫杉醇装载的纳米乳剂,这种纳米乳剂在超声成像引导下可以治疗卵巢癌、乳腺癌以及胰腺癌等肿瘤模型。这种策略可以高效的治疗肿瘤,并有效提高化疗的治疗疗效。此外,由于超声成像在临床中的广泛应用,将其与临床批准的药物结合的策略具有良好的临床转化潜力。
超声除了可以刺激药物释放之外,还可以作为氧气释放的外部刺激。在我们最新的工作中,我们利用超声刺激溶解在全氟-15-冠醚(PFC)中的氧气释放从而改善肿瘤乏氧增强光动力治疗与放疗的疗效141。将人血清白蛋白作为PFC纳米乳剂的稳定剂可以得到稳定的纳米乳剂。该纳米乳剂可以高效溶解氧气,并且在超声作用下,氧气有快速响应性释放。利用这一特征,静脉注射 PFC纳米乳剂后,将小鼠置于吸氧状态,同时在肿瘤部位加入超声作用可以在短时间内有效提高肿瘤内部的氧气含量。利用这一策略,光动力治疗以及放射治疗的治疗效果可以得到显著提高,如图7所示。由于这一策略中所使用的药物在临床均有所使用,并且超声仪器也是临床广泛使用的仪器,因此该纳米颗粒与超声技术的结合具有广阔的临床转化潜力。
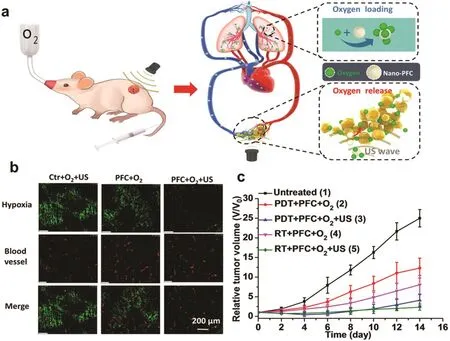
图7 超声刺激作用下,全氟碳纳米乳液在改善肿瘤乏氧并提高光动力治疗以及放射治疗中的应用
超声造影剂还可以作为良好的基因靶向递送的载体。声孔效应是一种有效促进大分子如质粒DNA外溢的方法,该方法可以提高大分子进入组织的量142,143。Shuai课题组144利用siRNA复合的聚合物胶束和含有气体空腔的脂质体合成了装载了siRNA的八氟丙烷(PFO)纳米气泡。该纳米气泡对超声十分敏感,因而,超声作用可以有效提高siRNA转录并增强基因沉默效率,在小鼠胶质瘤模型中取得了明显增强的治疗效果。
超声响应性的超声造影剂可以与药物,纳米颗粒,基因等相结合从而在诊断成像和肿瘤治疗中取得更高的效率。与其他物理刺激相比,超声具有较高的组织穿透深度,并且对正常组织没有损伤。超声不仅是一种简便的诊断手段,而且还可以刺激药物在病灶部位定点释放。此外,高强度聚焦超声本身可以产生热效应从而杀死癌细胞。以上这些优势使得超声成为一种多方位的外部刺激诱导的纳米诊断手段。超声造影剂的局限性主要是他们相对较大的尺寸(通常是几百纳米或者微米级别)会限制他们从血管渗出的效率。另外一方面,如果造影剂尺寸太小,他们的造影功能会大幅度降低。因此,良好的造影剂需要更加“灵活”,在一开始是大尺寸,然后在外部刺激作用下可以分解成纳米尺寸的药物载体,这样不仅可以提高组织穿透深度还可以增强肿瘤治疗疗效。

图8 热作用下产生气泡的装载碳酸氢铵脂质体的合成示意图以及在定向热刺激下在肿瘤部位释放药物的机制
5 其他物理刺激在肿瘤诊疗中的应用
近些年来,很多其他物理刺激如过高热,电离辐射以及射频也被用于肿瘤的诊疗中。电离辐射射线如X射线和伽马射线通常具有nm–fm级别非常短的波长,而射频通常具有无线电波频率,且该波长范围在mm–km之间。电离辐射和射频都被用于肿瘤刺激治疗的研究中。
5.1 传统过高热刺激的肿瘤治疗
过高热被广泛用于刺激热敏性纳米诊疗试剂随着温度变化发生相变时药物的响应性释放145–147。具有比正常体温稍高的相变温度的脂质可以被用于构建热敏感的脂质体药物载体148–150。二棕榈酰磷脂酰胆碱(DPPC)的相变温度在41 °C,这个温度比正常体温稍高,因而可以作为构建热敏性脂质体理想的磷脂。含有这种DPPC的脂质体可以在温度达到41 °C时,快速释放大量药物,而温度只有37 °C时,药物几乎没有释放。
与传统的热敏感的脂质体不同,Chen等设计了一种基于DPPC,胆固醇和二硬脂酰磷脂酰乙酰胺-聚乙二醇(DSPE-PEG)构成的脂质体,并装载了ABC/NH4HCO3以及阿霉素(DOX)151。当温度达到42 °C时,NH4HCO3会分解为CO2和NH3,产生的气泡可以提高磷脂层的渗透性,从而促进药物DOX的快速释放。这种装载NH4HCO3的脂质体可以在温和的温度下在肿瘤部位释放药物,如图8所示。
然而,传统的局部加热方法如使用热的工具或者微波具有很多缺陷,例如较低的热转换效率,非定向的大面积加热以及烧伤皮肤的危险。基于以上原因,将热敏性的药物输送体系与之前提到的物理刺激方法如光、磁场以及超声,达到在肿瘤部位选择性加热的目的将会是一种有效降低正常组织损伤,提高肿瘤治疗疗效的有效途径。
5.2 电离辐射刺激的肿瘤治疗
放射治疗是临床上常用的肿瘤治疗方法,它通过高能量射线如X射线和伽马射线杀死肿瘤细胞152。含有重元素的纳米颗粒可以吸收高能量的电离辐射,因而可以增强放射治疗疗效。例如,Zhang等153采用不同尺寸的聚乙二醇修饰的金纳米颗粒增强放射治疗。从他们的体外以及活体结果可以发现,尺寸为12.1和27.3 nm的聚乙二醇修饰的金纳米颗粒表现出较高的放射敏感度,在伽马射线照射下可以有效增强放射治疗。这种增强的放射治疗还可以与其他治疗方法相结合从而实现更加优化的治疗结果。
除了利用具有X射线吸收的纳米颗粒增强放射治疗外,还可以利用X射线引发光动力治疗。2008年,Liu等合成了LaF3:Tb3+-四(4-羧基苯基)卟吩(MTCP)纳米颗粒,该纳米颗粒在X射线照射下吸收X射线并发射出可见光从而激发光敏剂MTCP,产生的单线态氧可以有效杀死肿瘤细胞154。由于X射线的组织穿透深度较高,这种策略可以用于深层肿瘤的治疗。
5.3 射频刺激的肿瘤治疗
频率在10 kHz到900 MHz范围内的,具有长波长的射频可以产生热效应从而消除肿瘤细胞。相比于利用近红外光激发的光热治疗,射频具有更高的组织穿透深度,因而可以用于治疗深层的肿瘤。射频已经被食品及药物管理局批准用于肝癌治疗中155–158。然而,射频在肿瘤治疗中的应用受到了很多限制,比如非定向性以及侵略性的产热。最近,很多可以吸收射频能量的纳米材料被用于增强射频治疗的应用中。金纳米颗粒是一种理想的增强射频治疗的材料159–161。例如,Raoof等26将偶联了抗体的金纳米颗粒用于肿瘤的射频治疗中。在射频场的作用下,癌细胞内吞的金纳米颗粒可以吸收射频能量并转化为热能,从而杀死肿瘤细胞。此外,在2007年,Curley等发现单壁碳管也可以作为增强射频的有效试剂162。然而,在目前阶段,这些纳米材料在临床上用于射频治疗肿瘤的研究还比较少。
6 总结与展望
随着纳米诊疗技术的发展,物理响应刺激治疗作为一种新型治疗策略受到了广泛的关注。尽管物理刺激治疗的机制各不相同,但是他们在大体上具有一些相似的特征如较高的治疗的特异性以及与传统化疗相比较低的系统毒性。但是将这些物理刺激治疗手段推向临床应用还需要解决一系列重要的问题。
通过光引发的光学治疗在临床前期的动物实验中取得了高效的治疗效果,但是光有限的组织穿透深度依然是值得关注的问题。鉴于此,未来的光学治疗可能会仅限于治疗表皮的肿瘤如黑色素瘤或者内窥镜等仪器可以接触的肿瘤如喉癌,食道癌以及胃癌等。
另外一种光学治疗的潜在应用是用于手术治疗中,原位大肿瘤被切除后,消除较小肿瘤。例如,在我们组的一个工作中,利用纳米诊疗试剂在成像指导下消除原位肿瘤附近的哨位淋巴结后可以有效抑制肿瘤的进一步转移。该策略如果能实现临床转化将会很有应用潜力。
磁场作为一种物理刺激时不会存在像光一样的有限的组织穿透深度的限制。磁热和肿瘤的磁靶向都已经进入临床试验中。磁热治疗时,肿瘤部位需要大量的磁性纳米颗粒,因此,磁性纳米材料通常会通过瘤内注射的方式直接注射到肿瘤内部。但是瘤内注射在临床应用中具有一定的局限性,因此通过静脉注射磁性纳米颗粒,实现高效的磁热治疗具有非常重要的意义。为了实现这个目的,需要开发具有较强磁热转化效率以及肿瘤靶向效率的磁性纳米颗粒。另外,温和的磁热虽然不能直接杀死肿瘤细胞,但是这种温和的磁热效果可以较为容易实现,将它和化疗相结合就可以实现增强化疗的目的。此外,将磁场作用精准地集中于特定的部位在磁场诱导的肿瘤治疗中也非常重要。因此需要开发具有精准定位功能与磁场聚焦功能的仪器也是将磁热或者磁靶向功能用于临床肿瘤治疗的关键。
超声刺激的治疗具有很多独特的优势。例如,高强度聚焦超声已经在临床中得到应用,并且在病人身上表现出高效的肿瘤消除效率。借助纳米级别的超声响应的诊疗试剂,也许可以进一步实现治疗的特异性以及准确性。
考虑到其他的物理刺激的肿瘤治疗手段如X射线或者射频与纳米诊疗试剂相结合可能会为我们在对抗肿瘤的战斗中提供新的可能性。
将纳米级别的诊疗试剂推向临床引用的另外一个重要的问题是充分了解这些纳米试剂在活体内的行为如药代动力学、生物分布、降解、清除以及毒性等性质。这些行为通常可以通过控制纳米颗粒的化学组成、结构、尺寸以及表面修饰进行改变。尽管很多新型的纳米诊疗试剂在临床前期的研究中表现出良好的应用前景,并且纳米试剂在动物实验中没有明显的毒性。但是这些实验结果还不足以使这些纳米试剂通过食品与药物管理局的批准。基于此,生物可降解或者生物相容性的试剂在临床转化过程中将相对容易,对于非生物降解性以及含有无机核结构的纳米颗粒的临床转化具有较大的挑战。
尽管在物理刺激诱导的治疗中所用的纳米诊疗试剂在近年来被广泛研究,并且在临床前期的动物研究中取得了鼓舞人心的结果,但这些还只处于早期不成熟的阶段。从化学家的角度来看,通过一种简单的,高度可重复的方式合成真正安全、生物相容性好并且融合多种功能的纳米诊疗试剂还需要很多的改进。除此之外,肿瘤生物学家、肿瘤学专家、物理学家以及工程师的共同努力在这些物理刺激响应治疗向临床转化过程中显得尤为重要。
(1) Jemal, A.; Clegg, L. X.; Ward, E.; Ries, L. A.; Wu, X.; Jamison, P.M.; Wingo, P. A.; Howe, H. L.; Anderson, R. N.; Edwards, B. K.Cancer 2004, 101 (1), 3. doi: 10.1002/cncr.20288
(2) Mazzaferri, E. L.; Jhiang, S. M. Am. J. Med. 1994, 97 (5), 418.doi: 10.1016/0002-9343(94)90321-2
(3) Noordijk, E.; Clement, E. P.; Hermans, J.; Wever, A.; Leer, J.Radiother. Oncol. 1988, 13 (2), 83.doi: 10.1016/0167-8140(88)90029-1
(4) Kelland, L. Nat. Rev. Cancer 2007, 7 (8), 573.doi: 10.1038/nrc2167.
(5) Coates, A.; Abraham, S.; Kaye, S. B.; Sowerbutts, T.; Frewin, C.;Fox, R.; Tattersall, M. Eur. J. Cancer Clin. Oncol. 1983, 19(2),203. doi: 10.1016/0277-5379(83)90418-2
(6) Terentyuk, G. S.; Maslyakova, G. N.; Suleymanova, L. V.;Khlebtsov, N. G.; Khlebtsov, B. N.; Akchurin, G. G.; Maksimova,I. L.; Tuchin, V. V. J. Biomed. Opt. 2009, 14 (2), 021016.doi: 10.1117/1.3122371
(7) Luo, S.; Tan, X.; Fang, S.; Wang, Y.; Liu, T.; Wang, X.; Yuan, Y.;Sun, H.; Qi, Q.; Shi, C. Adv. Funct. Mater. 2016, 26 (17), 2826.doi: 10.1002/adfm.201600159
(8) Espinosa, A.; Di Corato, R.; Kolosnjaj-Tabi, J.; Flaud, P.;Pellegrino, T.; Wilhelm, C. ACS Nano 2016, 10 (2), 2436.doi: 10.1021/acsnano.5b07249
(9) Poissonnier, L.; Chapelon, J.Y.; Rouviere, O.; Curiel, L.; Bouvier,R.; Martin, X.; Dubernard, J. M.; Gelet, A. Eur. Urol. 2007, 51 (2),381. doi: 10.1016/j.eururo.2006.04.012
(10) Coussios, C.; Farny, C.; Ter Haar, G.; Roy, R. Inter. J.Hyperther. 2007, 23 (2), 105.doi: 10.1080/02656730701194131
(11) Wang, C.; Tao, H.; Cheng, L.; Liu, Z. Biomaterials 2011, 32(26), 6145. doi: 10.1016/j.biomaterials.2011.05.007
(12) Kumar, C. S.; Mohammad, F. Adv. Drug. Deliver. Rev.2011, 63 (9), 789. doi: 10.1016/j.addr.2011.03.008
(13) Huang, X.; El-Sayed, I. H.; Qian, W.; El-Sayed, M. A.J. Am. Chem. Soc. 2006, 128 (6), 2115.doi: 10.1021/ja057254a
(14) Cheng, L.; Yang, K.; Chen, Q.; Liu, Z. ACS Nano 2012, 6(6), 5605. doi: 10.1021/nn301539m
(15) Castano, A. P.; Demidova, T. N.; Hamblin, M. R.Photodiag. Photodyn. Ther. 2004, 1 (4), 279.doi: 10.1016/S1572-1000(05)00007-4
(16) Chatterjee, D. K.; Fong, L. S.; Zhang, Y. Adv. Drug Deliver Rev. 2008, 60 (15), 1627. doi: 10.1016/j.addr.2008.08.003
(17) Juarranz, Á.; Jaén, P.; Sanz-Rodríguez, F.; Cuevas, J.;González, S. Clin.Trans. Oncol. 2008, 10 (3), 148.doi: 10.1007/s12094-008-0172-2
(18) O’Neal, D. P.; Hirsch, L. R.; Halas, N. J.; Payne, J. D.;West, J. L. Cancer Lett. 2004, 209 (2), 171.doi: 10.1016/j.canlet.2004.02.004
(19) Song, X.; Gong, H.; Yin, S.; Cheng, L.; Wang, C.; Li, Z.;Li, Y.; Wang, X.; Liu, G.; Liu, Z. Adv. Funct. Mater. 2014,24 (9), 1194. doi: 10.1002/adfm.201302463
(20) Johannsen, M.; Gneveckow, U.; Eckelt, L.; Feussner, A.;Waldöfner, N.; Scholz, R.; Deger, S.; Wust, P.; Loening, S.;Jordan, A. Inter. J. Hyperther. 2005, 21 (7), 637.doi: 10.1080/02656730500158360
(21) Thiesen, B.; Jordan, A. Int. J. Hyperther. 2008, 24 (6), 467.doi: 10.1080/02656730802104757
(22) Dobson, J. Drug Develop. Res. 2006, 67 (1), 55.doi: 10.1002/ddr.20067
(23) Hergt, R.; Dutz, S.; Müller, R.; Zeisberger, M. J. Phys.:Condens. Mater. 2006, 18, (38), S2919.
(24) Wu, F.; Wang, Z. B.; Chen, W. Z.; Zhu, H.; Bai, J.; Zou, J.Z.; Li, K. Q.; Jin, C. B.; Xie, F. L.; Su, H. B. Ann. Surg.Oncol. 2004, 11 (12), 1061.doi: 10.1245/ASO.2004.02.026
(25) Rapoport, N. Y.; Kennedy, A. M.; Shea, J. E.; Scaife, C. L.;Nam, K. H. J. Control. Release 2009, 138(3), 268.doi: 10.1016/j.jconrel.2009.05.026
(26) Raoof, M.; Corr, S. J.; Kaluarachchi, W. D.; Massey, K. L.;Briggs, K.; Zhu, C.; Cheney, M. A.; Wilson, L. J.; Curley, S.A. Nanomed.: Nanotechnol. Biol. Med. 2012, 8 (7), 1096.doi: 10.1016/j.nano.2012.02.001
(27) Sawada, N.; Ishikawa, T.; Sekiguchi, F.; Tanaka, Y.;Ishitsuka, H. Clin. Cancer Res. 1999, 5 (10), 2948.
(28) Bardhan, R.; Lal, S.; Joshi, A.; Halas, N. J. Accounts Chem.Res. 2011, 44, (10), 936. doi: 10.1021/ar200023x
(29) Zhang, Z.; Wang, L.; Wang, J.; Jiang, X.; Li, X.; Hu, Z.; Ji,Y.; Wu, X.; Chen, C. Adv. Mater. 2012, 24 (11), 1418.doi: 10.1002/adma.201104714
(30) Kelkar, S. S.; Reineke, T. M. Bioconjugate Chem. 2011, 22(10), 1879. doi: 10.1021/bc200151q
(31) Huang, X.; Jain, P. K.; El-Sayed, I. H.; El-Sayed, M. A.Laser. Med. Sci. 2008, 23 (3), 217.doi: 10.1007/s10103-007-0470-x
(32) Yang, K.; Zhang, S.; Zhang, G.; Sun, X.; Lee, S.T.; Liu, Z.Nano Lett. 2010, 10 (9), 3318. doi: 10.1021/nl100996u
(33) Cheng, L.; Yang, K.; Li, Y.; Chen, J.; Wang, C.; Shao, M.;Lee, S. T.; Liu, Z. Angew. Chem. 2011, 123 (32), 7523.doi: 10.1002/ange.201101447
(34) Cheng, L.; Liu, J.; Gu, X.; Gong, H.; Shi, X.; Liu, T.; Wang,C.; Wang, X.; Liu, G.; Xing, H.; et al. Adv. Mater. 2014, 26(12), 1886. doi: 10.1002/adma.201304497
(35) Liu, T.; Shi, S.; Liang, C.; Shen, S.; Cheng, L.; Wang, C.;Song, X.; Goel, S.; Barnhart, T. E.; Cai, W.; et al. ACS Nano 2015, 9 (1), 950. doi: 10.1021/nn506757x
(36) Yang, K.; Xu, H.; Cheng, L.; Sun, C.; Wang, J.; Liu, Z. Adv.Mater. 2012, 24 (41), 5586. doi: 10.1002/adma.201202625(37) Yang, J.; Choi, J.; Bang, D.; Kim, E.; Lim, E. K.; Park, H.;Suh, J. S.; Lee, K.; Yoo, K. H.; Kim, E. K.; et al. Angew.Chem. Int. Ed. 2011, 50 (2), 441.doi: 10.1002/anie.201005075
(38) Song, X.; Chen, Q.; Liu, Z. Nano Res. 2015, 8 (2), 340.doi: 10.1007/s12274-014-0620-y
(39) Zheng, M.; Yue, C.; Ma, Y.; Gong, P.; Zhao, P.; Zheng, C.;Sheng, Z.; Zhang, P.; Wang, Z.; Cai, L. ACS Nano 2013, 7(3), 2056. doi: 10.1021/nn400334y
(40) Zheng, M.; Zhao, P.; Luo, Z.; Gong, P.; Zheng, C.; Zhang,P.; Yue, C.; Gao, D.; Ma, Y.; Cai, L. ACS Appl. Mater. Int.2014, 6 (9), 6709. doi: 10.1021/am5004393
(41) Chen, Q.; Wang, C.; Zhan, Z.; He, W.; Cheng, Z.; Li, Y.;Liu, Z. Biomaterials 2014, 35 (28), 8206.doi: 10.1016/j.biomaterials.2014.06.013
(42) Agarwal, A.; Huang, S.; O’donnell, M.; Day, K.; Day, M.;Kotov, N.; Ashkenazi, S. J. Appl. Phys. 2007, 102 (6),064701. doi: 10.1063/1.2777127
(43) Yang, X.; Stein, E. W.; Ashkenazi, S.; Wang, L. V. Wiley Interdiscip. Rev.: Nanomed. Nanobiotechnol. 2009, 1 (4),360.
(44) Kim, J.; Park, S.; Lee, J. E.; Jin, S. M.; Lee, J. H.; Lee, I. S.;Yang, I.; Kim, J. S.; Kim, S. K.; Cho, M. H.; et al. Angew.Chem. 2006, 118 (46), 7918. doi: 10.1002/ange.200602471(45) Zhou, Z.; Sun, Y.; Shen, J.; Wei, J.; Yu, C.; Kong, B.; Liu,W.; Yang, H.; Yang, S.; Wang, W. Biomaterials 2014, 35(26), 7470. doi: 10.1016/j.biomaterials.2014.04.063
(46) Liang, X.; Li, Y.; Li, X.; Jing, L.; Deng, Z.; Yue, X.; Li, C.;Dai, Z. Adv. Funct. Mater. 2015, 25 (9), 1451.doi: 10.1002/adfm.201402338
(47) Swanson, S. D.; Kukowska-Latallo, J. F.; Patri, A. K.;Chen, C.; Ge, S.; Cao, Z.; Kotlyar, A.; East, A. T.; Baker, J.R. Int. J. Nanomed. 2008, 3 (2), 201.
(48) Floyd, W. C., III; Klemm, P. J.; Smiles, D. E.; Kohlgruber,A. C.; Pierre, V. C.; Mynar, J. L.; Fréchet, J. M.; Raymond,K. N. J. Am. Chem. Soc. 2011, 133 (8), 2390.doi: 10.1021/ja110582e
(49) Zhou, M.; Zhang, R.; Huang, M.; Lu, W.; Song, S.;Melancon, M. P.; Tian, M.; Liang, D.; Li, C. J. Am. Chem.Soc. 2010, 132 (43), 15351. doi: 10.1021/ja106855m
(50) Huang, P.; Bao, L.; Zhang, C.; Lin, J.; Luo, T.; Yang, D.;He, M.; Li, Z.; Gao, G.; Gao, B.; et al. Biomaterials 2011,32 (36), 9796. doi: 10.1016/j.biomaterials.2011.08.086
(51) Zhou, Z.; Kong, B.; Yu, C.; Shi, X.; Wang, M.; Liu, W.;Sun, Y.; Zhang, Y.; Yang, H.; Yang, S. Sci. Rep. 2014,4.3653. doi: 10.1038/srep03653
(52) Chen, M.; Tang, S.; Guo, Z.; Wang, X.; Mo, S.; Huang, X.;Liu, G.; Zheng, N. Adv. Mater. 2014, 26 (48), 8210.doi: 10.1002/adma.201404013
(53) Ke, H.; Wang, J.; Dai, Z.; Jin, Y.; Qu, E.; Xing, Z.; Guo, C.;Yue, X.; Liu, J. Angew. Chem. 2011, 123 (13), 3073.doi: 10.1002/ange.201008286
(54) Ke, H.; Wang, J.; Tong, S.; Jin, Y.; Wang, S.; Qu, E.; Bao,G.; Dai, Z. Theranostics 2014, 4 (1), 12.doi: 10.7150/thno.7275
(55) Sun, X.; Huang, X.; Yan, X.; Wang, Y.; Guo, J.; Jacobson,O.; Liu, D.; Szajek, L. P.; Zhu, W.; Niu, G.; et al. ACS Nano 2014, 8 (8), 8438. doi: 10.1021/nn502950t
(56) Cheng, L.; Shen, S.; Shi, S.; Yi, Y.; Wang, X.; Song, G.;Yang, K.; Liu, G.; Barnhart, T. E.; Cai, W.; et al. Adv.Funct. Mater. 2016, 26(13), 2185.doi: 10.1002/adfm.201504810
(57) Liu, T. W.; MacDonald, T. D.; Shi, J.; Wilson, B. C.; Zheng,G. Angew. Chem. Int. Ed. 2012, 5 (52), 13128.doi: 10.1002/anie.201206939
(58) Morales-Avila, E.; Ocampo-García, B. E.; de María Ramírez, F.; Ferro-Flores, G. Radiolabeled Nanoparticles for Molecular Imaging. Available online:http://cdn.intechopen.com/pdfs/32695/InTech-Radiolabeled_nanoparticles_for_molecular_imaging.pdf (accessed on September 18, 2017).
(59) Sun, X.; Cai, W.; Chen, X. Accounts Chem. Res. 2015, 48(2), 286. doi: 10.1021/ar500362y
(60) Sharman, W. M.; Allen, C. M.; Van Lier, J. E. Drug Discov.Today 1999, 4 (11), 507.doi: 10.1016/S1359-6446(99)01412-9
(61) Roy, I.; Ohulchanskyy, T. Y.; Pudavar, H. E.; Bergey, E. J.;Oseroff, A. R.; Morgan, J.; Dougherty, T. J.; Prasad, P. N.J. Am. Chem. Soc. 2003, 125 (26), 7860.doi: 10.1021/ja0343095
(62) Ohulchanskyy, T. Y.; Roy, I.; Goswami, L. N.; Chen, Y.;Bergey, E. J.; Pandey, R. K.; Oseroff, A. R.; Prasad, P. N.Nano Lett. 2007, 7 (9), 2835. doi: 10.1021/nl0714637
(63) Lucky, S. S.; Soo, K. C.; Zhang, Y. Chem. Rev. 2015, 115(4), 1990. doi: 10.1021/cr5004198
(64) Tu, H. L.; Lin, Y. S.; Lin, H. Y.; Hung, Y.; Lo, L. W.; Chen,Y. F.; Mou, C. Y. Adv. Mater. 2009, 21 (2), 172.doi: 10.1002/adma.200800548
(65) Couleaud, P.; Morosini, V.; Frochot, C.; Richeter, S.;Raehm, L.; Durand, J.O. Nanoscale 2010, 2 (7), 1083.doi: 10.1039/C0NR00096E
(66) Jeong, H.; Huh, M.; Lee, S. J.; Koo, H.; Kwon, I. C.; Jeong,S. Y.; Kim, K. Theranostics 2011, 1, 230.
(67) Ricci-Júnior, E.; Marchetti, J. M. Int. J. Pharm. 2006, 310(1), 187. doi: 10.1016/j.ijpharm.2005.10.048
(68) Sun, Y.; Chen, Z. L.; Yang, X. X.; Huang, P.; Zhou, X. P.;Du, X.X. Nanotechnology 2009, 20 (13), 135102.doi: 10.1088/0957-4484/20/13/135102
(69) Allémann, E.; Rousseau, J.; Brasseur, N.; Kudrevich, S. V.;Lewis, K.; van Lier, J. E. Int. J. Cancer 1996, 66 (6), 821.doi: 10.1002/(SICI)1097-0215(19960611)66:6<821::AI D-IJC19>3.0.CO;2-5
(70) Lin, J.; Wang, S.; Huang, P.; Wang, Z.; Chen, S.; Niu, G.;Li, W.; He, J.; Cui, D.; Lu, G.; et al. ACS Nano 2013, 7 (6),5320. doi: 10.1021/nn4011686
(71) Juzenas, P.; Chen, W.; Sun, Y. P.; Coelho, M. A. N.;Generalov, R.; Generalova, N.; Christensen, I. L. Adv. Drug Deliv. Rev. 2008, 60 (15), 1600.doi: 10.1016/j.addr.2008.08.004
(72) Huang, P.; Lin, J.; Wang, X.; Wang, Z.; Zhang, C.; He, M.;Wang, K.; Chen, F.; Li, Z.; Shen, G.; et al. Adv. Mater.2012, 24 (37), 5104. doi: 10.1002/adma.201200650
(73) Chatterjee, D. K.; Yong, Z. Nanomedicine 2008, 3 (1), 73.doi: 10.2217/17435889.3.1.73
(74) Lovell, J. F.; Jin, C. S.; Huynh, E.; Jin, H.; Kim, C.;Rubinstein, J. L.; Chan, W. C.; Cao, W.; Wang, L. V.;Zheng, G. Nat. Mater. 2011, 10 (4), 324.doi: 10.1038/nmat2986
(75) Jin, C. S.; Cui, L.; Wang, F.; Chen, J.; Zheng, G. Adv.Healthc. Mater. 2014, 3 (8), 1240.doi: 10.1002/adhm.201300651
(76) Jin, C. S.; Lovell, J. F.; Chen, J.; Zheng, G. ACS Nano 2013, 7 (3), 2541. doi: 10.1021/nn3058642
(77) Jin, C. S.; Zheng, G. Laser. Surg. Med. 2011, 43 (7), 734.doi: 10.1002/lsm.21101
(78) Huynh, E.; Zheng, G. Nano Today 2014, 9 (2), 212.doi: 10.1016/j.nantod.2014.04.012
(79) Liu, T. W.; MacDonald, T. D.; Jin, C. S.; Gold, J. M.;Bristow, R. G.; Wilson, B. C.; Zheng, G. ACS Nano 2013, 7(5), 4221. doi: 10.1021/nn400669r
(80) Liang, X.; Li, X.; Yue, X.; Dai, Z. Angew. Chem. 2011, 123(49), 11826. doi: 10.1002/ange.201103557
(81) Cao, Z.; Ma, Y.; Yue, X.; Li, S.; Dai, Z.; Kikuchi, J. Chem.Commun. 2010, 46 (29), 5265. doi: 10.1039/B926367E
(82) Zhang, P.; Steelant, W.; Kumar, M.; Scholfield, M. J. Am.Chem. Soc. 2007, 129 (15), 4526. doi: 10.1021/ja0700707
(83) Idris, N. M.; Gnanasammandhan, M. K.; Zhang, J.; Ho, P.C.; Mahendran, R.; Zhang, Y. Nat. Med. 2012, 18 (10),1580. doi: 10.1038/nm.2933
(84) Cui, S.; Chen, H.; Zhu, H.; Tian, J.; Chi, X.; Qian, Z.;Achilefu, S.; Gu, Y. J. Mater. Chem. 2012, 22 (11), 4861.doi: 10.1039/C2JM16112E
(85) Chen, Q.; Wang, C.; Cheng, L.; He, W.; Cheng, Z.; Liu, Z.Biomaterials 2014, 35 (9), 2915.doi: 10.1016/j.biomaterials.2013.12.046
(86) Park, Y. I.; Kim, H. M.; Kim, J. H.; Moon, K. C.; Yoo, B.;Lee, K. T.; Lee, N.; Choi, Y.; Park, W.; Ling, D.; et al. Adv.Mater. 2012, 24 (42), 5755. doi: 10.1002/adma.201202433
(87) Cui, S.; Yin, D.; Chen, Y.; Di, Y.; Chen, H.; Ma, Y.;Achilefu, S.; Gu, Y. ACS Nano 2012, 7 (1), 676.doi: 10.1021/nn304872n
(88) Sahu, A.; Choi, W. I.; Lee, J. H.; Tae, G. Biomaterials 2013,34 (26), 6239. doi: 10.1016/j.biomaterials.2013.04.066
(89) Zhang, W.; Guo, Z.; Huang, D.; Liu, Z.; Guo, X.; Zhong, H.Biomaterials 2011, 32 (33), 8555.doi: 10.1016/j.biomaterials.2011.07.071
(90) Liu, H.; Chen, D.; Li, L.; Liu, T.; Tan, L.; Wu, X.; Tang, F.Angew. Chem. Int. Ed. 2011, 50 (4), 891.doi: 10.1002/anie.201002820
(91) Shen, S.; Tang, H.; Zhang, X.; Ren, J.; Pang, Z.; Wang, D.;Gao, H.; Qian, Y.; Jiang, X.; Yang, W. Biomaterials 2013,34(12), 3150. doi: 10.1016/j.biomaterials.2013.01.051
(92) Lu, F.; Wang, J.; Yang, L.; Zhu, J. J. Chem. Commun. 2015,51 (46), 9447. doi: 10.1039/C5CC01725D
(93) Wang, C.; Xu, H.; Liang, C.; Liu, Y.; Li, Z.; Yang, G.;Cheng, L.; Li, Y.; Liu, Z. ACS Nano 2013, 7 (8), 6782.doi: 10.1021/nn4017179
(94) Gong, H.; Cheng, L.; Xiang, J.; Xu, H.; Feng, L.; Shi, X.;Liu, Z. Adv. Funct. Mater. 2013, 23 (48), 6059.doi: 10.1002/adfm.201301555
(95) Chen, Q.; Liang, C.; Wang, C.; Liu, Z. Adv. Mater. 2015, 27(5), 903. doi: 10.1002/adma.201404308
(96) Chen, Q.; Wang, X.; Wang, C.; Feng, L.; Li, Y.; Liu, Z. ACS Nano 2015, 9 (5), 5223. doi: 10.1021/acsnano.5b00640
(97) Liu, J.; Wang, C.; Wang, X.; Wang, X.; Cheng, L.; Li, Y.;Liu, Z. Adv. Funct. Mater. 2015, 25 (3), 384.doi: 10.1002/adfm.201403079
(98) Ma, Y.; Liang, X.; Tong, S.; Bao, G.; Ren, Q.; Dai, Z. Adv.Funct. Mater. 2013, 23 (7), 815.doi: 10.1002/adfm.201201663
(99) Liu, T.; Wang, C.; Cui, W.; Gong, H.; Liang, C.; Shi, X.; Li,Z.; Sun, B.; Liu, Z. Nanoscale 2014, 6 (19), 11219.doi: 10.1039/C4NR03753G
(100) Song, X.; Zhang, R.; Liang, C.; Chen, Q.; Gong, H.; Liu, Z.Biomaterials 2015, 57, 84.doi: 10.1016/j.biomaterials.2015.04.001
(101) Chen, L.; Zhong, X.; Yi, X.; Huang, M.; Ning, P.; Liu, T.;Ge, C.; Chai, Z.; Liu, Z.; Yang, K. Biomaterials 2015, 66,21. doi: 10.1016/j.biomaterials.2015.06.043
(102) Song, G.; Liang, C.; Gong, H.; Li, M.; Zheng, X.; Cheng,L.; Yang, K.; Jiang, X.; Liu, Z. Adv. Mater. 2015, 27 (40),6110. doi: 10.1002/adma.201503006
(103) Zhou, M.; Chen, Y.; Adachi, M.; Wen, X.; Erwin, B.;Mawlawi, O.; Lai, S. Y.; Li, C. Biomaterials 2015, 57, 41.doi: 10.1016/j.biomaterials.2015.04.013
(104) Xiao, Q.; Zheng, X.; Bu, W.; Ge, W.; Zhang, S.; Chen, F.;Xing, H.; Ren, Q.; Fan, W.; Zhao, K.; et al. J. Am. Chem.Soc. 2013, 135 (35), 13041. doi: 10.1021/ja404985w
(105) Chen, Q.; Liang, C.; Wang, X.; He, J.; Li, Y.; Liu, Z.Biomaterials 2014, 35 (34), 9355.doi: 10.1016/j.biomaterials.2014.07.062
(106) Wang, C.; Xu, L.; Liang, C.; Xiang, J.; Peng, R.; Liu, Z.Adv. Mater. 2014, 26 (48), 8154.doi: 10.1002/adma.201402996
(107) Arruebo, M.; Fernández-Pacheco, R.; Ibarra, M. R.;Santamaría, J. Nano Today 2007, 2 (3), 22.doi: 10.1016/S1748-0132(07)70084-1
(108) Sun, C.; Lee, J. S.; Zhang, M. Adv. Drug Deliver Rev. 2008,60 (11), 1252. doi: 10.1016/j.addr.2008.03.018.
(109) Veiseh, O.; Gunn, J. W.; Zhang, M. Adv. Drug Deliver Rev.2010, 62 (3), 284. doi: 10.1016/j.addr.2009.11.002
(110) Pankhurst, Q. A.; Connolly, J.; Jones, S. K.; Dobson, J.J. Phys. D: Appl. Phys. 2003, 36 (13), R167.
(111) Tartaj, P.; Veintemillas-Verdaguer, S.; Serna, C. J. J. Phys.D: Appl. Phys. 2003, 36 (13), R182.
(112) Tucker, R. D.; Platz, C. E.; Huidobro, C.; Larson, T.Urology 2002, 60 (1), 166.doi: 10.1016/S0090-4295(02)01653-9
(113) Kim, D. H.; Nikles, D. E.; Johnson, D. T.; Brazel, C. S.J. Magn. Magn. Mater. 2008, 320 (19), 2390.doi: 10.1016/j.jmmm.2008.05.023
(114) Freeman, M.; Arrott, A.; Watson, J. J. Appl. Phys. 1960, 31(5), S404. doi: 10.1063/1.1984765
(115) Lee, J. H.; Chen, K. J.; Noh, S. H.; Garcia, M. A.; Wang,H.; Lin, W. Y.; Jeong, H.; Kong, B. J.; Stout, D. B.; Cheon,J.; et al. Angew. Chem. 2013, 125 (16), 4480.doi: 10.1002/ange.201207721
(116) Li, Z.; Yin, S.; Cheng, L.; Yang, K.; Li, Y.; Liu, Z. Adv.Funct. Mater. 2014, 24 (16), 2312.doi: 10.1002/adfm.201303345
(117) Wang, C.; Sun, X.; Cheng, L.; Yin, S.; Yang, G.; Li, Y.; Liu,Z. Adv. Mater. 2014, 26 (28), 4794.doi: 10.1002/adma.201400158
(118) Liu, Z.; Kiessling, F.; Gätjens, J. J. Nanomater. 2010, 2010,51. doi: 10.1155/2010/513501
(119) Frinking, P. J.; Bouakaz, A.; Kirkhorn, J.; Ten Cate, F. J.;De Jong, N. Ultrasound Med. Biol. 2000, 26 (6), 965.doi: 10.1016/S0301-5629(00)00229-5
(120) Cosgrove, D. Eur. J. Radiol. 2006, 60 (3), 324.doi: 10.1016/j.ejrad.2006.06.022
(121) Xing, Z.; Wang, J.; Ke, H.; Zhao, B.; Yue, X.; Dai, Z.; Liu,J. Nanotechnology 2010, 21 (14), 145607.doi: 10.1088/0957-4484/21/14/145607
(122) Smith, M. D.; Elion, J. L.; McClure, R. R.; Kwan, O. L.;Demaria, A. N.; Evans, J.; Fritzsch, T. H. J. Am. Coll.Cardiol. 1989, 13 (7), 1622.doi: 10.1016/0735-1097(89)90357-4
(123) Barnhart, J.; Levene, H.; Villapando, E.; Maniquis, J.;Fernandez, J.; Rice, S.; Jablonski, E.; GjØen, T.;Tolleshaug, H. Invest. Radiol. 1990, 25, S162.
(124) Forsberg, F.; Basude, R.; Liu, J.B.; Alessandro, J.; Shi, W.T.; Rawool, N. M.; Goldberg, B. B.; Wheatley, M. A.Ultrasound Med. Biol. 1999, 25 (8), 1203.doi: 10.1016/S0301-5629(99)00079-4
(125) Wheatley, M. A.; Forsberg, F.; Dube, N.; Patel, M.;Oeffinger, B. E. Ultrasound Med. Biol. 2006, 32 (1), 83.doi: 10.1016/j.ultrasmedbio.2005.08.009
(126) El-Sherif, D. M.; Wheatley, M. A. J. Biomed. Mater. Res.Part A 2003, 66 (2), 347. doi: 10.1002/jbm.a.10586
(127) Leong-Poi, H.; Christiansen, J.; Heppner, P.; Lewis, C. W.;Klibanov, A. L.; Kaul, S.; Lindner, J. R. Circulation 2005,111 (24), 3248.doi: 10.1161/CIRCULATIONAHA.104.481515
(128) Ryan, P. J.; Davis, M. A.; Melchior, D. L. Lipisomes Containing Gas for Ultrasound Detection. Google Patents:1990.
(129) Kort, A.; Kronzon, I. J. Clin. Ultrasound 1982, 10 (3), 117.doi: 10.1002/jcu.1870100306
(130) Klibanov, A. L. Adv. Drug Deliver Rev. 1999, 37 (1), 139.doi: 10.1016/S0169-409X(98)00104-5
(131) Schutt, E. G.; Klein, D. H.; Mattrey, R. M.; Riess, J. G.Angew. Chem. Int. Edit. 2003, 42 (28), 3218.doi: 10.1002/anie.200200550
(132) Unger, E. C.; Lund, P. J.; Shen, D. K.; Fritz, T. A.;Yellowhair, D.; New, T. E. Radiology 1992, 185 (2), 453.doi: 10.1148/radiology.185.2.1410353
(133) Kim, H. J.; Matsuda, H.; Zhou, H.; Honma, I. Adv. Mater.2006, 18 (23), 3083. doi: 10.1002/adma.200600387
(134) Huang, S. L.; MacDonald, R. C. BBA-Biomembranes 2004,1665 (1), 134.
(135) Jing, Y.; Zhu, Y.; Yang, X.; Shen, J.; Li, C. Langmuir 2010,27 (3), 1175. doi: 10.1021/la1042734
(136) Grüll, H.; Langereis, S. J. Control. Release 2012, 161 (2),317. doi: 10.1016/j.jconrel.2012.04.041
(137) Lammers, T.; Koczera, P.; Fokong, S.; Gremse, F.; Ehling,J.; Vogt, M.; Pich, A.; Storm, G.; Van Zandvoort, M.;Kiessling, F. Adv. Funct. Mater. 2015, 25 (1), 36.doi: 10.1002/adfm.201401199
(138) Illing, R.; Kennedy, J.; Wu, F.; Ter Haar, G.; Protheroe, A.;Friend, P.; Gleeson, F.; Cranston, D.; Phillips, R.;Middleton, M. Br. J. Cancer 2005, 93 (8), 890. doi:10.1038/sj.bjc.6602803
(139) Blana, A.; Walter, B.; Rogenhofer, S.; Wieland, W. F.Urology 2004, 63 (2), 297.doi: 10.1016/j.urology.2003.09.020
(140) Rapoport, N.; Gao, Z.; Kennedy, A. J. Natl. Cancer I. 2007,99 (14), 1095. doi: 10.1093/jnci/djm043
(141) Song, X.; Feng, L.; Liang, C.; Yang, K.; Liu, Z. Nano Lett.2016, 16, (10), 6145. doi: 10.1021/acs.nanolett.6b02365.
(142) Böhmer, M.; Chlon, C.; Raju, B.; Chin, C.; Shevchenko, T.;Klibanov, A. J. Control. Release 2010, 148(1), 18.doi: 10.1016/j.jconrel.2010.06.012
(143) Klibanov, A. L.; Shevchenko, T. I.; Raju, B. I.; Seip, R.;Chin, C. T. J. Control. Release 2010, 148 (1), 13.doi: 10.1016/j.jconrel.2010.07.115
(144) Yin, T.; Wang, P.; Li, J.; Zheng, R.; Zheng, B.; Cheng, D.;Li, R.; Lai, J.; Shuai, X. Biomaterials 2013, 34 (18), 4532.doi: 10.1016/j.biomaterials.2013.02.067
(145) Kong, G.; Anyarambhatla, G.; Petros, W. P.; Braun, R. D.;Colvin, O. M.; Needham, D.; Dewhirst, M. W. Cancer Res.2000, 60, (24), 6950.
(146) Needham, D.; Anyarambhatla, G.; Kong, G.; Dewhirst, M.W. Cancer Res. 2000, 60 (5), 1197.
(147) Kim, Y. J.; Ebara, M.; Aoyagi, T. Adv. Funct. Mater. 2013,23 (46), 5753. doi: 10.1002/adfm.201300746.
(148) Yatvin, M. B.; Weinstein, J. N.; Dennis, W. H.; Blumenthal,R. Science 1978, 202 (4374), 1290.doi: 10.1126/science.364652
(149) Ponce, A. M.; Vujaskovic, Z.; Yuan, F.; Needham, D.;Dewhirst, M. W. Int. J. Hyperther 2006, 22 (3), 205.doi: 10.1080/02656730600582956
(150) Al-Ahmady, Z. S.; Al-Jamal, W. T.; Bossche, J. V.; Bui, T.T.; Drake, A. F.; Mason, A. J.; Kostarelos, K. ACS Nano 2012, 6 (10), 9335. doi: 10.1021/nn302148p
(151) Chen, K. J.; Chaung, E. Y.; Wey, S. P.; Lin, K. J.; Cheng, F.;Lin, C. C.; Liu, H. L.; Tseng, H. W.; Liu, C. P.; Wei, M. C.;et al. ACS Nano 2014, 8(5), 5105. doi: 10.1021/nn501162x
(152) Goitein, M.; Jermann, M. Clin. Oncol. 2003, 15 (1), S37.doi: 10.1053/clon.2002.0174
(153) Zhang, X. D.; Wu, D.; Shen, X.; Chen, J.; Sun, Y. M.; Liu,P. X.; Liang, X. J. Biomaterials 2012, 33 (27), 6408.doi: 10.1016/j.biomaterials.2012.05.047
(154) Liu, Y.; Chen, W.; Wang, S.; Joly, A. G. Appl. Phys. Lett.2008, 92 (4), 043901. doi: 10.1063/1.2835701
(155) Mudr, K. F.; Meltem Onder, M. J. Drug. Dermatol. 2014,13 (3), 291.
(156) Rejinold, N. S.; Jayakumar, R.; Kim, Y. C. J. Control.Release 2015, 204, 85. doi: 10.1016/j.jconrel.2015.02.036
(157) Chou, C. Radio Frequency Hyperthermia in Cancer Therapy. In: Biologic Effects of Nonionizing Electromagnetic Fields; CRC Press Inc. 1995; pp. 1424–1428.
(158) Curley, S. A. Ann. Surg. Oncol. 2003, 10 (4), 338. doi:10.1245/ASO.2003.07.017
(159) Glazer, E. S.; Massey, K. L.; Zhu, C.; Curley, S. A. Surgery 2010, 148 (2), 319. doi: 10.1016/j.surg.2010.04.025
(160) Kruse, D. E.; Stephens, D. N.; Lindfors, H. A.; Ingham, E.S.; Paoli, E. E.; Ferrara, K. W. IEEE T. Biomed. Eng. 2011,58 (7), 2002. doi: 10.1109/TBME.2011.2124460
(161) Cardinal, J.; Klune, J. R.; Chory, E.; Jeyabalan, G.;Kanzius, J. S.; Nalesnik, M.; Geller, D. A. Surgery 2008,144 (2), 125. doi: 10.1016/j.surg.2008.03.03
(162) Gannon, C. J.; Cherukuri, P.; Yakobson, B. I.; Cognet, L.;Kanzius, J. S.; Kittrell, C.; Weisman, R. B.; Pasquali, M.;Schmidt, H. K.; Smalley, R. E.; Curley, S. A. Cancer 2007,110 (12), 2654. doi: 10.1002/cncr.23155

