广西黑山羊溶血性曼氏杆菌分离鉴定
黄宇何宏勇李军刘香林梁清甘一波唐第深吴翠兰潘艳*
(1,广西玉林市动物疫病预防控制中心 537000;2,广西兽医研究所 530001;3,广西兽医生物技术重点实验室 530001)
溶血性曼氏杆菌(Mannheimia Haemolytica)为微溶于血、革兰氏阴性球杆菌、曼氏杆菌属的成员。溶血性曼氏杆菌是危害牛羊等反刍动物的病原之一,比其他曼氏杆菌属成员包含肉芽曼氏杆菌、葡萄糖苷酶曼氏杆菌、反刍兽曼氏杆菌、多源曼氏杆菌的致病性强[1]。国内外已有很多研究报道,当牛羊感染该菌时经济损失非常惨重,由于其可引起牛羊肺炎及新生羔羊的败血症。现本试验运用细菌的分离技术、生化鉴定试验和16SrRNA序列分析,从黑山羊的肺脏中分离出1株溶血性曼氏杆菌,并进行药物敏感性试验,旨在为羊病的防控奠定基础。
1 材料与方法
1.1 病料来源
2017年6月,广西某黑山羊养殖户在当地购买一批黑山羊,该羊群曾在田间地头放牧。购买15d后,患病羊开始出现咳嗽、流鼻涕、发热等症状。该养殖户给黑山羊使用氟苯尼考等药物,但不见好转。于是养殖户将该病死羊送广西兽医研究所就诊。该羊体毛粗糙、无光泽,体形偏瘦。剖检时见胸、腹腔有积水,肝、脾、肾均无肉眼可见病变,肺有出血。
1.2 主要试剂
细菌DNA提取试剂盒、2×Taq MasterMix、DH5α等均购自北京康为世纪生物科技有限公司;PCR仪购自北京天根生物科技有限公司;胰蛋白胨大豆肉汤(TSA)购自北京路桥技术有限责任公司;药敏纸片购自杭州滨和微生物试剂有限公司。
1.3 细菌分离
无菌采取黑山羊肺脏在TSA板进行接种,37℃培养24h后挑取单个菌落进行纯培养,再挑取纯化后的菌落进行革兰氏染色、镜检。
1.4 生化鉴定
将纯化的菌落按照常规方法37℃培养在生化鉴定管中,观察细菌的生理生化特性。
1.5 16SrRNA基因扩增
用细菌DNA提取试剂盒提取细菌DNA,其操作步骤按照说明书进行。然后以此DNA为模板、细菌16SrRNA通用型引物[2]进行PCR扩增。其扩增程序为先进行95℃5 min;然后进行30个循环95℃30s、52℃40s、 72℃50min; 最后再进行72℃10min。扩增结束后,取7μl的PCR产物在1.5%的凝胶琼脂糖上进行电泳,观察电泳结果。
1.6 序列分析
将PCR产物进行回收、克隆、测序。所得的测序结果用生物学软件MegAlign和Mega 7进行分析,并分别作出同源性分析图和绘制进化树图。
1.7 gcp基因扩增
以细菌DNA为模板、以gcp基因为目的基因,根据广西兽医研究所建立检测溶血性曼氏杆菌的PCR方法进行特异性扩增。
1.8 动物致病性试验
分别将10只健康的昆明鼠随机分成2组(试验组和对照组),试验组每只小鼠腹腔注射细菌纯培养物0.4ml,另一组每只小鼠注射0.4ml的生理盐水作为对照组,观察小鼠的身体状况,并记录结果。
1.9 药物敏感性试验
取100μl纯培养的细菌均匀涂在TSA板上,然后贴上药敏片,再置于37℃培养24h,观察抑菌效果。
2 试验结果
2.1 细菌分离
细菌在TSA板上生长良好,镜检结果为革兰氏阴性的小杆菌。
2.2 生化鉴定
生化试验结果显示阳性结果的有葡萄糖、氧化酶、甘露醇、山梨醇、木糖和麦芽糖;阴性结果有山梨糖、海藻糖、甘露糖和脲酶。这些结果与陆承平 《兽医微生物学》(第三版)[3]的溶血性曼氏杆菌相符合,初步判断该分离株为溶血性曼氏杆菌。
2.3 16SrRNA基因扩增结果
扩增结果见图1,获得了1500bp条带大小的目的片段,并命名为MS-1706。
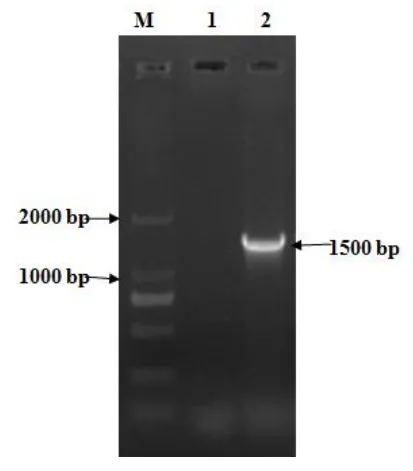
图1 分离株16SrRNA基因扩增电泳图
2.4 16SrRNA测序结果分析
将测序结果与10株溶血性曼氏杆菌参考株进行同源性比较,结果与参考株的同源性为94.5%-100%。在进化树上,分离株MS-1706与参考株NCTC 9380(M75080)、8-3365-5(KLJ051693)等都在同一分支上。说明MS-1706分离株为溶血性曼氏杆菌。
2.5 gcp基因扩增
根据广西兽医研究所建立检测溶血性曼氏杆菌的PCR方法进行检测该细菌,扩增得到与预期大小的片段,如图2。
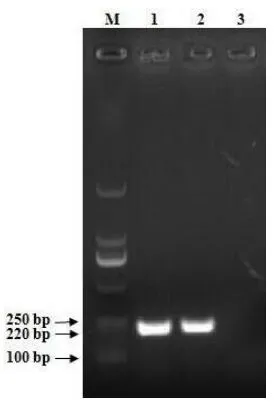
图2 分离株gcp基因扩增电泳图
2.6 致病性试验结果
试验组小鼠在注射后6h开始出现行动缓慢,在24h内已有80%的小鼠出现死亡。对死亡小鼠进行剖解,发现肺有出血点。同时,从小鼠肺中分离到该菌。
2.7 药物敏感性试验结果
本试验共用14种药物做药物敏感性试验,结果分离菌对药物头孢噻肟、强力霉素、恩诺沙星和头孢曲松呈现出高度敏感;对链霉素、庆大霉素、阿莫西林、阿奇霉素和四环素表现为中敏;对复方新诺明、多粘菌素B、卡那霉素、青霉素G和氨苄西林表现为耐药。
3 讨论
溶血性曼氏杆菌大多数是从肺脏中分离的,少部分从鼻拭子中分离。本研究从广西某养殖户病死黑山羊的肺脏中分离出一株菌。通过传统的方法包含细菌的形态特征鉴定技术、生理生化特性初步鉴定该菌为溶血性曼氏杆菌。再结合新型技术PCR的方法对16SrRNA基因进行扩增和序列分析以及应用广西兽医研究所建立的溶血性曼氏杆菌的诊断方法进行检测,进一步确定该菌(MS-1706)即是溶血性曼氏杆菌。冯旭飞等[4]研究报道表明,传统方法不仅费时费力,且该菌的分离率较低,较难分离得到该菌。Shangthalingam等[5]报道在2009~2010年间对溶血性曼氏杆菌进行病原学分离和PCR检测,结果病原的分离率仅为3%,而PCR检测率占77%。因此,在做病原学诊断时,应注意传统方法和新型方法的结合。
16SrRNA即16Sribosomal RNA,是原核核糖体30S小亚基的组成部分。16SrRNA基因是细菌上编码rRNA相对应的DNA序列,存在与所有细菌的基因组中。该基因具有高度保守性和特异性,该基因检测技术已成为检测和鉴定病原菌有效手段。基于16SrRNA基因序列核苷酸同源性分析显示,分离株MS-1706与10株溶血性曼氏杆菌参考株的核苷酸同源性为94.5~100%,显示较高的同源性。为更进一步了解分离株MS-1706的分子特征,本研究对其16SrRNA基因绘制核苷酸进化树,进化树分析显示,分离株与溶血性曼氏杆菌参考株出在同一分支,且与溶血性曼氏杆菌参考株NCTC 9380(M75080)、8-3365-5(KLJ051693)的亲缘关系较近。原名为溶血性曼氏杆菌的细菌是一个复杂的类群,按生化特性可分为A生物型和T生物型,现将A生物型划分为溶血性曼氏杆菌。据Lee[6]报道,A生物型含有gcp基因,而T生物型没有此基因,通过运用广西兽医研究所以gcp为靶基因建立的PCR诊断方法扩增到相应的目的片段。由上述可知,该分离株为溶血性曼氏杆菌。
本研究通过致病性试验表明该菌具有很强的致病性。溶血性曼氏杆菌具有多种毒力因子,包含白细胞介素、脂多糖、脂多糖、白细胞介素等,而该菌是怎样引起患畜致病的机理还有待于进一步的研究。溶血性曼氏杆菌病的发生已呈全球分布,引起人们广泛关注。马增军等[7]在河北从病死绵羊的肺脏、心血等脏器分离出5株溶血性曼氏杆菌;李璞君等[8]从四川死亡山羊的肺组织中分离到1株该菌;王羽等[9]运用形态学鉴定、生化试验和PCR等方法从江苏羊肺中分出1株该菌;李雪霞等[10]从云南奴比山羊羊肺中分离出1株溶血性曼氏杆菌。因此,对于该病的治疗原则是尽早发现,及时治疗,否则该病易与其他病原菌如多杀巴氏杆菌、化脓性隐秘杆菌、绵羊肺炎支原体等混合感染而加大治疗难度。
对于溶血性曼氏杆菌病,应用传统的药物治疗是预防和治疗该病最主要的手段。Lubbers[11]、Katsuda[12]等研究表明,该菌已经对氨基糖苷类、四环素类、磺胺类等药物已产生一定程度的耐药。本次研究表明,分离菌MS-1706对药物头孢噻肟、强力霉素、恩诺沙星和头孢曲松这4种呈现出高度敏感;对链霉素等5种药物表现为中敏;对复方新诺明等5种药物表现为耐药,说明该菌对药物出现多重耐药。关于该菌产生的耐药机制研究的较少,还有待于更进一步的研究。综上所述,临床上如何选择有效用药是治疗本病的关键。本研究为羊溶血性曼氏杆菌病的治疗提供理论基础。
[1]陈艳红,颜忠,查振林,等.溶血性曼氏杆菌致病机制的研究进展[J].中国畜牧兽医,2010,37(12):153-155.
[2]王羽,董文龙,汪艳,等.绵羊溶血性曼氏杆菌的分离鉴定[J].中国兽医科学,2016,46(7):870-873.
[3]陆承平.兽医微生物学(第三版)[M].北京:中国农业出版社,2001:252-253.
[4]冯旭飞,刀筱芳,王志敏,等.绵羊肺脏中溶血性曼氏杆菌的分离鉴定及其药物面感谢分析[J].中国畜牧兽医,2014,41(8):224-228.
[5]Shanthalingam S,Goldy A,Bavanan thasivam J,et al.PCR assay detectsMannheim ia haemolytica in culture-negative pneumonic lung tissuesof bigborn sheep(Ovis canadensis)from outbreaks in the western USA,2009-2010[J].JW ildl Dis,2014,50(1):1-10.
[6]Lee C W,Lo R E,Shewen P E,et al.The detection of the sialoglycoprotease gene and assay for sialoglycoprotease activity among isolates of Pasteurella haemolytica A1 strains,serotypes A13,A14,T15 and A16[J].FEMSM icrobiol Lett,1994,121(2):199-205.
[7]马增军,颛锡良,苪萍,等.羊溶血性曼氏杆菌主要生物学形态测定[J].黑龙江畜牧兽医,2005(7):39-40.
[8]李璞君,吴禹熹,王娟,等.一例绵羊肺炎支原体和溶血性曼氏杆菌混合感染山羊的诊断[J].畜牧与兽医,2016,48(5):126-128.
[9]王羽,董文龙,汪艳,等.绵羊溶血性曼氏杆菌分离鉴定[J].中国兽医科学,2016,46(7):870-873.
[10]李雪霞,李富华,赵文祥,等.云南羊溶血性曼氏杆菌的分离鉴定及药敏试验[J].上海畜牧兽医通讯,2014(1):36-38.
[11]Lubber B W,Hanzlicek G A.Antim icrobialmultidrug resistance and coresistance patternsof Mannheim ia haemolytica isolated from bovine respiratory disease cases——A three-year(2009-2011)retrospective analysis[J].JVet Diagn Invest,2013,25(3):413-417.
[12]Katsuda K,Kohmoto M,M ikam i O.Relationship between serotype and antim icrobial susceptibility of Mannheim ia haemolytica isolates collected between 1991 and 2010[J].Res Vet Sci,2013,94(2):205-208.

