炎性肌纤维母细胞瘤的影像及病理对照分析
陈亚男, 杨智明, 王甜, 焦玉新, 滑炎卿
炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor,IMT)是一种生物学谱系广泛、慢性炎症细胞为背景的、以梭形细胞增生为主的间叶源性肿瘤。IMT可发生在任何年龄人群的任何部位,易被误诊和漏诊。研究[1-2]指出该病影像表现具有特征性,但是否与其病理分型、预后相关,尚不明确。回顾性分析16例IMT患者的影像特点及病理表现,旨在提高对该病的诊断水平。
材料与方法
1.研究对象
搜集2010年5月-2016年9月本院收治的经手术病理证实的16例IMT患者,男15例,女1例,年龄42~78岁,中位年龄62岁。临床表现为咳嗽、气促者7例,腹部不适伴腹部包块者5例,发热伴呕吐者1例,无明显症状者3例。
2.检查方法
所有患者均采用GE Discovery CT 750HD扫描仪行常规胸部或全腹部平扫加增强。胸部扫描范围从肺尖到肺底,全腹部扫描范围从膈顶至盆底。采用管电压120 kV及自动管电流技术,显示层厚5 mm,重建层厚1 mm。增强扫描经肘前静脉以3.0 mL/s流率一次性高压注射非离子型对比剂(370 mg I/mL),剂量1.5 mg/kg体重。增强扫描时间:胸部为开始注射对比剂后60 s;全腹部动脉期、静脉期及延迟期分别为开始注射对比剂后30 s、60 s及180 s。
5例患者采用Siemens Verio 3.0T超导型MRI扫描仪行上腹部T1WI及T2WI的横轴面、冠状面、矢状面及脂肪抑脂平扫,并经肘前静脉一次性注射Gd-DTPA(剂量0.1 mmol/kg体重)后,行T1WI vibe薄层增强扫描。
全部数据传至PACS系统后,由2名高年资放射科医师独立阅片并取得一致意见。记录肿瘤发生部位、大小、形态、密度、强化特点、与周围结构关系等。图像上病灶CT强化数值较平扫增加10~20 HU、21~40 HU、41 HU以上分别称轻度、中度及明显强化。而病灶MRI信号强化幅度以与同层面肌肉信号相同为轻度强化,与同层面主动脉血管信号相同为明显强化,介于两者之间为中度强化。
术中观察肿瘤的形态学特征、毗邻结构关系以及供血动脉等。组织切片行HE染色,镜下观察。病理图片由同一位病理科医师阅片。
结 果
16例IMT中,7例位于胸部,9例位于腹部,其中4例发生于腹腔实质脏器。肿瘤直径1.9~15.8 cm,平均最大长径(5.38±8.71) cm。肿瘤形态各异,边界多清晰。肺内1例见远端阻塞性肺不张、实变及少许炎症。腹腔肿瘤体积偏大,推移周围脏器,其旁脂肪间隙有絮状炎性渗出,邻近的肠壁亦有增厚、水肿改变。肠系膜区2例伴多发卫星灶、散在稍大淋巴结(图1~3)。
CT图像上胸部IMT以实性密度为主,腹盆腔IMT则表现为比例不同囊实性混杂密度,囊实性成分占比与肿瘤大小无关。5例(肺部2例、胃1例、肝脏1例、肠系膜1例)病灶内见点、细条或团块状钙化。所有病灶均未见出血及脂肪密度。腹盆腔肿瘤MRI整体上信号不均匀,实性部分T1WI呈低信号或稍低信号,T2WI呈等、稍高及高信号。3例病灶中心可见小范围更长T1、长T2信号的液性坏死区(图4)。
增强扫描后肺部肿瘤CT值可由35 HU增至70 HU。腹盆腔肿瘤动脉期瘤体表面呈花环样强化,内部囊实区不强化或轻度片絮状、团块样强化;静脉期强化范围、程度明显扩大、提高,接近同层同期主动脉腔内密度,另有2例见偏心性分隔样改变;延迟期强化范围及程度未减退。胃窦及胆囊壁IMT在动脉期即呈现出明显不均匀强化。所有MR图像上亦表现为不均性、渐进性、持续强化的特点(图1b~c、图2b~c、图3b)。
大体观:肿物均与周围结构粘连,形态不规则,切面呈灰白或灰黄色囊实性,局部区域呈结节状胶冻粘液样,偶见坏死组织,未见出血区,肿块整体质嫩。
镜检:肥胖的肌成纤维母细胞片状、成团结节状或束带编织状散在分布。在间质粘液样水肿或胶原基质化区域背景下,梭形瘤细胞均未见明显核分裂象及异型性,大量炎细胞与其交错分布,如:浆细胞、嗜酸性粒细胞、淋巴细胞等。另有2例镜下可见丰富的新生薄壁毛细血管。部分肿瘤局部区域出现砂砾样或粗大钙化(图1e、图2d、图3c、图4g)。
免疫组化检查:所有肿瘤Ki-67均阳性表达,但细胞比例低于10%;ALK及平滑肌机动蛋白(SMA)染色阳性率分别为87.5%、93.8%;波形蛋白(Vimentin)、Desmin、Calponin、S-100部分阳性;Dog-1、CD34、CK、CD117均阴性表达。
讨 论
IMT临床症状、体征不典型且多表现为良性生物学行为,常被误认为是与局部慢性炎症相关的非特异性瘤样病变。2013年WHO将IMC明确定义为间叶组织来源的真性肿瘤。文献报道该病与EB病毒/细菌等微生物感染、机体损伤后局部修复异常、激素治疗或放化疗等有关[3-4]。IMT常为单发病变,少数位于腹腔者可呈多灶性生长。由于IMT属中间型肿瘤,临床需审慎甄别具有侵袭性的病变以便及时治疗。
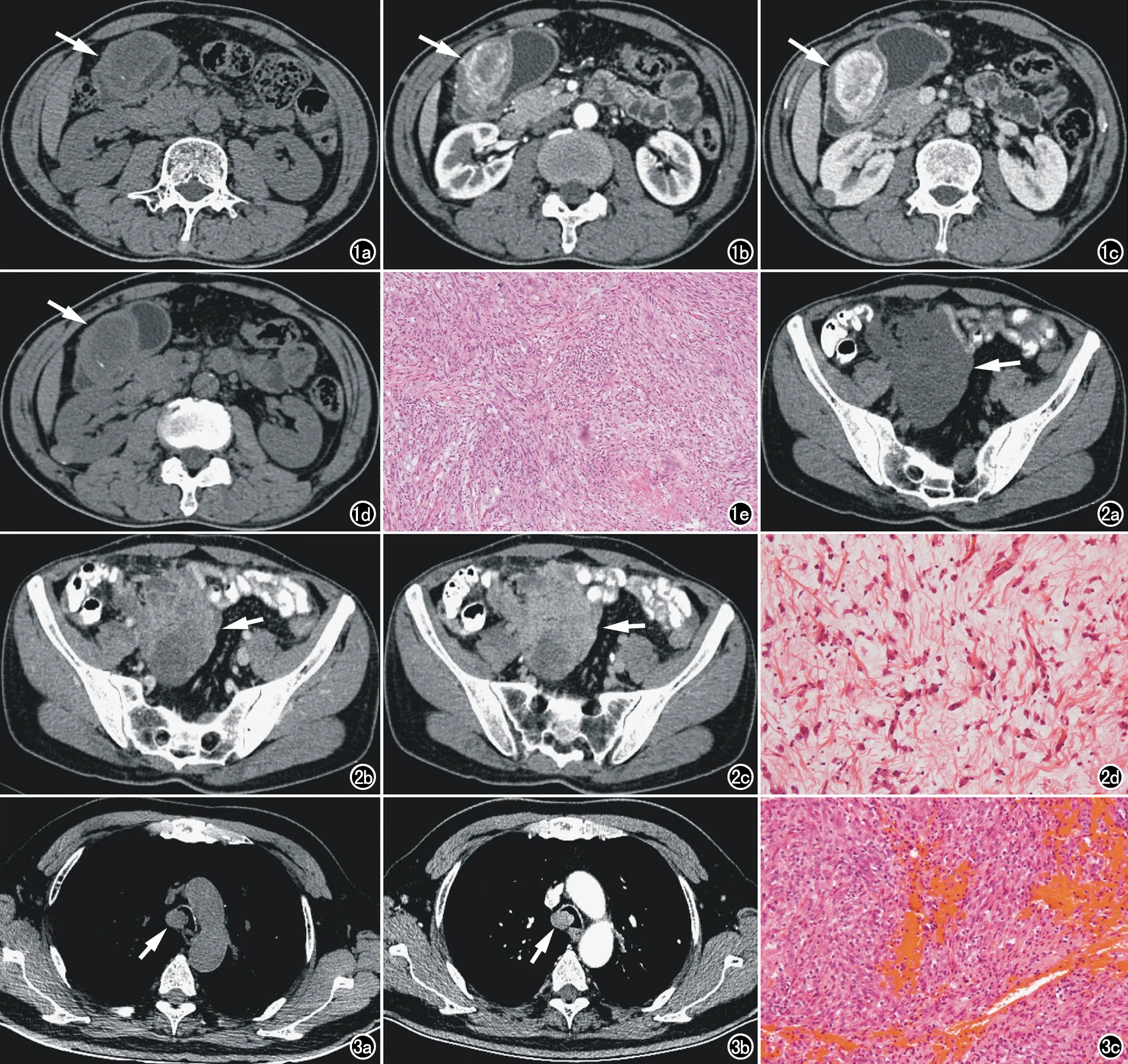
图1 男,55岁,因“黑便3天”入院检查。a) 上腹部横轴面CT平扫示胃窦部一大小约56mm×46mm软组织肿块(箭),边界不清,密度不均,中心可见低密度灶,另见小条状钙化灶; b) 横轴面CT增强动脉期示病灶边缘明显花环状强化(箭); c) 横轴面CT增强静脉期示对比剂持续填充,呈渐进性不均匀强化(箭); d) 未经治疗,第二年横轴面CT平扫示病灶的大小、密度、形态均较前无明显变化(箭); e) Ⅱ型梭形细胞密集型(×200,HE)。 图2 男,43岁,因“右下腹包块进行性增大”入院。a) 下腹部横轴面CT平扫示右下腹一大小约112mm×80mm软组织肿块(箭),形态不规则,边界不清晰,周围脂肪间隙内少量粟粒性结节和微结节灶,病灶与邻近肠管分界不清,周围肠管增厚、粘连; b) 横轴面CT动脉期示病灶呈片絮状轻度强化(箭); c) 横轴面CT静脉期示病灶持续不均匀明显强化(箭),周围结节灶强化方式与主病灶同步; d) Ⅰ型粘液/血管密集型(×200,HE)。 图3 男,77岁,因“咳嗽、胸闷”入院。a) 胸部横轴面CT平扫示气管主动脉弓层面偏右侧一大小约19mm×15mm实性结节,与气管壁广基底相连; b) 横轴面CT增强示病灶明显均匀强化(箭); c) Ⅱ型梭形细胞密集型(×200,HE)。
1.临床表现及发病机制

T1WI示病灶呈较均匀低信号(箭); c) 横轴面T2WI抑脂相病灶信号更高(箭); d) 横轴面T1WI增强扫描静脉期示病灶明显强化(箭),其内少量低信号分隔; e) DWI示病灶呈高信号(箭); f) ADC图示病灶呈低信号(箭),扩散相受限; g) Ⅱ型梭形细胞密集型(×200,HE)。
图4 a) 男,77岁,因B超体检示“肝实质性占位灶”入院。a) 上腹部横轴面T2WI示近肝门区一类圆形稍高信号灶(箭),大小约45mm×37mm×33mm; b) 横轴面
患者多因体检或肿瘤引发的占位效应而首次就诊,血清实验检查缺乏特异性。性别及病变部位宽泛且各异,总体以肺部发病更常见,本研究入组病例男女比例约7:1,肺部病变约占43.8%,与文献[3]报道接近。Antonescu等[3]指出国外IMT患病人群以儿童及青少年多见,而本研究中患者平均年龄(62.31±12.43)岁,表明IMT患病率在国内中老年人群中高发,笔者推测这或与不同种族人群的ALK基因突变率相关。Liang等[2]研究表明国外IMT患者儿童组ALK突变率明显高于成年组,而国内则以成年组ALK突变率更高。且多家学者研究结果表明ALK是多种肿瘤的强致癌驱动因子,IMT患者体内ALK表达为阳性者常具备更高的侵袭性,易局部复发与转移[3,5]。但本研究中ALK是否呈阳性表达,在不同病理亚型的患者体内以及影像形态学方面没有差异,可能与入组研究样本量偏少有关。
IMT存在年龄分布差异,还与其发病机制不同有关。本研究组内病例年龄偏大,局部组织存在长期慢性炎症或者病变部位曾有手术史,机体在炎性反应或创伤修复过程中诱导激活了肌纤维母细胞的潜在增殖,进展成肿瘤。文献[6]指出IMT继发于其他恶性肿瘤放化疗后,存在HV-8DNA、IL-6和CyclinD1过表达,提示机体内的一种过度反应性增生状态。另有观点[7]提出IMT是IgG4相关性疾病的组成之一,表现为大量IgG4阳性的浆细胞浸润,属免疫系统异常,更常见于年轻患者人群,对激素治疗敏感。
2.病理特点
IMT分为三种亚型[8]:Ⅰ型粘液/血管密集型,成束状分布的梭形肌纤维母细胞置于大量不成熟新生血管及粘液变性的间质组织中,伴有不等量炎性细胞;Ⅱ型梭形细胞丰富型,视野内以紧密成团的梭形细胞为主,散在少量炎性细胞;Ⅲ型少细胞纤维型,好发于四肢软组织内,呈大片板形胶原纤维夹杂少许瘤细胞改变,局部可存在钙化或骨化。本组病例14例为Ⅱ型,2例为Ⅰ型,仅1例肺部Ⅱ型患者术后出现转移。
IMT的侵袭转移能力及复发率与瘤内梭形细胞核分裂相及异型性密切相关,与瘤细胞数目比例(即病理亚型)无关[9-10]。分裂异型的瘤细胞越少,则临床更多表现为良性生物学行为。若瘤内梭形细胞核异型性多,易误诊为肉瘤或恶性纤维组织细胞瘤等;若瘤内炎性细胞数目异常增多,则易与淋巴瘤混淆。本研究中一例细针穿刺病理怀疑为肝IMT患者,在完整切除病灶后确诊为淋巴瘤。所以细针穿刺活检的病理结果存在一定假阳性。
本组病例免疫组化提示以SMA及Vimentin的阳性表达为主,有文献[11]指出SMA特异性高于Vimentin。研究[5]表明多数IMT涉及2p23染色体上ALK基因突变,在儿童组中发生概率高达50%~70%,总体阳性率约30%。本研究数据显示成年人的ALK阳性率约87.5%,这为IMT患者可接受分子靶向治疗提供了一定证据。另免疫组化提示所有肿瘤Ki-67均低比例阳性表达,表明患者体内少量瘤细胞具备潜在增殖能力,术后的长期随访监测是有必要的。
3.影像学表现
本研究发现,腹盆腔肿瘤边缘局部脂肪间隙密度增高,邻近腹膜及肠壁有增厚、粘连;胸膜下者表现为幕状或刀切状与胸膜相贴;术中证实IMT与周围组织结构紧密难分离。该表现和IMT瘤内的炎性渗出、浸润密切相关,可作为IMT的特征性征象之一,与边界清楚的良性肿瘤或周围型肺癌的胸膜凹陷征相鉴别。
CT图像上IMT瘤内的囊性水样低密度灶多呈不均匀延迟强化,实质上为病灶的粘液胶原化组织成分。Venkataraman等[12]认为这是由于对比剂通过IMT瘤体内不成熟的新生肿瘤血管渗入间质,被血管外的大量纤维间隔阻挡、蓄积,从而使病灶整体呈延迟强化持续上升型。IMT多为惰性生长肿瘤,发生营养不良性坏死的机率更低。本研究中随访超过2年的患者(肺部1例,胃1例)的瘤灶未见任何形态及密度上的变化,故影像上始终无强化的液化坏死低密度区少见。延迟强化模式及低坏死率的特征可与以大片坏死囊变为主、进展迅速的恶性肿瘤相鉴别。
瘤内各组织学成分的多少影响着MRI信号强度的表达。本组研究的IMT病灶在T1WI上为不均匀低信号,在T2WI上则为等、稍高及高信号(分别为1例、3例、1例),瘤内间质水肿及粘液胶原变性所占比例越多信号越高,梭形细胞所占比例越多信号越低。Motosugi等[13]也指出约为13%~25%的IMT可因瘤内的胶原粘液或坏死液化而在T2WI上表达高亮信号。本组2例I型患者的T2WI信号总体上高于其他Ⅱ型患者,可能与肿瘤内部存在更多新生血管有关。研究中1例肝IMT因扩散受限,而在术前被误诊为肝或十二指肠来源的恶性肿瘤。结合术后病理切片,笔者认为IMT的扩散受限,可能与自由水分子在胶原纤维及粘液化间质组织中的布朗运动受限有关。
钱海珍等[14]指出IMT多见血管穿行或漂浮征,表现为增强扫描时瘤灶内可见少量明显强化的迂曲血管样影。本组病例动脉期瘤表呈花环样强化6例(约66.7%),血管漂浮征1例(约11.1%)。术中观察该7例病灶,均由邻近动脉分支供血,如肝固有动脉、胃十二指肠、髂内动脉等。供血宿主动脉多包绕在瘤体表面,极少数被瘤体包埋、截断,亦未见淋巴结转移及静脉内瘤栓。结合镜下病理发现,该征象是瘤内束带状分布的新生肿瘤血管与壁周的大量炎性细胞协同潴留对比剂所致,而非肿瘤细胞包埋浸润了原宿主血管引起的改变。可与动脉期即明显强化的血管源性或神经源性肿瘤相鉴别,但非特征性征象。此外,本研究数据显示胸部IMT多明显均匀强化,约57.1%(4/7例),考虑主要是由于增强扫描时仅行肺静脉期数据采集。胃窦及胆囊壁2例患者动脉期呈现出明显不均匀强化,可能与瘤灶所在部位的宿主血供更丰富有关。
4.治疗与预后
IMT人群约5%出现转移,25%出现复发[3]。本研究中1例肺内IMT患者采取保守治疗,2年后进展成恶性肌纤维母细胞瘤,后死于呼吸衰竭。其余病例均经手术切除,术后随访至今均未出现复发及转移征象。IMT的复发转移可能与病灶无法被完全切除、累及浸润相邻重要器官、瘤细胞表达TP53等有关[2,5]。尽管有学者[9]指出经抗炎或激素治疗可使病灶缩小甚至消失,手术切除仍为临床首选最佳干预手段,术后一般无需再行放化疗巩固治疗。
IMT在临床上少见但具有潜在恶性,细针穿刺病理活检易误漏诊。但CT能精准显示病灶的血供及解剖结构特征;MRI有助于评价病灶组成成分及预判病理分型。二者结合有利于提高良恶性倾向诊断的符合率,使IMT患者术前评估、治疗及随访方案的制定更加合理化。
[1] Chen M,Zhang L,Cao G,et al.Partial response to chemotherapy in a patient with retroperitoneal inflammatory myofibroblastic tumor[J].Mol Clin Oncol,2016,5(4):463-466.
[2] Liang W,Zhou X,Xu S,et al.CT manifestations of inflammatory myofibroblastic tumors (inflammatory pseudotumors) of the urinary system[J].AJR,2016,206(6):1149-1155.
[3] Antonescu CR,Suurmeijer AJ,Hang L,et al.Molecular characterization of inflammatory myofibroblastic tumors with frequent ALK and ROS1 gene fusions and rare novel RET rearrangement[J].Am J Surg Pathol,2015,39(7):957-967.
[4] 唐威,周纯武.肝脏炎性肌纤维母细胞瘤的影像学诊断[J].放射学实践,2009,24(2):217-220.
[5] 魏婵娟,赵强.ALK与儿童恶性肿瘤关系的研究进展[J].中国肿瘤临床,2015,23(4):251-254.
[6] Al SG,Wimmer JL,Ayala AG,et al.An isolated inflammatory myofibroblastic tumor of adrenal gland[J].Ann Diagn Pathol,2016,25(1):33-36.
[7] Saab S,Hornick J,Fletcher C,et al.IgG4 plasma cells in inflammatory myofibroblastic tumor: inflammatory marker or pathogenic link?[J].Mod Pathol,2011,24(2):606-612.
[8] 钱民,柏瑞,李小荣,等.腹部炎性肌纤维母细胞瘤CT表现[J].放射学实践,2012,27(11):1238-1241.
[9] 骆佳,李德永.儿童腹部炎性肌纤维母细胞瘤22例CT表现及病理对照[J].中国医疗设备,2015,12(7):57-59.
[10] 柴亚如,高剑波,梁盼.黏液血管型炎性肌纤维母细胞瘤的CT表现[J].郑州大学学报(医学版),2015,38(4):582-585.
[11] 包婕,李强,胡粟,等.炎性肌纤维母细胞瘤影像学诊断与病理对照研究[J].临床放射学杂志,2016,35(11):1734-1737.
[12] Venkataraman S,Semelka R,Braga L,et al.Inflammatory myofibroblastic tumor of the hepatobiliary system:report of MR imaging appearance in four patients[J].Radiology,2003,227(3):758-763.
[13] Motosugi U,Ichikawa T,Onohara K,et al.Distinguishing hepatic metastasis from hemangioma using gadoxetic acid-enhanced magnetic resonance imaging[J].Invest Radiol,2011,46(6):359-365.
[14] 钱海珍,林光武,嵇鸣,等.肝脏孤立性乏血供结节的磁共振成像表现及鉴别诊断[J].中华肿瘤杂志,2015,37(6):445-450.

