美国红枫系列品种保护酶系统活性变化及其与耐寒性的关系
于思桦, 陆秀君, 曹 婷, 李 玲
(1.沈阳农业大学林学院,辽宁沈阳 110161; 2.兴城市中等职业技术专业学校,辽宁兴城 125100)
美国红枫(AcerrubrumL.)是北美地区红枫的统称。美国红枫是槭树科槭属落叶大乔木,因其秋季色彩夺目,树冠整洁,被广泛应用于公园、小区、街道栽植,是近几年来引进的优良城市园林的理想珍稀树种之一。近年来,国内许多地区开始引种栽培美国红枫,美国红枫有许多改良的园艺品种,改良美国红枫是从众多品种中选育的40余个非常优秀的园艺栽培品种的统称。美国红枫和改良美国红枫春夏季叶色为绿色,秋季变为火红色,是优良的彩叶树种[1]。
近年来,有关美国红枫系列品种的抗性及适应性研究已有一些报道。刘毓在国外优良彩叶槭树资源引种及适应性研究中对改良美国红枫(Acerr.×freemanii‘Autumn Blaze’)进行了生物学特性观察和耐寒性观测,认为所引种彩叶槭树品种在引种地济南市存在长期生存的可能性[2]。王菲等报道了沈阳地区栽种的红花槭(Acerrubrum)在低温胁迫下几种生理指标的变化,初步得出红花槭可以抵御-35 ℃的低温,可以在沈阳地区露地越冬[3]。刘广林等报道了沈阳地区引种的红花槭、自由人槭(Acerr.×freemanii‘Autumn Blaze’)的半致死温度以及自然越冬过程中含水量等生理指标的变化,结果表明,在自然越冬过程中,束缚水/自由水值,以及可溶性糖、可溶性蛋白、丙二醛含量随着温度的降低均呈现先增加后降低的趋势[4]。目前,关于美国红枫系列品种在低温逆境下细胞内保护酶活性的变化并没有系统的研究报道,但已经有大量研究表明,植物的保护酶系统影响了植物的抗寒性。植物组织因为受到寒害而产生大量活性氧,会破坏细胞的正常功能以致影响植物的生长和发育[5]。植物体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是重要的防御保护酶,能够清除组织内多余的自由基,使活性氧保持动态稳定的水平,从而保护其细胞本身不受危害[6-9]。因此,当植物受到胁迫时,可以通过SOD、POD、CAT三者共同作用来清除机体内累积的自由基[10-11]。低温胁迫在引起植物体内抗氧化酶活性变化的同时,还能诱导抗氧化酶同工酶活性的增加。殷有等对白皮松幼苗抗寒性的研究表明,其机体内SOD、POD和CAT的活性随温度降低明显提高,说明3种酶的活性是影响白皮松幼苗抗寒性强弱的关键因素[12]。对金边卫矛(Euonymusradicans‘Emorald & Gold’)[13]、加拿大糖槭(AcernegundoLinn)[14]、杨树(PopulusL.)[15]等植物的SOD、POD以及相应同工酶活性的测定结果也表明,植物的抗寒性与保护酶系统的活性有显著相关性。
本研究拟通过对引进的美国红枫系列品种苗木在辽宁沈阳地区自然越冬过程中各项保护酶活性和同工酶活性变化的研究,明确各树种的抗寒能力和低温适应机制,为沈阳地区引种与栽培美国红枫等系列树种及通过保护酶活性评价其抗寒性提供理论依据。
1 试验地概况
试验地位于辽宁省沈阳市东陵区高坎镇兴隆村,该地区与抚顺市接壤,属于半湿润季风气候,冬寒时间较长,近6个月,降雪较少;夏季时间较短,多雨;春季多风;秋季晴朗。该地日照充足,四季分明。年平均气温6.2~9.7 ℃,极端最高气温38.3 ℃,极端最低气温-32.9 ℃。受季风影响,降水集中在夏季,全年降水量600~800 mm,集中于6—8月,占全年的62.5%,年平均相对湿度61%,年日照时数约2 516 h,全年无霜期155~180 d。于2012年11月1日至2013年3月16日对试验地实测最高和最低温度进行了记录,详见表1。
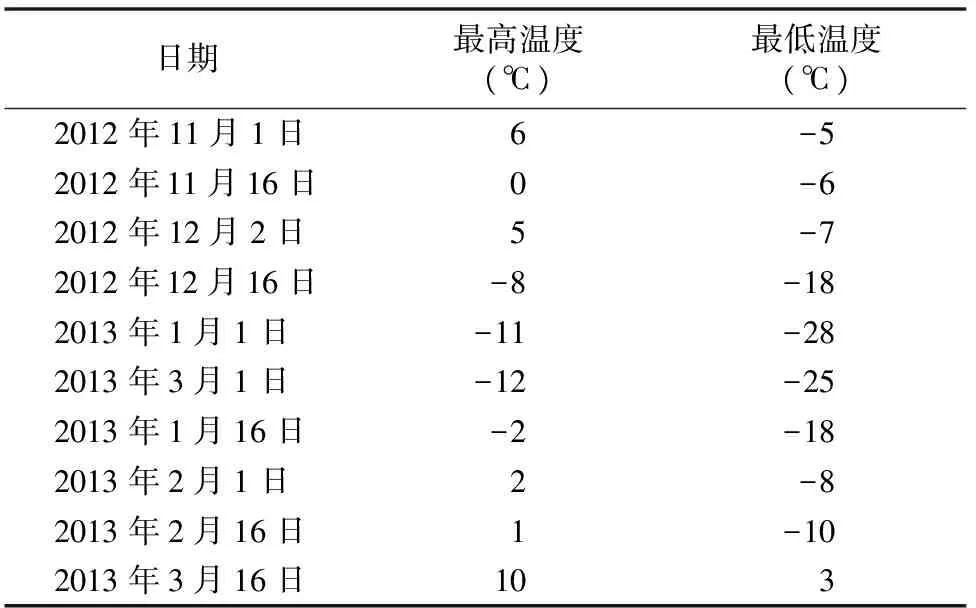
表1 2012年冬季至2013年春季期间采样地温度变化
2 材料与方法
2.1 材料与处理
本试验所用红花槭为从山东青岛引进的实生苗;改良美国红枫为从山东青岛引进的1年生扦插苗;五角枫(Acerelegantulum)为当地播种的繁殖苗。从2012年11月初至2013年3月中旬,每隔15 d分别对红花槭4年生苗、红花槭3年生苗、改良美国红枫1年生苗、五角枫3年生苗的1年生休眠枝进行采样。将材料洗净擦干后,直接放于-20 ℃冰箱中恒温保存,用于测定超氧化物歧化酶、过氧化物酶、过氧化氢酶及其同工酶活性几项生理指标。测量时剪成15 cm长的枝段,每组测量选取9段枝条,3次重复。
2.2 测定方法
2.2.1 SOD、POD、CAT活性的测定 SOD活性测定采用氮蓝四唑还原法,POD活性测定采用愈创木酚法[16],CAT活性测定采用紫外吸收分光光度法。
2.2.2 SOD、POD、CAT同工酶活性的分析 (1)酶液提取。称取0.5 g冷冻样品枝条,在冰浴条件下加2 mL酶提取液(0.1 mol/L、pH值7.5的Tris-HCl缓冲液),研磨至匀浆,加入离心管内,然后在低温冷冻离心机中于4 ℃、12 000 r/min离心20 min,吸取1 mL上清液,加入1 mL 10%甘油,1 mL 40%蔗糖,即为待测酶提取液。
(2)制胶。测定SOD同工酶分离胶浓度为10%,浓缩胶浓度为4%。先配制分离胶,后配制浓缩胶,在即将灌胶前再分别加入过硫酸铵(AP)、四甲基乙二胺(TEMED)试剂,在分离胶中加入150 μL AP、32 μL TEMED,在浓缩胶中加入50 μL AP、15 μL TEMED。
(3)灌胶、加样。混匀后立即沿玻璃板边缘用移液器将分离胶缓缓注入胶室中,注胶过程中要防止气泡产生,胶液加到距玻璃板边缘1 cm处为止,立即用移液器在胶溶液上加满无水乙醇,静置5 min,待分离胶上出现清晰的界面时,将上层无水乙醇倒掉,用移液器加入配制好的浓缩胶,加满浓缩胶后立即插入10孔样品梳,注意不要带入气泡。静置10 min后,轻轻拔出梳子,将2 μL溴酚蓝点在消毒一次性手套上,吸取 20 μL 样品液,混入溴酚蓝中,将吸取的20 μL混合液加入槽点中,应保证每个槽点的上样量相同。
(4)电泳。采用垂直平板聚丙烯酰胺凝胶电泳法[17]。
(5)染色。SOD同工酶的染色采用四氮唑蓝(NBT)法;POD同工酶的染色采用醋酸-联苯胺法;CAT同工酶的染色采用铁染色法[18]。
2.3 图像扫描与数据分析
用UMAX Powerlook 2100XL扫描仪对SOD、POD、CAT的同工酶凝胶进行扫描并保存图像。用Adobe Photoshop CS4软件对图像进行处理。
3 结果与分析
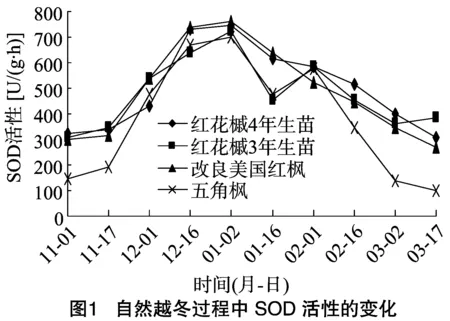
3.1 SOD活性的变化
由图1可以看出,在自然越冬过程中,红花槭4年生苗、红花槭3年生苗、改良美国红枫SOD活性均呈先上升后下降的趋势。其中在11月份刚进入冬季时,温度下降幅度较小,3种红枫SOD活性基本维持在较低的水平。但到12月上旬外界温度下降较快时,几种红枫SOD活性急剧上升,红花槭4年生苗、红花槭3年生苗和改良美国红枫SOD活性分别在12月16日、12月1日和1月2日时达到峰值,分别比11月1日最初测定时的活性提高了2.34、2.33、2.56倍。结果表明,在整个越冬季节,几种树种的SOD活性会随着低温胁迫的加强逐渐增大,其中五角枫的升幅表现最大,改良美国红枫以及红花槭4年、3年生苗的升幅依次递减。
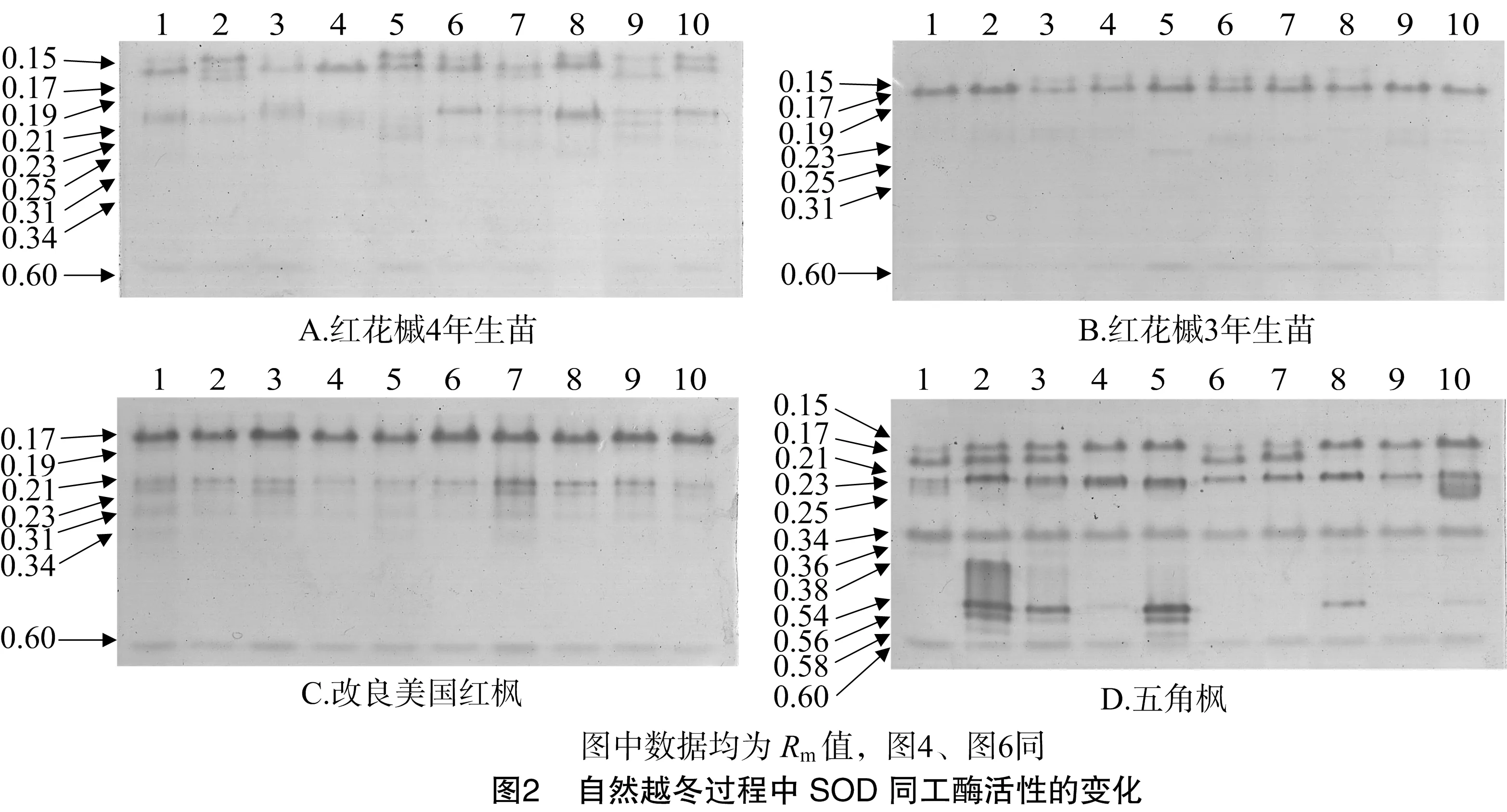
3.2 SOD同工酶活性的变化
从图2可以看出,迁移率为0.17、0.23、0.34的SOD同工酶条带几乎为几种树种所共有。红花槭4年生苗和3年生苗条带表现接近,但是红花槭3年生苗相比4年生苗缺少了迁移率为0.21、0.34的条带,3年生苗Rm=0.17、0.23、0.25的条带在整个取样过程中均表现为弱于4年生苗。改良美国红枫比红花槭少了Rm=0.15、0.25的2个条带,但其他条带表现比较强。五角枫在4种树种中的SOD同工酶条带数最多。结果表明,各树种的SOD同工酶会在温度降低时表现出相应增强的趋势,且抗寒性越强的树种同工酶条带的数量越多,每个种树在不同时期其SOD同工酶的强弱也不相同。
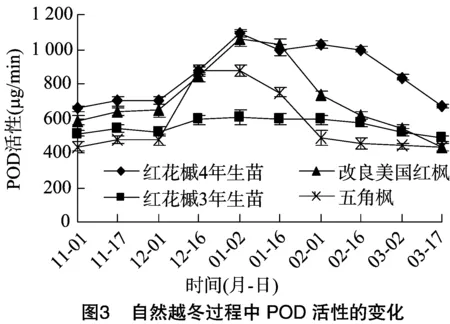
3.3 POD活性的变化
图3结果显示,在自然越冬过程中,4种树种的POD活性的基本走势都是先升高后下降,但红花槭3年生苗POD活性虽然有所升高,但是变化比较平缓。红花槭4年生苗和改良美国红枫的POD活性总体上处于较高的水平,五角枫在11月初期到12月上旬时的POD活性均最低,但在12月中旬有个大幅度提升,与红花槭4年生苗和改良美国红枫在同一时期的POD活性水平相当。结果表明,4种树种的POD活性会随着越冬过程中温度的降低逐渐增强,红花槭4年生苗达到极值时表现出的活性最高,但是五角枫从越冬初期到最低温时POD活性的升幅最大,改良美国红枫稍次之,红花槭3年生苗的走势则较平缓,可见该树种通过增加POD活性来抵御低温胁迫的能力较弱。
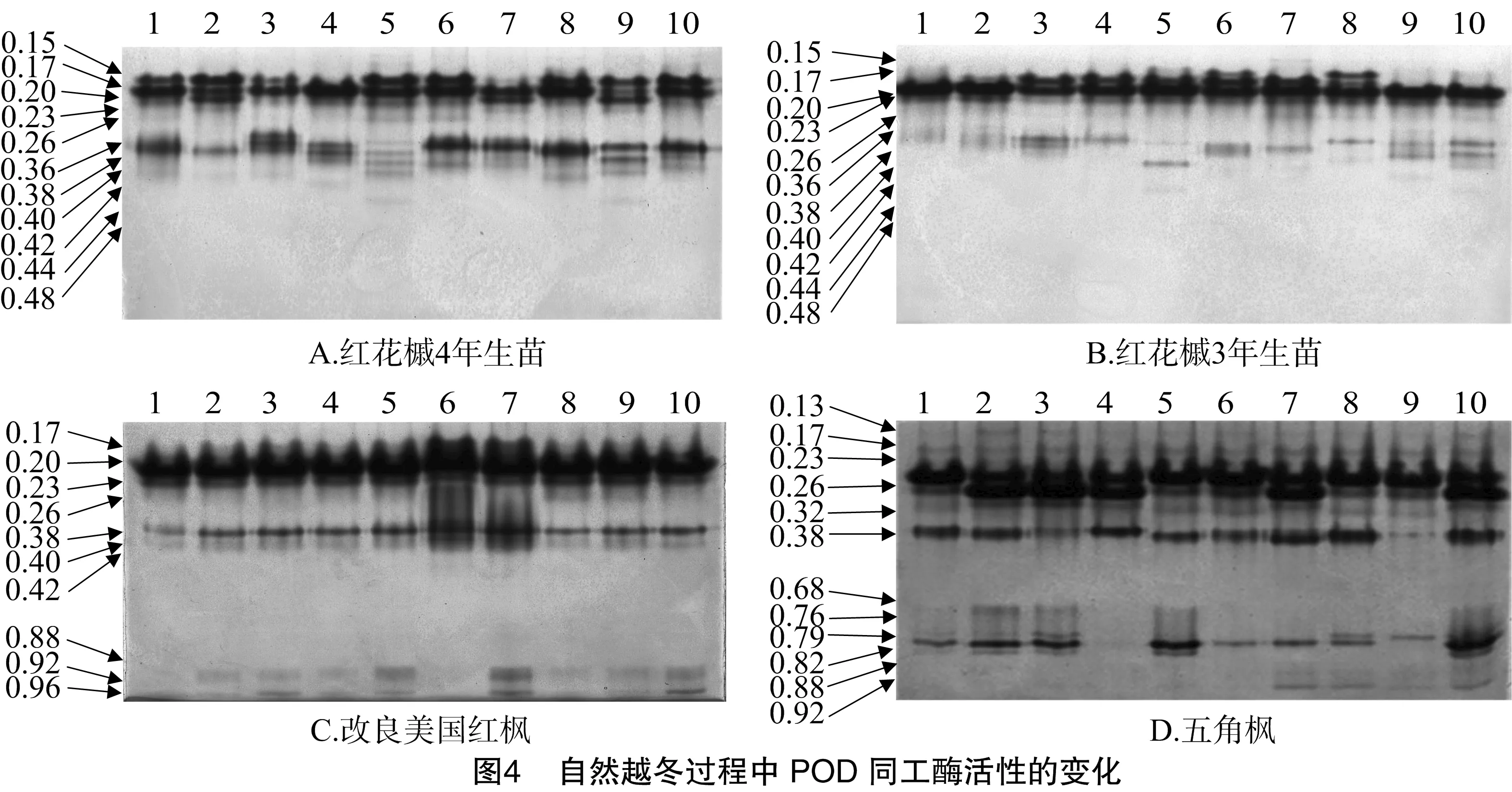
3.4 POD同工酶活性的变化
如图4所示,4种树种均含有Rm=0.17、0.23、0.26、0.38的这几条POD同工酶条带。红花槭4年生苗的条带总体上要强于3年生苗。改良美国红枫比红花槭3年、4年生苗多出了Rm=0.88、0.92、0.96的3条条带,其Rm=0.20、0.23、0.38、0.40的这4条条带要强于另外2种红枫。五角枫的POD同工酶条带数最多,共有12条,五角枫的Rm=0.23、0.38的条带表现较强,强于其他3种红枫。结果表明,POD同工酶也与几种树种的抗寒性相关,其中抗寒性较强的品种其同工酶谱带也表现较强。可以看出,整体上五角枫的条带数最多,且条带表现均较强,其次是改良美国红枫、红花槭4年生苗,红花槭3年生苗的同工酶条带则表现最弱。
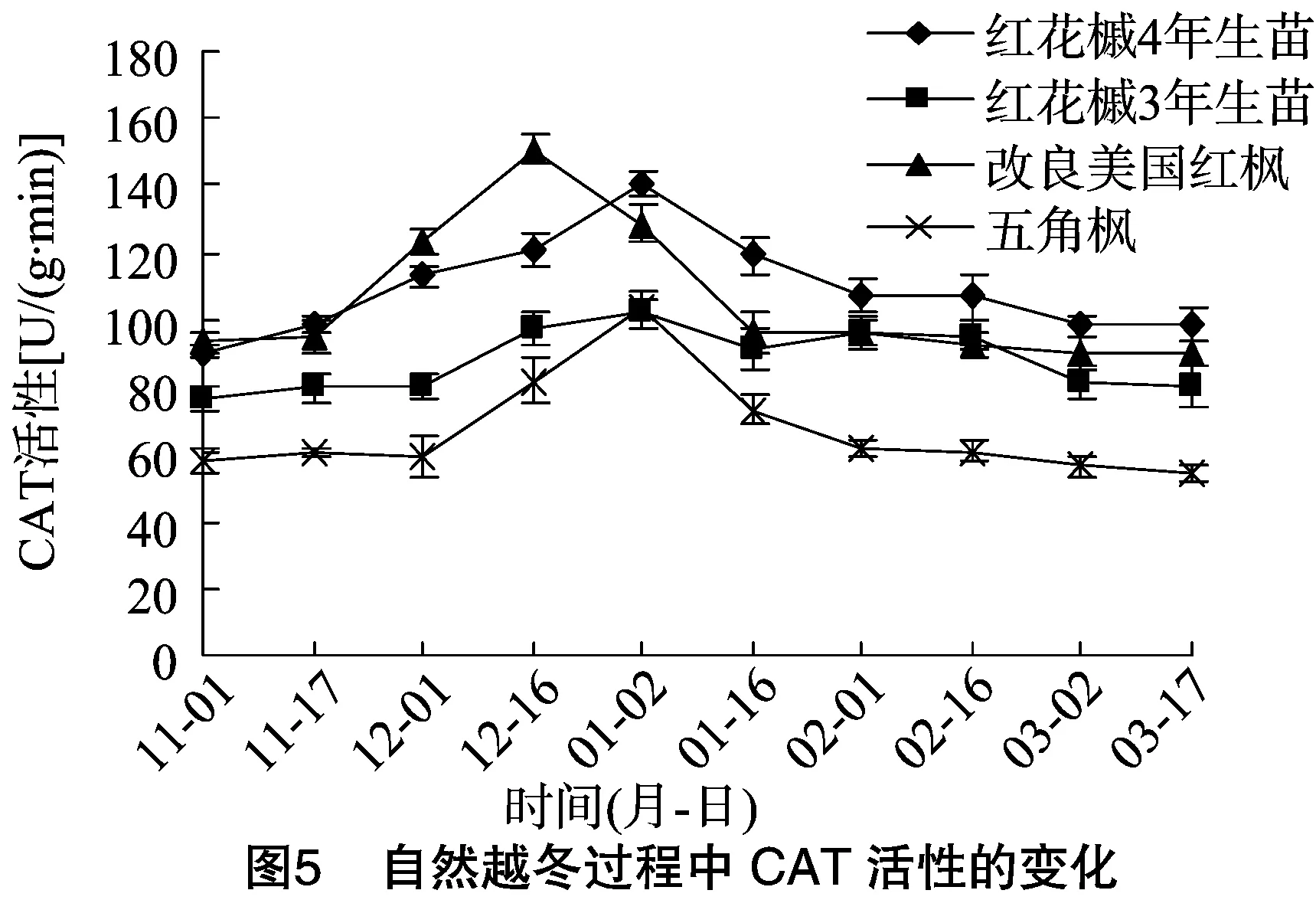
3.5 CAT活性的变化
从图5可以看出,红花槭4年、3年生苗和改良美国红枫在自然越冬过程中的CAT活性总体呈先升后降的趋势,但是五角枫的CAT活性在整个冬季的走势平缓。在越冬初期,3种红枫的CAT活性呈先缓慢上升后急剧上升的趋势,11月1日至11月17日,变化比较平缓,升幅不大,12月初至12月中旬,酶活性急剧增加,并且3种红枫先后达到峰值,其中红花槭4年生苗、改良美国红枫分别在1月2日、12月16日达到最大值140.7、150.6 U/(g·min),分别比测定初期值高 1.56、1.62倍,红花槭3年生苗在1月2日达到最大值 102.9 U/(g·min),比测定初期值高1.34倍。五角枫CAT活性在冬季低温时达到最大值,比初期测定值高了1.80倍,相比另外3种树种在整个取样期间的总体酶活性变化幅度最大。
3.6 CAT同工酶活性的变化
由图6可见,CAT同工酶图谱中的4种树种均出现了CAT同工酶条带,且其迁移率相同,Rm=0.94。结果表明,几种树种的CAT同工酶条带变化无明显差异,且均含有同一条条带,表明植物体中已测出的这一种CAT同工酶可能与几种树种的抗寒性不直接相关,但是却能协调体内的H2O2平衡。
4 结论与讨论
植物在遭受低温逆境时,体内的自由基增多,其自身会激发SOD、POD等植物体内的酶促防御系统,从而阻止膜脂过氧化,使其活性适应胁迫。可以通过提高护酶活性来清除过多的自由基,使其在一定范围内与自由基保持相对平衡[19]。人们讨论的酶促防御系统中,最常被测定就是SOD、POD、CAT,前人有许多研究证实了植物在受到低温胁迫时,其自身酶促防御系统会发生响应,保证植物在冬季低温下的正常生长[20]。

本试验结果表明,4种树种均会通过增加其SOD、POD、CAT活性来保证其在低温逆境中的正常生存,这与前人的研究结果一致[21]。同时测定每种植物在不同时期的同工酶变化,也发现其SOD、POD同工酶活性都会随着温度的降低相应增强,这与其活性的增加是相对应的。测定CAT活性发现,随着温度降低,其活性相应增强,但是其同工酶却没有明显变化,可能是因为CAT在植物体中是用于清除H2O2的,也可能只是响应H2O2的增加[22-23]。
通过对各种酶活性变化的综合评价,发现在越冬过程中温度达到最低值时,4种树种的SOD、POD、CAT的活性增强,从而增强了细胞膜保护系统清除活性氧的能力,其变化幅度根据树种不同也表现出很大差异。与4个树种的POD、SOD同工酶相比,CAT同工酶谱带多样性较差,只有1个条带,说明相比之下CAT对低温胁迫不敏感。已有研究认为,抗寒性强的品种体内保护酶类活性较高是其抗寒性强的原因之一[24-25]。由此判断,4个树种的酶促防御系统反映的抗寒性强弱依次表现为五角枫、改良美国红枫、红花槭4年生苗、红花槭3年生苗。
本试验首次研究了越冬过程中的低温胁迫对美国红枫系列品种抗氧化酶系统活性的影响,由本试验可以看出,不同品种的林木因其遗传特性不同,会表现出不同的适应性和抗逆性,今后我们需要在苗木引种和选育上找到最适合当地的树种,以提高用于美化城市环境的植物的成活率。
[1]荣旭升,孙迎坤,赵 爽,等. 彩叶树种新品种——美国红枫[J]. 现代园林,2006(4):42-43.
[2]刘 毓. 国外优良彩叶槭树资源引种及适应性研究[D]. 济南:山东师范大学,2010.
[3]王 菲,潘 婷,宋 南. 低温胁迫对红花槭生理指标的影响[J]. 农业科技与信息:现代园林,2011,8(9):15-17.
[4]刘广林,曹 婷,梅 梅. 红花槭和自由人槭抗寒性鉴定及生理生化指标差异分析[J]. 沈阳农业大学学报,2014,45(3):289-293.
[5]曾庆平,郭 勇. 植物的逆境应答与系统抗性诱导[J]. 生命的化学,1997,17(3):31-33.
[6]刘 冰,梁婵娟. 生物过氧化氢酶研究进展[J]. 中国农学通报,2005,21(5):223-224,232.
[7]汪耀富,韩锦峰,林学梧. 烤烟生长前期对干旱胁迫的生理生化响应研究[J]. 作物学报,1996,22(1):117-121.
[8]Larson R A. The antixidanis of higher plants[J]. Phytochemistry,1988(27):977-978.
[9]Gill S S,Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930.
[10]Sawada Y,Ohyama T,Yamazaki I. Preparation and physicochemical
properties of green pea superoxide dismutase[J]. Biochimica et Biophysica-Enzymology,1972,268(2):305-312.
[11]Fghire R,Ali O I,Anaya F,et al. Protective antioxidant enzyme activities are affected by drought in quinoa(ChenopodiumquinoaWilld)[J]. Journal of Biology Agriculture and Healthcare,2013,3(4):62-68.
[12]殷 有,苏宝玲,周永斌,等. 抗氧化酶促防御系统对白皮松幼苗抗寒性的影响[J]. 沈阳农业大学学报,2001,32(4):278-280.
[13]郭惠红,宋 菲,沈 昕,等. 金边卫矛冷驯化期间SOD和POD同工酶及蛋白的研究[J]. 北京林业大学学报,2005,27(6):56-61.
[14]陆秀君,张 倩,许有博,等. 对北方地区引种的加拿大糖槭越冬状况的研究[J]. 辽宁林业科技,2008,42(2):14-17,42.
[15]陈建中,胡建芳,杜慧玲. 低温胁迫下杨树SOD酶活性研究[J]. 天津农业科学,2013,19(12):98-100.
[16]张志良. 植物生理学实验指导[M]. 北京:高等教育出版社,1990:154-155.
[17]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M]. 北京:科学出版社,1999:263-265.
[18]冯建灿,张玉洁,杨天柱. 低温胁迫对喜树幼苗SOD活性、MDA和脯氨酸含量的影响[J]. 林业科学研究,2002,15(2):197-202.
[19]董泗建,刘昌玲. 一种鉴定过氧化氢酶活性的铁染色法[J]. 生物化学与生物物理进展,1996,23(1):86-88.
[20]鲍思伟. 云锦杜鹃低温半致死温度对自然降温的适应[J]. 西南民族大学学报(自然科学版),2005,31(1):99-102.
[21]和红云,田丽萍,薛 琳. 植物抗寒性生理生化研究进展[J]. 天津农业科学,2007,13(2):10-13.
[22]Almeselmani M,Deshmukh P S,Sairam R K,et al. Protective role of antioxidant enzymes under high temperature stress[J]. Plant Science : an International Journal of Experimental Plant Biology,2006,171(3):382-388.
[23]Sairam R K,Srivastava G C,Saxena D C. Increased antioxidant activity under elevated temperatures,a mechanism of heat stress tolerance in wheat genotypes[J]. Biol Plant,2000,43(2):245-251.
[24]杨再强,韩 冬,王学林,等. 寒潮过程中4个茶树品种光合特性和保护酶活性变化及品种间差异[J]. 生态学报,2016,36(3):629-641.
[25]王淑杰,王连君,王家民,等. 抗寒性不同的葡萄品种叶片中氧化酶活性及变化规律[J]. 中外葡萄与葡萄酒,2000(3):29-30.

