唾液乳杆菌Ls04对小鼠肠道菌群及黏膜SIgA质量浓度的影响
郝薇,范彧,闫雪,解林奇,刘媛媛,王安如
(北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室,北京100192)
0 引言
唾液乳杆菌(Lactobacillus salivarius)主要来源于人和动物的口腔及肠道,是一种具有多种生理功能的重要益生菌。研究表明,唾液乳杆菌能够影响肠道菌群结构,帮助建立以有益菌为主体的肠道微生物菌群[1];对先天性免疫防御系统及免疫机能具有调节作用,提高小肠局部黏膜免疫水平[2-4];还可产生有机酸、过氧化氢,分泌多种细菌素[5-8],防止单细胞增生李斯特菌、幽门螺旋杆菌等致病菌的感染[9-12]。唾液乳杆菌Ls04能够在胃肠道模拟环境中保持高存活率,对肠道致病菌具有良好的体外抑制作用,具有潜在的益生性能[13]。本文对Ls04对小鼠肠道微生物区系及肠黏膜分泌型免疫球蛋白A(secretory imm unoglobulin A,SIgA)质量浓度的影响及持续作用效果进行研究,以期能够更加全面的评估唾液乳杆菌Ls04的益生特性。
1 实验
1.1 材料
菌株:唾液乳杆菌(Lactobacillus salivarius)菌株Ls04由北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室保存;E.coli K 88(C 83901)、E.coli K 99(C 83709)购自中国兽医药品监察所。
试验动物:SPF级昆明白、雄性、3周龄小鼠100只,购自北京维通利华试验动物技术有限公司,小鼠每笼5只饲养于普通笼中,笼底垫上碎木屑并每3天更换;控制室内温度20℃~25℃、湿度45%~50%,12 h黑暗,12 h光照;日常用水采用纯净水,灭菌,基础日粮为SPF级标准小鼠生长维持期颗粒饲料,自由采食饮水。
培养基及试剂:BBL琼脂培养基用于双歧杆菌(Bifidobacterium)计数;M RS琼脂培养基用于乳杆菌(Lactobacillus)计数;紫红胆盐葡萄糖琼脂培养基(Violet red bile glucose,VRBG)用于肠杆菌(Enterobacteriaceae)计数;Pfizer琼脂培养基用于肠球菌(Enterococcus)计数;胰月示亚硫酸盐环丝氨酸琼脂培养基(T ryptose sulfite cycloserine,TSC)用于产气荚膜梭菌(C lostridium perfringens,C.perfringens)计数;营养肉汤琼脂培养基(N utrient Broth,NB)用于大肠杆菌(Escherichia coli,E.coli)K88、K99培养;小鼠SIgA Elisa(enzym e linked imm unosorbent assay)试剂盒用于小鼠肠黏膜SIgA含量的测定。
1.2 方法
1.2.1菌株活化及抑菌实验
将冷冻干燥的唾液乳杆菌Ls04菌粉(实验室制备,活菌数为8.4×1010cfu/g)接种于M RS肉汤培养基中,37℃静置培养24 h,经传代培养,以1%接种量接种于MRS培养基中,过夜培养后,5 000 r/min离心10 min,取上清液用于抑菌试验;将营养肉汤琼脂培养基(含1%葡萄糖)高压高温灭菌后,冷却至45℃,按1μL菌液/mL培养基的比例加入过夜培养的E.coli K 88、K 99菌液,震荡混匀,倒入无菌平板,凝固待用。在琼脂平板等距放置3只牛津杯,每只牛津杯中加入100μL待测唾液乳杆菌菌液(3个重复),37℃培养20 h,卡尺测量抑菌圈直径。
1.2.2实验动物处理
小鼠购进后,适应性喂养7 d,随机分成4组,每组25只,即Ls高、中、低剂量组及对照组。实验设计与分组如表1所示。各组灌胃量均为0.2 mL/只,灌胃时间15 d。

表1 实验设计与分组
2 结果
1.2.3小鼠大肠黏膜采集及菌群测定
将灌胃前及灌胃15 d各处理组小鼠,及灌胃结束后第3,7,14天的Ls中剂量组小鼠断颈处死,每组5只,解剖后剖开大肠,无菌操作刮取大肠黏膜组织约0.1 g,将其溶于10 mL无菌生理盐水中,充分溶解后进行稀释,选3个稀释度进行平板计数,每个稀释度3个平行。用于大肠杆菌计数的VRBG平板于30℃培养,24 h后观察结果;用于乳杆菌计数的MRS平板以及用于双歧杆菌计数的BBL平板置于厌氧罐中,37℃培养48 h后计数;肠球菌于Pfizer平板计数,35℃厌氧培养48 h;产气荚膜梭菌用TSC平板分离,涂布完成后倒置于厌氧罐中,36℃培养20 h后计数[14]。
1.2.4小鼠小肠黏膜采集及SIgA测定
无菌取上述处理组小鼠小肠部分2.5 cm,去除肠道内残渣后,刮取小肠黏膜表面,加入无菌pH=7.2浓度为0.01m ol/L的PBS缓冲溶液200μL,充分震荡混匀,于40℃,转速为4 000 r/min离心15 min,收集上清液,-80℃冻存待测。采用酶联免疫方法(ELISA)中的双抗体夹心法测定样品中SIgA水平[15],按SIgA试剂盒说明书进行检测。
1.2.5统计分析
实验数据采用SPSS 17.0软件进行单因素方差分析,结合Ducan法进行多重比较,结果以平均值±标准差表示。以P<0.05作为差异显著性判断标准。
2.1 唾液乳杆菌Ls04抑菌特性
E.coli K 88、K 99被认为是引起腹泻的主要致病菌。由表2可以看出,唾液乳杆菌Ls04的菌液在E.coli K 88和K 99平板上均表现出清晰的透明抑菌圈,表明该菌对E.coli K 88和K99具有显著的抑菌特性。

表2 唾液乳杆菌菌液抑菌圈直径(n=3)
2.2 不同剂量的唾液乳杆菌Ls04对小鼠肠道菌群的影响
灌胃前后各处理组小鼠肠道菌群结构如表3所示。由表3可以看出,对照组小鼠经15 d灌胃后,肠球菌数量显著升高(P<0.05),乳杆菌、双歧杆菌、肠杆菌及产气荚膜梭菌数量相较于灌胃前均无显著差异(P>0.05)。Ls低、中、高剂量组小鼠肠道中乳酸菌数量随灌胃剂量的增加而显著升高(P<0.05)。双歧杆菌数量同样显著升高,Ls低、中、高剂量组之间差异不显著,但Ls中剂量组中双歧杆菌数量最高,达4.2×107cfu/g左右。灌胃唾液乳杆菌Ls04后,肠球菌、肠杆菌及产气荚膜梭菌均被显著抑制。Ls低剂量组小鼠肠道中肠杆菌、肠球菌及产气荚膜梭菌数量与对照组无显著差异(P>0.05),Ls04中剂量、高剂量的添加则显著降低了小鼠肠道中上述各菌数量(P<0.05)。Ls中剂量组中肠杆菌、肠球菌及产气荚膜梭菌数量分别约为7.8×104,1.7×107g-1及3.3×104g-1,显著低于对照组而与Ls高剂量组无显著差异。由此可见,Ls04中剂量的添加即可有效增加小鼠肠道中有益菌数量,并最大程度抑制肠杆菌等肠道致病菌。
2.3 不同剂量的唾液乳杆菌对小鼠肠道黏膜SIgA质量浓度的影响
灌胃唾液乳杆菌Ls04对小鼠肠黏膜SIgA质量浓度同样具有显著影响(P<0.05)。如图1所示,Ls低剂量组小鼠肠黏膜SIgA质量浓度约为15.8μg/mL,与对照组无显著差异。Ls中、高剂量组与对照组相比,小鼠肠黏膜SIgA质量浓度均显著升高,并且Ls中剂量组小鼠肠黏膜SIgA质量浓度最高,约为19.1μg/mL。
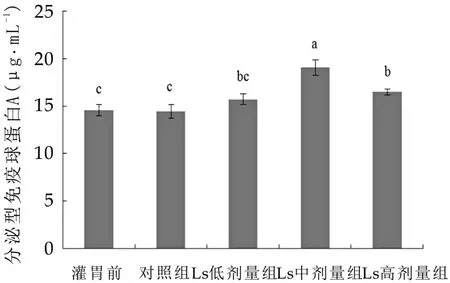
图1 灌胃唾液乳杆菌Ls04对小鼠肠黏膜SIgA质量浓度的影响(n=5)
图1中,柱状图上所标字母相异表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05)。
2.4 唾液乳杆菌的定植对小鼠肠道菌群的影响
为进一步研究唾液乳杆菌Ls04的定植对小鼠肠道菌群结构影响的持续作用,在Ls中剂量组小鼠灌胃结束后14 d内,研究其肠道菌群结构的动态变化过程。如表4所示,灌胃结束后,Ls中剂量组小鼠肠道中乳杆菌及双歧杆菌数量分别约为2.4×108g-1和4.2×107g-1,结束后3 d,肠道中乳杆菌、双歧杆菌数量有所降低,随后保持相对稳定。至灌胃结束后14 d,小鼠肠道中乳杆菌、双歧杆菌数量分别为1.3×108g-1和3.0×107g-1,仍显著高于灌胃前水平(P<0.05)。灌胃中剂量Ls04使小鼠肠道中肠杆菌数量显著降低,至灌胃结束后14 d,肠杆菌数量虽显著升高至约2.1×105g-1,相较于灌胃前仍被显著抑制(P<0.05)。产气荚膜梭菌数量在灌胃结束后显著升高,至14 d其数量基本恢复至灌胃前数量水平(P<0.05)。而小鼠肠道中肠球菌数量在灌胃结束后并无明显变化(P>0.05)。
2.5 唾液乳杆菌的定植对小鼠肠道黏膜SIgA质量浓度的影响
为研究唾液乳杆菌Ls04的定植对小鼠肠黏膜SI-gA质量浓度的影响,本研究对Ls中剂量组小鼠在灌胃前及灌胃结束后14 d内小鼠肠黏膜SIgA质量浓度的动态变化进行了测定。如图2所示,灌胃中剂量Ls04后,小鼠小肠黏膜SIgA质量浓度显著升高。在灌胃结束7d内,小鼠肠黏膜SIgA质量浓度显著降低,随后保持相对稳定,至灌胃结束后14 d,肠黏膜SIgA质量浓度约为16.1μg/mL,显著高于灌胃前水平(P<0.05)。
图2中,柱状图上所标字母相异表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05)。
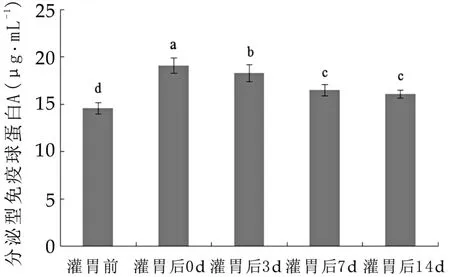
图2 Ls04中剂量组小鼠灌胃前及灌胃后小肠黏膜SIgA的动态变化(n=5)
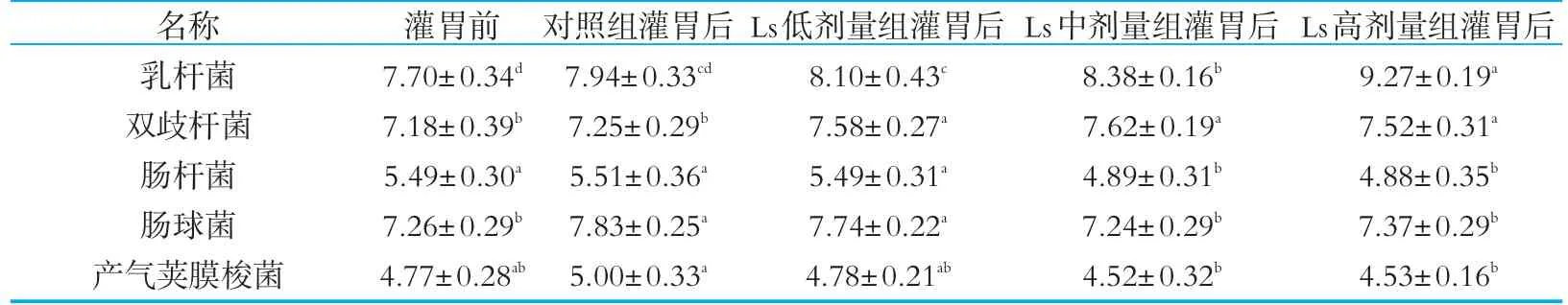
表3 灌胃唾液乳杆菌对各组小鼠肠道菌群的影响(n=5) g-1
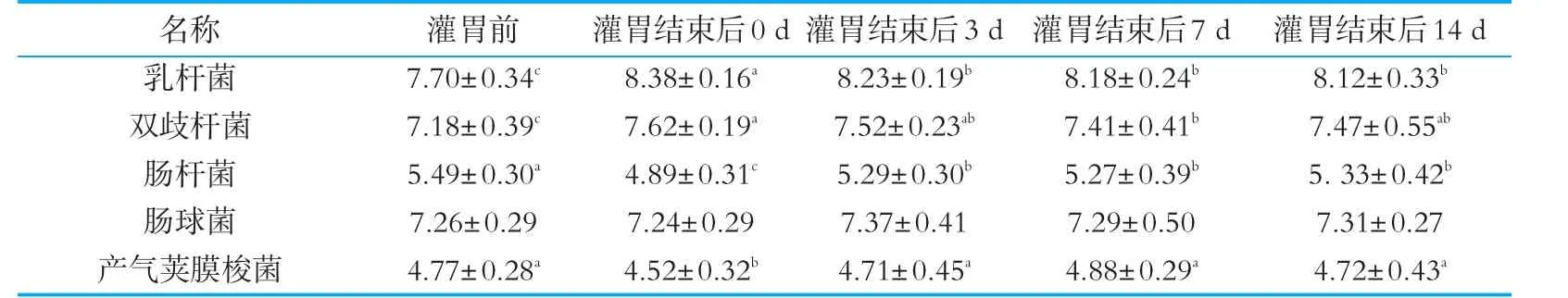
表4 灌胃结束后唾液乳杆菌Ls04中剂量组小鼠大肠黏膜处微生物区系的动态变化(n=5) g-1
3 结果与讨论
唾液乳杆菌Ls04满足潜在益生菌的筛选标准,且对E.coli K 88、E.coli K99具有显著的抑菌特性,这与之前报道相一致[16-18]。除大肠杆菌外,唾液乳杆菌由于其高效产酸性能及其所产细菌素的广谱抑菌特性[6,9],对沙门氏菌、金黄色葡萄球菌等多种致病菌均具有显著的体外抑制作用[19]。
微生物菌剂进入到机体肠道后,需要在肠黏膜表面黏附定植、形成生物屏障并分泌抑菌物质,才能有效抑制病原菌,发挥平衡肠道微生物区系的益生作用。Tannock等[20]曾报道,唾液乳杆菌是为数不多的能够在宿主肠道内有效定植甚至在肠道乳酸菌中占数量优势的菌种。本文结果显示,Ls中剂量组小鼠在灌胃结束14 d乳酸菌数量保持相对稳定且高于灌胃前水平,这一点间接说明了唾液乳杆菌Ls04的肠道定植力。本文结果同样显示,灌胃Ls04能够显著提高小鼠肠道内双歧杆菌的数量,而这一结果在仔猪动物试验上得到了证实:饲喂仔猪唾液乳杆菌B1后,B1能够有效地定植于仔猪肠道内,并且增加哺乳前期仔猪粪便和十二指肠局部黏膜双歧杆菌的相对丰富度[21]。
益生菌的作用机制不仅包括平衡胃肠道微生物环境,还能对肠道免疫系统进行有效的刺激和调节[22-23]。SIgA是机体肠黏膜免疫系统重要的抗体之一,由SIgA参与的体液免疫是防御病原菌在肠黏膜定植的重要防线。因此,本文对Ls04对小鼠肠黏膜SIgA质量浓度的影响及持续作用效果进行了研究。结果表明,唾液乳杆菌Ls04能够在肠道内有效定植并促进肠黏膜SIgA的分泌。张锦华(2011)曾报道了唾液乳杆菌B1对新生仔猪免疫性能的影响,结果表明,饲喂唾液乳杆菌B1后,仔猪小肠、特别是十二指肠处IgA分泌细胞数量相较于对照组显著升高,差异极显著[21],这与本文结果基本一致。此外,有报道称肠道内的一些共生菌同样能够诱导SIgA的分泌[24]。Moreau和Baforiau-Routhiau研究发现,双歧杆菌、特别是在婴儿肠道中的双歧杆菌,与促进SIgA的合成分泌以及提高抗感染病原菌的能力密切相关[25]。
本文结果提示,唾液乳杆菌Ls04在停止服用后仍能够有效抑制小鼠肠道致病菌,增殖有益菌;并且能够持续有效地提高小鼠肠黏膜SIgA质量浓度,刺激机体免疫反应。因此将唾液乳杆菌Ls04应用到益生菌产品中去,可持续平衡肠道菌群、增强机体免疫力,具有广阔的市场应用前景。
参考文献:
[1]TINRAT S,SARAYA S,CHOMNAWANG M T.Isolation and characterization of lactobacillussalivariusMTC1026 as a potential probiotic[J].Journal of General and Applied Microbiology,2011,57(6):365-678.
[2]LANGA S,JUAN M R,RUTH IC,etal.Characterization ofLac to bacillus salivariusCECT 5713,a strain isolated from human milk:fromgenotype to phenotype[J].Applied Microbiology and Biotechnology,2012,94(5):1279-1287.
[3]DENG J,LIY F,ZHANG JH,et al.Co-administration of Bacillus subtil is RJGP16 and Lactobacillus salivarius B1 strongly enhances the intestinal mucosal immunity of piglets[J].Research in Veterinary Science,2013,94(1),62-68
[4]ZHANG J,DENG J,WANG Z,et al.Modulatory effects ofLactobacillussalivarius on intestinal mucosal immunity of piglets[J].Current Microbiology,2011,62,1623-1631.
[5]BARRETT E,HAYESM,O’CONNOR P,et al.Salivaricin P,one of a family of two-component antilisterial bacteriocins produced by intestinal isolates ofLactobacillus salivarius[J].Applied and Environmental Microbiology,2007,73:3719-3723.
[6]MESSAOUDIS,KERGOURLAY G,DALGALARRONDO M,et al.Purification and characterization of a new bacteriocin active against Campylobacter produced by Lactobacillus salivarius SMXD51[J].Food Microbiology,2012,(1),129-134.
[7]RIBOULET-BISSON E,STURMEM H J,JEFFERY IB.Effect of Lactobacillussalivarius Bacteriocin Abp118 on the Mouse and Pig IntestinalM icrobiota[J].PlosOne,2012,7(2),e31113.
[8]O’SHEA E F,O’CONNOR M,PAUL D C,et al.Production of multiple bacteriocins from a single locus by gastrointestinal strains ofLactobacillus salivarius[J].Journal of Bacteriology,2011,193(24):6973-6982.
[9]CORR SC,LIY,RIEDEL C U,et al.Bacteriocin production as a mechanism for the anti infective activity ofLac to bacillus salivariusUCC118[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104,7617-7621.
[10]MESSAOUDIS,KERGOURLAY G,ROSSERO A,et al.Identification of lactobacilli residing in chicken cecaw ith antagonism against Campylobacter[J].International Microbiology,2011,14:103-110.
[11]AUDISIO M C,APELLA M C.Bacteriocin-like substance produced byLactobacillus salivarius subsp.salivariusCRL1384 with anti-Listeria and anti-Salmonella effects[J].Research Journal of Microbiology,2010,5(7),667-675.
[12]RYAN K A,DALY P,LIY,etal.Strain-specific inhibition ofHelicobacter pylori by Lactobacillus salivarius and other lactobacilli[J].Journal of antimicrobial chemotherapy,2008,61(4):831-834.
[13]郭本恒.益生菌[M].北京:化工工业出版社,2004.
[14]徐致远,郭本恒,王荫榆,等.植物乳杆菌ST-Ⅲ对小鼠肠道菌群的调节[J].中国乳品工业,2006,34(2):10-12.
[15]周晶,周颖,曹凤波,等.乳酸杆菌对感染大肠杆菌小鼠肠黏膜免疫的影响[J].中国乳品工业,2015,43(2):12-15.
[16]NOURIM,RAHBARIZADEH F,AHNADVAND D,et al.Inhibitory effects ofLac to bacillus salivarius and Lac to bacillus crispatusisolated from chicken gastrointestinal tract onSalmonell aenteritidis andEscherichiacoli growth[J].Iranian Journal of Biotechnology,2010,8(1),32-37.
[17]R IBOULET-BISSON E,STURMEM H,JEFFERY IB.Effect ofLactobacillussalivariusbacteriocin Abp118 on the mouse and pig intestinal microbiota[J].Plos One,2012,2(7),1-12.
[18]MESSAOUDIS,MADIA,PREVOUST H,et al.In vitro evaluation of the probiotic potential ofLacto bacillus salivariusSMXD 51[J].Anaerobe,2012,18:584-589.
[19]齐炳理,李艳杰,陈世贤,等.唾液乳杆菌的生长特性及抑菌作用[J].乳业科学与技术,2015,38(3):1-4.
[20]TANNOCK GW,MUNRO K,HARMESEN H J,et al.Analysis of the fecal micr of lora of human subjects consuming aprobiotic product containingLactobacillus rhamnosusDR20.Applied and Environmental Microbiology[J].2000,66(6):2578-2588.
[21]张锦华.猪源乳酸杆菌的筛选及及其对仔猪肠道黏膜免疫影响的研究[D].南京,南京农业大学,2011.
[22]PEREZ-CAN of J,DONG H,YAQOOB P.In vitro immunomodulatory activity ofLactobacillus fer mentumCECT5716 and Lacto bacillus salivarius CECT5713:two probiotic strains isolated from human breast milk[J].Immunobiology,2010,215,996-1004.
[23]SIERRA S,LARA-VILLOSLADA F,SEMPERE L,et al.Intestinal and immunological effects of daily oral administration ofLactobacillus salivariusCECT5713 to healthy adults[J].Anaerobe,2010,16:195-200.
[24]MACPHERSON A J,UHR T.Induction of protective IgA by intestinal dendritic cells carrying commensal bacteria[J].Science,2004,303(5664):1662-1665.
[25]MOREAU M C,BAFOR IAU-ROUTH IAU V.Influence of resident intestinal microflora on development and functions of the in terstinal-associated lymphoid tissue[J].Springer Netherlands,2000,13(2):69-114.

