有机质和阳离子对氧化石墨烯团聚行为的影响
孙斌斌,张寅清,王坤坤,祝凌燕
有机质和阳离子对氧化石墨烯团聚行为的影响
孙斌斌,张寅清,王坤坤,祝凌燕*
(南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津城市生态环境修复与污染防治重点实验室,天津 300350)
利用动态光散射技术分别考察了3种天然有机质(NOM)及其浓度和阳离子对纳米氧化石墨烯(GO)在水环境中团聚动力学的影响.无NOM存在时,GO团聚行为符合经典的Derjaguin-Landau-Verwey-Overbeek (DLVO)理论和舒尔采-哈迪准则.Na+溶液中,NOM显著增强GO稳定性,顺序为腐殖酸(HA)>富里酸(FA)>海藻酸钠(SA),这主要是由于HA在GO之间产生了更强的空间位阻斥力.以HA为代表性有机质,2mg/L HA对GO在水溶液中的稳定性还受阳离子种类的影响:HA增强了GO在Na+和Mg2+溶液中的稳定性,然而对GO在Ca2+溶液中的稳定性几乎没有影响.提高HA浓度为5mg/L时:高浓度Mg2+溶液中,HA的盐析效应使得其未促进GO稳定性;Ca2+溶液中,HA与Ca2+发生了较强的桥联作用,使得HA促进了GO的团聚.
氧化石墨烯(GO);团聚动力学;天然有机质(NOM);二价阳离子
氧化石墨烯(GO)是单原子厚度的二维纳米材料,具有独特的电、热和机械性能,在很多领域得到广泛应用[1-4],这也导致GO会进入自然环境如水体和土壤当中,进而对细菌[5]、植物[6]和动物[7]等造成一定的毒性效应.GO的团聚行为是影响其应用、生物毒性和环境归趋的一个重要因素[8-10].因此,研究GO在水环境中的团聚对于正确评价和预测其生态环境风险具有一定的理论和现实意义.
多种水环境因素,包括金属离子、溶液pH值、矿物和天然有机质(NOM),均会显著影响GO的稳定性和迁移能力.NOM是由多种组分(主要包括腐殖质和生物大分子)组成的混合物,在天然水环境中的浓度一般为1~10mg/L[11].研究表明,不同来源和理化性质的NOM可显著影响纳米材料的溶解、团聚和毒性效应[9,12-14].之前的研究表明,天然有机质吸附至碳纳米材料表面后主要通过静电力、位阻斥力及架桥作用影响碳材料的稳定性[15-19].目前关于NOM对GO团聚动力学影响的研究主要集中于单一来源的有机质(如萨旺尼河腐殖酸)或者模型有机质(聚丙烯酸)[11,20-21].环境中其他来源的腐殖质和生物大分子(例如海藻酸钠)对GO在水环境中团聚动力学的影响仍需进一步探究.
本研究主要探讨NOM的类型(腐殖酸、富里酸和海藻酸钠)及浓度(2和5mg/L,TOC)和3种金属阳离子等对GO在水环境中团聚动力学的影响.不同类型和浓度有机质条件下,从GO在单价阳离子(Na+)和二价阳离子(Mg2+和Ca2+)溶液中的粘附系数、临界絮凝浓度和表面zeta电位、天然有机质絮凝动力学及DLVO理论计算来阐释团聚机理.
1 材料与方法
1.1 材料
GO固体粉末(99.0%)购自天津普兰纳米科技有限公司;氯化钠(NaCl)、六水氯化镁(MgCl2·6H2O)和无水氯化钙(CaCl2)购自国药集团化学试剂有限公司(天津);腐殖酸(HA, 53680)购自Sigma-Aldrich公司;富里酸(FA, H108498)和海藻酸钠(SA, 937673)购自上海阿拉丁有限公司.实验所用的其他化学试剂和溶剂均为分析纯或者优级纯.
1.2 有机质储备液制备
HA按照文献报道的方法进行纯化[22].HA粉末溶于超纯水中,用0.1mol/L NaOH调节pH值为10;氮气保护下,将溶液搅拌12h后离心(2500g, 45min)再移取上清液,然后用6mol/L HCl调节pH值到1,按照上述离心方法再次离心.离心之后,去掉上清液,将沉淀悬浮于0.1mol/L HCl和0.3mol/L HF的混合溶液中再次离心.如此重复3次,将得到的沉淀物冷冻干燥,避光4℃保存.纯化后的HA粉末溶于超纯水,调节pH值为10后搅拌12h,过0.22μm水相聚醚砜滤膜.SA和FA溶于超纯水,搅拌12h使其完全溶解,过0.22μm水相聚醚砜滤膜.有机质的浓度采用总有机碳分析仪测定(multi N/C 3100, Analytik Jena, Germany).元素分析仪(CHN-1000, LECO, USA)测定有机质的C、H、N和S等元素的含量(%),O元素的含量通过质量平衡计算.SA的分子式为(C6H7NaO6),其C的相对含量为31.4%.基于天然水环境中有机质的浓度范围(1~10mg/L),实验选择2和5mg/L (TOC)2个浓度来研究NOM对GO在水环境介质中团聚动力学的影响.
1.3 GO储备液的制备及表征
120mg GO粉末加入200mL超纯水中,磁力搅拌12h以活化GO表面,冰水浴超声处理4h (600W, 40kHz)[23],得到GO储备液.每次实验之前,GO储备液超声处理3min,使其均匀分散.所有实验均在一个月内完成,以保证该时间段内GO水合粒径不发生明显变化.通过系列表征手段,如紫外光谱、拉曼光谱、原子力显微镜、透射电镜和傅里叶变换红外光谱等,表明GO表面含有大量含氧官能团且其横向尺寸可达几微米,其片层厚度主要集中在0.7~1.8nm范围内,是氧化程度较高的单层GO[9].
GO在不同水溶液中的zeta电位及水合粒径h均采用纳米粒度及zeta电位分析仪(Zetasizer NanoZS90, Malvern, UK) 测定.水合粒径采用动态光散射(DLS)技术测定.zeta电位通过测量电泳迁移率并运用Henry方程计算得到,每一个值至少平行测试5次.10mmol/L NaOH和HCl用来调节溶液的pH值,使其控制在(5.5±0.2).
1.4 有机质在不同电解质中的团聚动力学
有机质(未被纳米颗粒吸附部分)在电解质中的团聚行为在一定程度上可以阐释其对纳米颗粒团聚行为的影响机制[15,24].选取不同类型和较高浓度的电解质,考察有机质在电解质溶液中的团聚动力学.由于2和5mg/L的有机质浓度较低,难以通过DLS监测其在电解质溶液中的团聚行为.因此将HA和FA浓度设为25mg/L TOC, SA的浓度设为50mg/L TOC (25mg/L SA未有显著的信号).
1.5 GO团聚动力学
向2mL无菌微量离心管(Crystalgen, USA)中加入0.5mL 30mg/L GO储备液,然后再加入0.5mL纯水或者有机质,再加入0.5mL的电解质溶液,涡旋震荡1s使溶液混合均匀,并立即倒入聚苯乙烯测试皿中测定GO水合粒径.测试间隔时间为15s,每次测定为20min到1h,以保证GO的水合粒径超过1.5h,0.
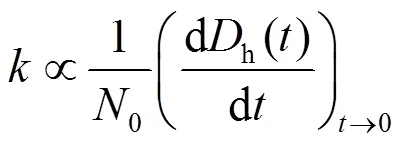
式中:0是GO的初始浓度(mg/L);h()为GO在时刻的水合粒径;为初始凝聚速率常数.
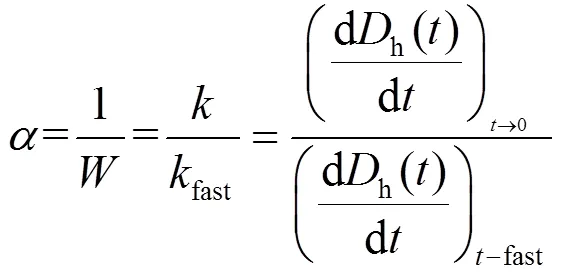
式中:fast是指扩散控制阶段的团聚速率常数.稳定性比率的倒数1/即颗粒的粘附系数可以用来量化GO的团聚动力学.粘附系数为反应限制阶段的团聚速率与扩散限制阶段的最大团聚速率fast的比值.不同电解质浓度条件下,初始凝聚阶段h()和进行最小二乘法回归分析,即可得到相应的值所有的团聚实验中,GO的浓度为定值(10mg/L).反应限制阶段和扩散限制阶段曲线的交点为临界絮凝浓度(CCC),这个浓度为使得纳米颗粒发生快速团聚的最低电解质浓度.
2 结果与讨论
2.1 GO和NOM的理化性质
GO的水合粒径为(200±7.5)nm(多分散系数为0.178),表面电位为(-46.4±0.46)mV,表明GO纳米颗粒在水环境中有很好的稳定性.GO的边缘和基面含有大量的含氧官能团,如羧基、羰基、环氧基团和羟基,是GO在水环境中稳定存在的主要原因.表1表明HA和FA的元素组成主要为C, H, N和O,不含S.腐殖质的元素组成和比值关系可以表示其芳香性和极性指数.H/C表示腐殖质的芳香性,其值越小表示芳香性越高;(N+O)/C表示腐殖质的极性指数,其值越高表示腐殖质极性指数越高.HA的H/C和(N+O)/C比值均低于FA(对应关系分别为0.663与0.824, 0.378与0.790),表明HA比FA有较高的芳香性和较低的极性指数(表1).通过总有机碳分析仪测定三种有机质(HA、FA及SA)的含碳量分别为62.5、43.1和29.4%;元素分析仪测定有机质的含碳量分别为64.3、47.2和31.4%,二者分析结果十分接近.GO在不同有机质溶液中的理化性质如表2所示,加入HA和FA(2和5mg/L)后,GO的电位和水合粒径无显著变化;加入SA之后,GO的表面电位(绝对值)和水合粒径均略微增加.SA加入后,GO的粒径略微增加,这主要是由于SA具有较大的分子结构和水合粒径.通过测定高浓度有机质的水合粒径,SA、HA、FA分子的水合粒径分别为140、120和120nm.
高浓度有机质在电解质溶液中的团聚动力学如图1所示.Na+溶液中,即使其浓度高达600mmol/L,3种NOM的水合粒径均没有发生明显变化.在Mg2+溶液,FA和SA分子水合粒径未发生明显变化,而HA分子在10mmol/L Mg2+溶液中发生了团聚.在Ca2+溶液中,HA分子在2.5和5mmol/L Ca2+溶液中发生快速团聚,FA分子仅在5mmol/L Ca2+溶液中发生团聚;50mg/L SA在实验浓度Ca2+溶液中也发生了快速团聚(5mmol/L Ca2+,粒径快速增长为2000nm).上述团聚实验表明,相较于FA和SA,HA更易在电解质溶液中发生团聚.鉴于3种NOM在不同类型和浓度电解质中的团聚行为,有机质的自团聚可能会影响GO纳米颗粒在不同水环境条件下的团聚行为.因此,将分别考察3种NOM及其浓度和阳离子类型对GO纳米颗粒在不同水环境条件下团聚动力学的影响.

表1 HA和FA的主要元素组成
注: -为未检验.
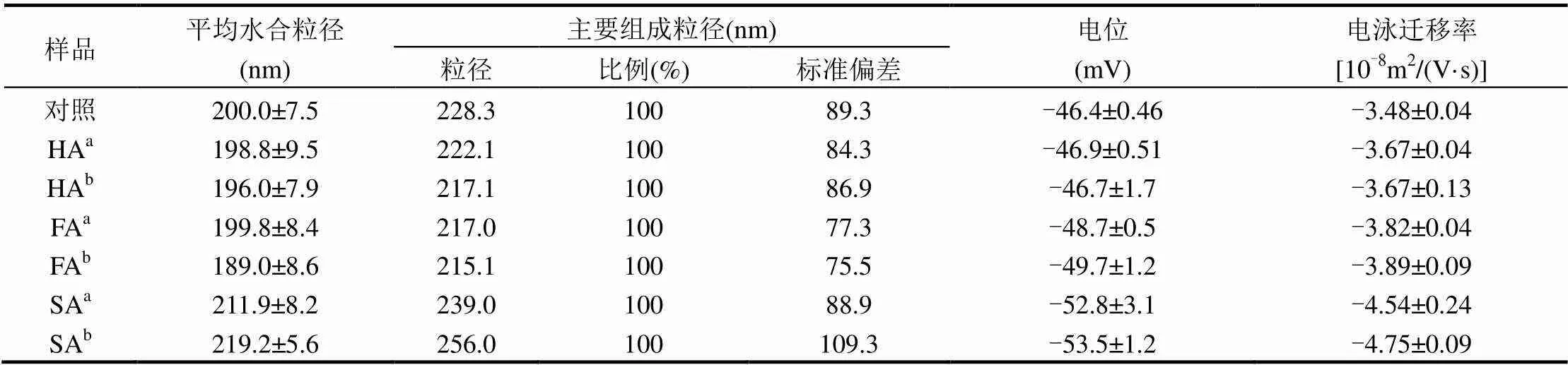
表2 pH(5.5 ± 0.2)条件下,GO在不同有机质溶液中的理化性质
注:a2mg/Lb5mg/L.

图1 pH (5.5 ± 0.2)条件下,3种NOM在不同电解质溶液中的团聚动力学
2.2 3种NOM对GO在Na+溶液中团聚动力学的影响
由图2GO的团聚动力学示意图可以看出,在无NOM存在条件下,按照粘附系数随离子浓度变化趋势可以将GO的团聚分为两个阶段:反应限制阶段和扩散限制阶段.在反应限制阶段,阳离子通过压缩双电层和离子中和反应降低颗粒之间的静电斥力,从而促进GO纳米颗粒的团聚.随着离子浓度的增加,粘附系数逐渐增加;在扩散限制阶段,GO颗粒之间由静电斥力和范德华引力所构成的能量势垒几乎消失,每一次碰撞都会使得GO发生不可逆的团聚,此时GO团聚速率与离子浓度无关,粘附系数始终为1.经计算,无NOM存在时,GO在NaCl, MgCl2和CaCl2溶液中的CCC值分别为190, 5.41和1.61mmol/L.根据DLVO理论,随着离子浓度的增大,离子压缩双电层作用会逐步增强,导致颗粒之间的静电斥力逐渐减小,最大能量势垒减小,第二能量极小值(绝对值)逐渐增大[17].理论计算表明GO在离子溶液中的团聚符合经典的胶体团聚DLVO理论.比如,当加入30mmol/L NaCl时,最大能量势垒为213.4KBT,第二能量极小值为-1.14KBT,表示GO在此溶液条件下比较稳定;当加入150mmol/L NaCl时,最大能量势垒为30.3KBT,第二能量极小值为-19.8KBT,表示GO在此条件下发生了明显团聚,但是尚未达到快速团聚.当加入300mmol/L NaCl时,其能量势垒和第二极小值均消失,表示GO发生了快速团聚.虽然GO不是球形颗粒,GO在离子溶液中的团聚仍符合经典的胶体稳定性DLVO理论,这与之前的研究结果相吻合[11,25-28].对于其他非球形和球形纳米颗粒,比如碳纳米管[16]、单层石墨烯[29]和二氧化锰[30],其在电解质溶液中的团聚行为也均符合DLVO理论.
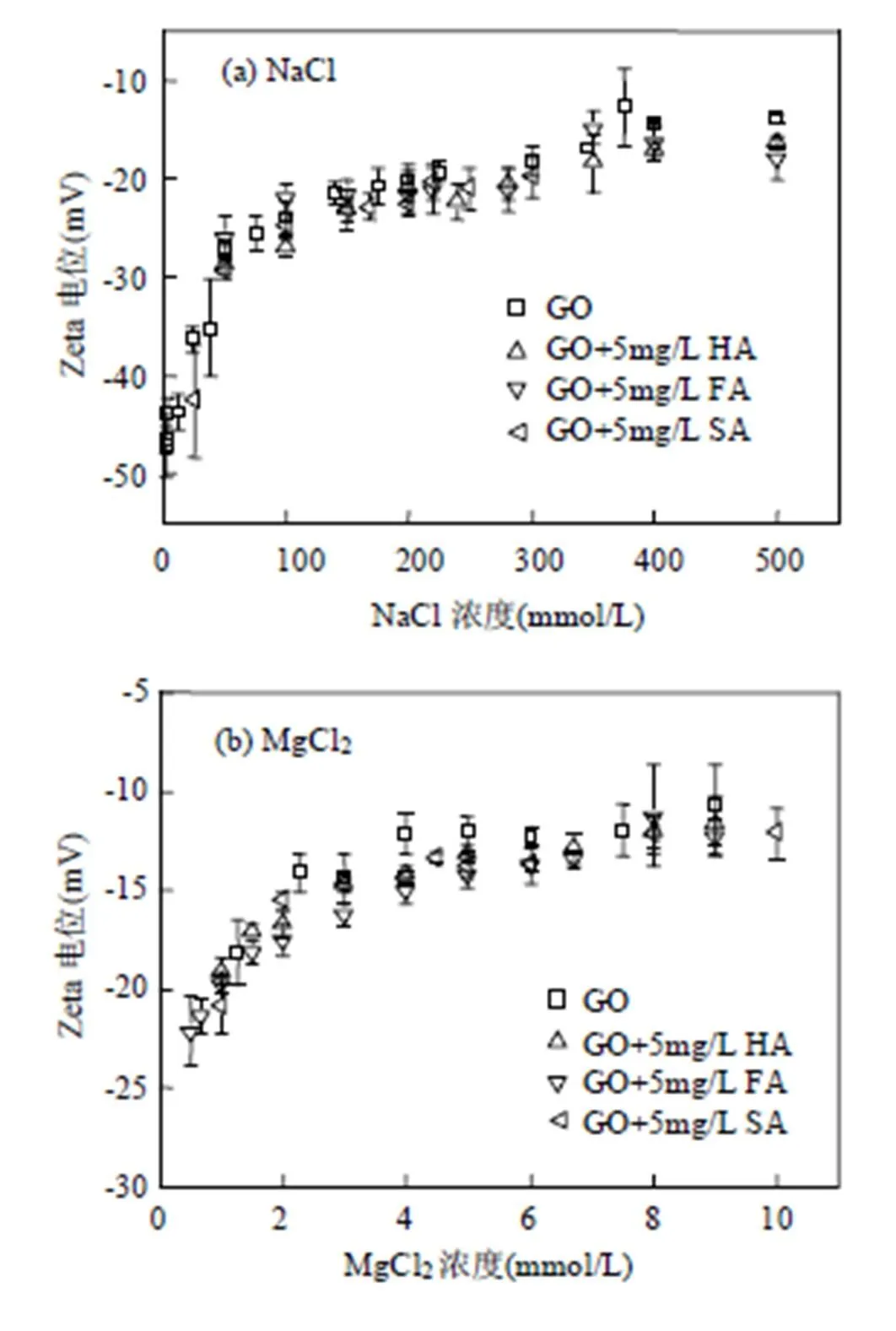
SA、FA和HA(2mg/L)存在条件下,GO在Na+溶液中的CCC值分别为298、319和355mmol/L,说明NOM可显著提高GO稳定性,其增强顺序为HA>FA>SA(图2).例如,SA、FA和HA(2mg/L)存在条件下,加入200mmol/L Na+,GO的粘附系数分别为0.55、0.01和0.003.图3(a)表明,GO表面电位(绝对值)随阳离子浓度增加而逐渐降低,说明其稳定性在逐渐降低.天然有机质加入并未显著改变GO的表面电位,表明有机质主要是通过增强颗粒间位阻斥力来增强GO颗粒的稳定性.相对于FA而言,HA有较高的芳香性和较低的极性指数.GO对于腐殖质中的较高分子量和芳香性的组分有更高的吸附能力[21,31].因此HA比FA和SA更容易吸附到GO表面,导致GO颗粒之间更强的位阻斥力.之前的研究表明,Na+存在条件下,西格玛来源的HA因具有较高芳香性而在GO上有更强的吸附能力,因此比萨旺尼河HA和FA更能有效促进GO的稳定性[18].
2.3 不同阳离子存在条件下,HA(2mg/L)对GO团聚动力学的影响
以HA为代表性有机质,研究2mg/L HA对GO在3种阳离子(Na+, Mg2+和Ca2+)溶液中的团聚行为的影响.GO粘附系数随电解质浓度的变化如图4所示.无HA存在时,GO在Mg2+和Ca2+中的团聚动力学均符合经典的DLVO理论.经计算,GO在MgCl2和CaCl2溶液中的CCC值分别为5.41和1.61mmol/L.根据舒尔采-哈迪准则(Schulze-Hardy rule),其他条件相同时,纳米颗粒在电解质溶液中的CCC和相对应阳离子价态的六次方成反比(CCC∝1/Z6, Z为阳离子价态).GO在Mg2+、Ca2+中的CCC值和Na+存在条件下的CCC值的比值分别为2-5.13和2-6.87,比值关系基本符合舒尔采-哈迪准则.

图4 不同类型和浓度阳离子存在条件下,HA对GO粘附系数的影响
如图4所示,GO在HA溶液中的稳定性依赖于阳离子的类型和浓度:HA分子增强了GO在Na+和Mg2+溶液中的稳定性,但是对GO在Ca2+溶液中的稳定性几乎没有影响.HA分子通过增强GO之间的静电斥力和位阻斥力来提高GO在Na+和Mg2+溶液中的稳定性.相对于Na+,二价阳离子Mg2+具有更高的电荷数和离子半径,使得其有更强的压缩双电层和电性中和能力,因此HA对GO在Mg2+溶液中稳定性的促进程度要低于在Na+溶液中.在实验浓度Mg2+和Ca2+范围内, HA对GO的电位值没有显著影响(图3).Ca2+存在条件下,HA对GO的稳定性没有促进作用甚至稍微抑制GO稳定性.这可能是由两方面的原因导致.一方面,GO的基面和边缘含有大量的羟基和羧基等官能团,可以与Ca2+发生桥联作用.在没有HA存在时,GO在Ca2+溶液中已经非常不稳定,其CCC值仅为1.61mmol/L.体系中增加HA对其稳定性的影响效果非常有限.另一方面,如前所述, HA分子在2.5和5mmol/L Ca2+溶液中发生快速团聚,说明HA也可能与Ca2+发生架桥作用.因此, HA的存在甚至可能会促进GO的团聚.
2.4 有机质浓度对GO在二价阳离子溶液中团聚动力学的影响
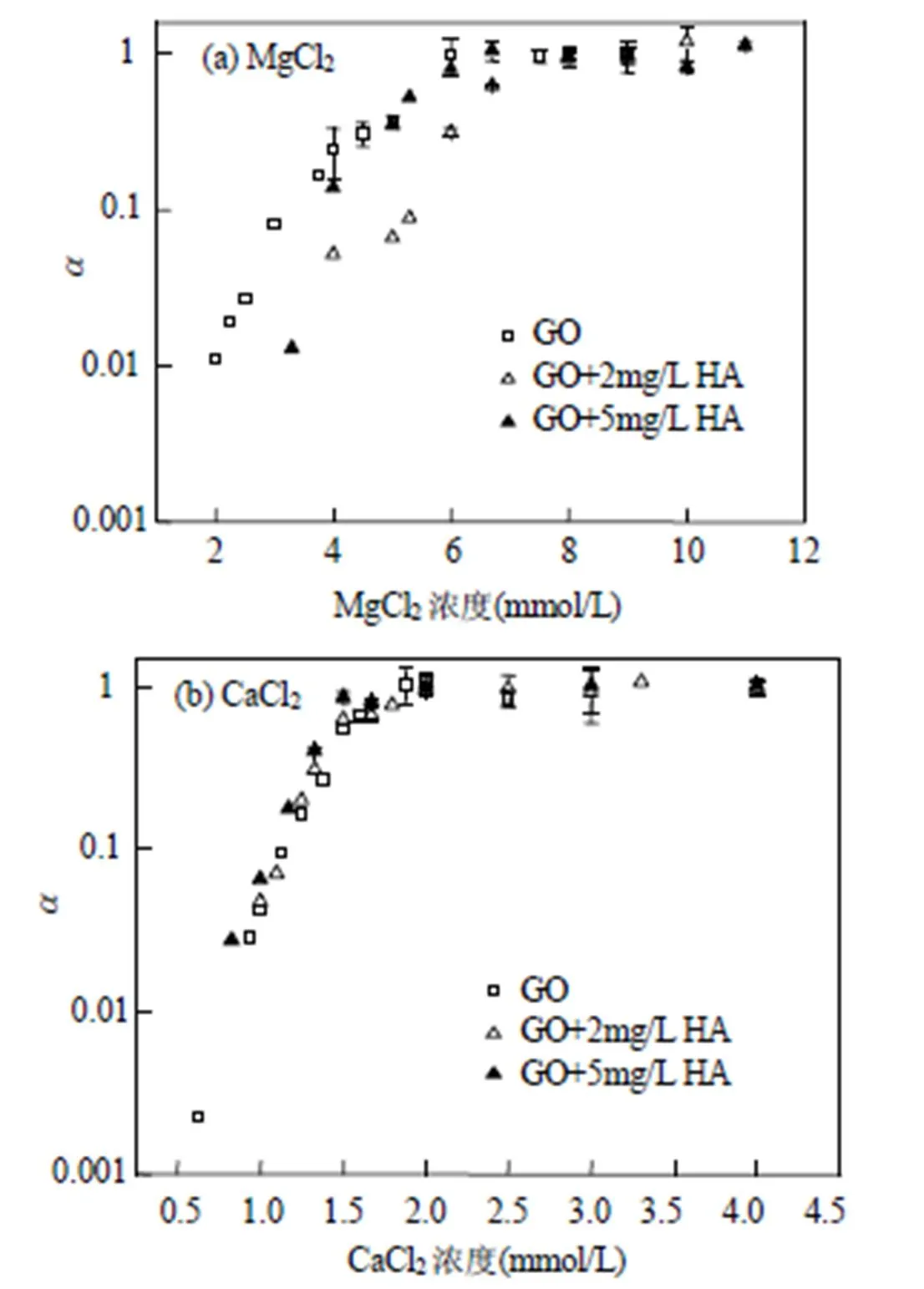
图5 不同浓度有机质存在条件下,α随电解质浓度的变化
图5显示了不同浓度NOM存在时GO粘附系数随MgCl2和CaCl2浓度的变化.当进一步提高HA浓度为5mg/L时:HA对低浓度Mg2+溶液中GO的稳定性有增强作用,但未进一步增强GO在较高浓度Mg2+溶液中的稳定性;Ca2+存在条件下,HA使得GO的α均高于无HA时,表明5mg/L HA使GO团聚速率增加从而抑制其稳定性.
HA难溶于水、只溶于碱液的现象说明了HA比FA和SA的疏水性更强.Mg2+比Na+更强的压缩双电层能力,使得HA分子在高浓度Mg2+溶液中发生了一定的盐析效应,进而使得5mg/L HA无法进一步促进GO在高浓度(5~10mmol/L) Mg2+溶液中的稳定性.Stankus等[32]发现,5mg/L SRHA(萨旺尼河腐殖酸)在高浓度Mg2+(10~ 100mmol/L)溶液中通过阳离子架桥作用抑制了金纳米颗粒的稳定性.在本研究当中,进一步提高Mg2+浓度时,5mg/L HA并未进一步提高GO纳米颗粒的稳定性,也有可能是Mg2+与HA之间发生了络合和架桥.
有机质的疏水性会影响二价阳离子参与的架桥作用强度进而改变纳米颗粒的团聚行为[12].有机质团聚动力学(图1)表明Ca2+与HA之间的结合要强于FA.如2.3所述,Ca2+存在条件下, HA(2mg/L)并未增强甚至是抑制GO的稳定性;当进一步提高HA(5mg/L)浓度时,GO的均高于无HA时,这主要是因为当进一步提高HA浓度时,Ca2+的架桥作用更加明显从而抑制GO稳定性的作用更强.之前的研究也表明,随着有机质浓度的逐渐增加(0~100mg/L),Ca2+的架桥作用逐渐增强从而使得柠檬酸包覆的纳米金颗粒在Ca2+溶液中的团聚速率不断增加[33].
3 结论
3.1 采用超声分散法制备的GO纳米颗粒悬浮液有较高的ζ电位、较强的电负性(-46.4mV)和较低的分散系数(0.178),可在水中稳定分散.
3.2 GO在电解质溶液中的团聚动力学符合经典的胶体稳定性DLVO理论和舒尔采-哈迪准则.Na+、Mg2+和Ca2+存在下,GO的临界絮凝浓度分别为190,5.41和1.61mmol/L.
3.3 Na+溶液中,SA、FA和HA(2mg/L)可通过增强GO颗粒之间的空间位阻斥力和静电斥力来增强GO的稳定性,GO的临界絮凝浓度分别提高至298、319和355mmol/L.
3.4 Mg2+和Ca2+存在条件下,有机质增强或者抑制GO稳定性与有机质的理化性质和浓度有关系.
[1] Dreyer D R, Park S, Bielawski C W, et al. The chemistry of graphene oxide [J]. Chemical Society Reviews, 2010,39(1):228- 240.
[2] Zhu Y W, Murali S, Cai W W, et al. Graphene and graphene oxide: synthesis, properties, and applications [J]. Advanced Materials, 2010,22(35):3906-3924.
[3] Loh K P, Bao Q L, Eda G, et al. Graphene oxide as a chemically tunable platform for optical applications [J]. Nature Chemistry, 2010,2(12):1015-1024.
[4] Mao H Y, Laurent S, Chen W, et al. Graphene: promises, facts, opportunities, and challenges in nanomedicine [J]. Chemical Reviews, 2013,113(5):3407-3424.
[5] Perreault F, Faria A F, Nejati S, et al. Antimicrobial properties of graphene oxide nanosheets: Why size matters [J]. ACS NANO, 2015,9(7):7226-7236.
[6] Begurn P, Ikhtiari R, Fugetsu B. Graphene phytotoxicity in the seedling stage of cabbage, tomato, red spinach, and lettuce [J]. Carbon, 2011,49(12):3907-3919.
[7] 段伟艳,杜永祥,孟范平,等.氧化石墨烯对双壳类动物文蛤的亚致死毒性研究 [J]. 中国环境科学, 2017,37(7):2755-2764.
[8] Su Y, Yang G Q, Lu K, et al. Colloidal properties and stability of aqueous suspensions of few-layer graphene: Importance of graphene concentration [J] Environmental Pollution, 2017,220: 469-477.
[9] Qiang L W, Chen M, Zhu L Y, et al. Facilitated bioaccumulation of perfluorooctane sulfonate in common carp () by graphene oxide and remission mechanism of fulvic acid [J]. Environmental Science and Technology, 2016,50(21):11627- 11636.
[10] 吕小慧,陈白杨,朱小山.氧化石墨烯的水环境行为及其生物毒性[J]. 中国环境科学, 2016,36(11):3348-3359.
[11] Chowdhury I, Duch M C, Mansukhani N D, et al. Colloidal properties and stability of graphene oxide nanomaterials in the aquatic environment [J]. Environmental Science and Technology, 2013,47(12):6288-6296.
[12] Jiang C J, Castellon B T, Matson C W, et al. Relative contributions of copper oxide nanoparticles and Dissolved copper to cu uptake kinetics of gulf killifish () embryos [J]. Environmental Science and Technology, 2017,51(3):1395- 1404.
[13] Abe T, Kobayashi S, Kobayashi M. Aggregation of colloidal silica particles in the presence of fulvic acid, humic acid, or alginate: Effects of ionic composition [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2011,379(1-3):21-26.
[14] Chong Y, Ge C C, Yang Z X, et al. Reduced cytotoxicity of graphene nanosheets mediated by blood-protein coating [J]. ACS NANO, 2015,9(6):5713-5724.
[15] Chen K L, Elimelech M. Influence of humic acid on the aggregation kinetics of fullerene (C-60) nanoparticles in monovalent and divalent electrolyte solutions [J]. Journal of Colloid and Interface Science, 2007,309(1):126-134.
[16] Saleh N B, Pfefferle L D, Elimelech M. Influence of biomacromolecules and humic acid on the aggregation kinetics of single-walled carbon nanotubes [J]. Environmental Science and Technology, 2010,44(7):2412-2418.
[17] Xia T J, Fortner J D, Zhu D Q. Transport of sulfide-reduced graphene oxide in saturated quartz sand: cation-dependent retention mechanisms [J]. Environmental Science and Technology, 2015,49(19):11468-11475.
[18] 方 华,方若雨,于江华,等.典型碳纳米材料在水中的凝聚特性比较[J]. 中国环境科学, 2016,36(5):1476-1481.
[19] 方 华,孙宇心,于江华,等.腐殖酸对水中多壁碳纳米管凝聚特性的影响[J]. 中国环境科学, 2015,35(5):1410-1415.
[20] Gao Y, Ren X M, Tan X L, et al. Insights into key factors controlling GO stability in natural surface waters [J]. Journal of Hazardous Materials, 2017,335:56-65.
[21] Jiang Y, Raliya R, Liao P, et al. Graphene Oxides in Water: assessing stability as a function of material and natural organic Matter Properties [J]. Environmental Science: Nano, 2017,4(7): 1484-1493.
[22] Johnson W P, Bao G B, John W W, et al. Specific UV absorbance of Aldrich humic acid: Changes during transport in aquifer sediment [J]. Environmental Science and Technology, 2002,36(4): 608-616.
[23] Nam S W, Jung C, Li H, et al. Adsorption characteristics of diclofenac and sulfamethoxazole to graphene oxide in aqueous solution [J]. Chemosphere, 2015,136:20-26.
[24] Miao L Z, Wang C, Hou J, et al. Effect of alginate on the aggregation kinetics of copper oxide nanoparticles (CuO NPs): bridging interaction and hetero-aggregation induced by Ca2+[J]. Environmental Science and Pollution Research, 2016,23(12): 11611-11619.
[25] Wu L, Liu L, Gao B, et al. Aggregation kinetics of graphene oxides in aqueous solutions: Experiments, mechanisms, and modeling [J]. Langmuir, 2013,29(49):15174-15181.
[26] Yang K J, Chen B L, Zhu X Y, et al. Aggregation, adsorption, and morphological transformation of graphene oxide in aqueous solutions containing different metal cations [J]. Environmental Science and Technology, 2016,50(20):11066-11075.
[27] Gudarzi M M. Colloidal stability of graphene oxide: Aggregation in two dimensions [J]. Langmuir, 2016,32(20): 5058-5068.
[28] Jiang Y, Raliya R, Fortner J D, et al. Graphene oxides in water: Correlating morphology and surface chemistry with aggregation behavior [J]. Environmental Science and Technology, 2016, 50(13):6964-6973.
[29] Su Y, Gao B, Mao L. Concurrent agglomeration and straining govern the transport of14C-labeled few-layer graphene in saturated porous media [J]. Water Research, 2017,115:84-93.
[30] Huangfu X L, Jiang J, Ma J, et al. Aggregation kinetics of manganese dioxide colloids in aqueous solution: influence of humic substances and biomacromolecules [J]. Environmental Science and Technology, 2013,47(18):10285-10292.
[31] Lee B M, Seo Y S, Hur J. Investigation of adsorptive fractionation of humic acid on graphene oxide using fluorescence EEM- PARAFAC [J]. Water Research, 2015,73:242-251.
[32] Stankus D P, Lohse S E, Hutchison J E, et al. Interactions between natural organic matter and gold nanoparticles stabilized with different organic capping agents [J]. Environmental Science and Technology, 2011,45(8):3238-3244.
[33] Liu J F, Legros S, Kammer F, et al. Natural Organic Matter Concentration and Hydrochemistry Influence Aggregation Kinetics of Functionalized Engineered Nanoparticles [J]. Environmental Science and Technology, 2013,47(9):4113-4120.
Impacts of natural organic matter and electrolytes on aggregation kinetics of graphene oxide.
SUN Bin-bin, ZHANG Yin-qing, WANG Kun-kun, ZHU Ling-yan*
(Key Laboratory of Pollution Processes and Environmental Criteria of Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300350, China).2018,38(3):985~992
In this study, the impacts of three typical natural organic matters (NOMs: humic acid (HA), fulvic acid (FA) and sodium alginate (SA)) at different concentrations (2 and 5mg/L, total organic carbon, TOC) and electrolyte types (Na+, Mg2+, Ca2+) on the aggregation kinetics of graphene oxide (GO) nanoparticles were investigated through dynamic light scattering. The GO aggregation kinetics without NOM followed the classical Derjaguin-Landau-Verwey-Overbeek (DLVO) model and Schulze-Hardy rule. All the three NOMs at 2mg/L enhanced the stability of GO in the order of HA>FA>SA, which could be due to the strongest steric repulsive force exhibited by HA than FA and SA in the presence of Na+. In the presence of 2mg/L HA, which was selected as the representative NOM, it significantly enhanced the stability of GO in the solutions of Na+and Mg2+; while it displayed marginal influence for Ca2+. When the HA concentration increased to 5mg/L, it did not further enhance the stability of GO in the solution of high concentration Mg2+due to salting out effect of HA; while it depressed GO stability in the solution of Ca2+with higher attachment efficiencies than the control experiment in the absence of any NOM.
graphene oxide (GO);aggregation kinetics;natural organic matter (NOM);divalent cations
X131
A
1000-6923(2018)03-0985-08
孙斌斌(1988-),男,河北沧州人,博士研究生,主要从事纳米材料水环境化学研究.发表论文4篇.
2017-08-15
国家重点基础研究发展计划项目(2014CB932001);国家自然科学基金资助项目(21325730,41501515);天津市自然科学基金资助项目(15JCQNJC08600)
*责任作者, 教授, zhuly@nankai.edu.cn

