高锰酸钾氧化水中沙拉沙星的动力学研究
李 绚,刘志泉,周琪浩,朱世俊,徐勇鹏,2*
高锰酸钾氧化水中沙拉沙星的动力学研究
李 绚1,刘志泉1,周琪浩3,朱世俊1,徐勇鹏1,2*
(1.哈尔滨工业大学环境学院, 黑龙江 哈尔滨 150001;2.哈尔滨工业大学城市水资源开发利用(北方)国家工程研究中心, 黑龙江 哈尔滨 150001;3.中国城市规划设计研究院,北京 100044)
选用高锰酸钾为氧化剂从动力学的角度研究高锰酸钾初始浓度,pH值和温度对沙拉沙星氧化反应速率的影响,并比较高锰酸钾氧化其他氟喹诺酮类药物(恩诺沙星,氧氟沙星,环丙沙星,诺氟沙星)的动力学参数,旨在为沙拉沙星污染治理提供科学依据和建议.研究得出:氧化过程符合二级反应动力学规律,随着高锰酸钾浓度和环境温度的升高,反应速率增加;相对于中性条件和碱性条件[=30~47L/(mol·min)],酸性条件(pH=4~5)下其反应速率[=66~91.28L/(mol·min)]要明显更快.高锰酸钾氧化沙拉沙星的动力学参数与环丙沙星的类似,在相关研究中可以适当参考环丙沙星的处理参数.
沙拉沙星(SAR);氟喹诺酮类抗生素;氧化;高锰酸钾;动力学
沙拉沙星(SAR),化学名称为6-氟-1-(4-氟苯基)-1,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸.沙拉沙星作为新型的高效兽用氟喹诺酮药物,与细菌的结合能力和对细胞膜的通透性较强,抗菌谱范围广,在保持抗革兰氏阴性菌的同时增强了对革兰氏阳性球菌和厌氧菌以及衣原体支原体的抗菌作用[1-2],加之其不良反应少的优点,使得沙拉沙星在很多国家大量使用以控制家禽的早期死亡率和大肠杆菌含量以及水产养殖中富润结核病,弧菌病的治疗[3].目前在国内外水体和污水处理厂中均检出此类抗生素,石家庄汪洋沟河水中检出此类抗生素含量为3.916ng/L[4-6].沙拉沙星会对人体产生三致作用,干扰人的激素功能,使机体易发生感染性疾病,此外还可造成中枢神经系统,循环系统,泌尿系统,呼吸系统的不良反应[7-10].
研究去除氟喹诺酮类抗生素(恩诺沙星,氧氟沙星,环丙沙星,诺氟沙星)的方法有:生物降解,吸附剂吸附,高级氧化法,膜处理,高锰酸钾氧化.其中生物降解去除率为35%左右,主要是依靠生物的吸附而非降解作用[11].常用的吸附剂活性炭,碳纳米管,金属氧化物,蒙脱石等的吸附位点无选择性[12-13],污水中的其他物质会与抗生素产生竞争吸附,降低抗生素的吸附效率.高级氧化作用下产生的中间产物可能具有更强的毒性[14].通过膜过滤只能去除颗粒污染物,而对于抗生素这种溶解性有机污染物去除效果不佳[15],因此需要与其他技术联合,而技术联合使用过程大多比较复杂,能耗也较高.而高锰酸钾去除其他氟喹诺酮类抗生素(恩诺沙星,氧氟沙星,环丙沙星,诺氟沙星)效果显著,在适宜条件下,去除率均可达到90%[18-21],并且其用于水处理具有投资小,使用方便等优点.因此本文选择高锰酸钾为氧化剂,通过研究高锰酸钾初始浓度,pH值和温度对氧化降解反应速率的影响,以及与环丙沙星,恩诺沙星等氟喹诺酮类抗生素的动力学参数的对比,来寻找高锰酸钾氧化沙拉沙星的动力学规律,为沙拉沙星污染水体治理提供科学依据和建议.
1 材料与方法
1.1 实验仪器与设备
磁力搅拌器(红杉实验设备厂);Agilent 1200高效液相色谱仪(美国Agilent公司);THD-0515低温恒温槽(宁波天恒仪器厂);pHS-3C精密pH计(上海雷磁仪器厂);FA1004电子分析天平(上海精密科学仪器有限公司);100ºC温度计(上海楚定仪器有限公司)等.
1.2 化学试剂与溶液的制备
实验所用沙拉沙星为色谱纯(Dr. Ehrenstorfer公司),沙拉沙星储备液由沙拉沙星在超声的环境下溶解于超纯水中(15min),用琥珀色试剂瓶在4℃低温避光情况下保存,浓度为1mmol/L.
实验所用硫代硫酸钠,高锰酸钾,缓冲溶液配置所用硼砂,氢氧化钠,硼酸,磷酸氢二钠,乙酸,乙酸钠均为分析纯;实验用水为去离子水和超纯水.
实验所用缓冲溶液分别通过以下两种物质纯溶液混合得到,且在混合过程中通过pH计检测pH值:pH值为4,5的缓冲溶液由乙酸和乙酸钠混合配制; pH值为6,7,8的缓冲溶液由磷酸氢二钠和磷酸二氢钠混合得到;pH值为9的缓冲溶液由硼酸和硼砂混合配制;pH值为10的缓冲溶液由硼砂和氢氧化钠混合得到.
1.3 实验方法及过程
1.3.1 氧化实验方法 在装有20mmol/L 的缓冲溶液,10μmol/L 的沙拉沙星以及一定浓度的高锰酸钾的琥珀色旋盖小瓶中进行,高锰酸钾浓度分别为250,500,900,1300μmol/L.高锰酸钾加入的同时开启磁力搅拌器,实验过程通过恒温槽控制实验温度为4,21,28,40℃,试验终止时用500mmol/L的Na2S2O3终止实验.样品通过塑料注射器与0.22μm玻璃纤维滤膜过滤后,送入液相色谱检测.
1.3.2 液相实验方法 沙拉沙星用高效液相色谱检测,其条件为:水相采用 0.2%乙酸,有机相采用乙腈,水相和有机相比例为87:13,进样量为20μL,流速1mL/min,温度为30℃,检测波长为275nm.色谱柱Zorbax Extend-C18 (4.6mm× 250mm, 5μm)柱.
1.3.3 实验过程 首先通过标准目标物质储备液配置成1,3,5,7,9,11μmol/L不同浓度的目标溶液,经过高效液相色谱检测得出的响应值绘制成标准曲线.之后的各项试验分别根据标准曲线中的响应值来得出溶液中目标物质的浓度.
1.3.4 质量控制与保证 在分析中,采用仪器空白,实验室试剂空白,实验室空白加标,实验室样品加标,平行样(3个)测定进行质量控制.
2 结果与讨论
2.1 高锰酸钾初始浓度对沙拉沙星氧化降解反应速率的影响
假设只考虑目标物浓度的变化而忽略其中间产物的影响,高锰酸钾氧化降解沙拉沙星的过程可表示为如下形式:
-d[SAR]d=K[Mn(VII)][SAR] (1)
式中:为二级反应速率常数,L/(mol·min);[SAR]为沙拉沙星浓度,mol/L;[Mn(VII)]为高锰酸钾浓度,mol/L.
实验过程中高锰酸钾的初始浓度为沙拉沙星浓度的10倍以上,相对于高锰酸钾的初始浓度,在整个反应过程中高锰酸钾的消耗量相对很小,可以忽略不计,因此高锰酸钾的浓度可视为不变.改变高锰酸钾的初始浓度,分别为250, 500,900, 1300µmol/L,固定沙拉沙星初始浓度为10µmol/L,起始pH值为7.0,反应温度为21℃,研究高锰酸钾不同初始浓度对高锰酸钾氧化降解沙拉沙星效果的影响.由ln(/0)-作图(图1)可以发现, ln(/C)与时间成线性关系.并结合式(2),可以得到图1中直线的斜率为obs(obs为假一级反应速率常数(min-1),obs=K[Mn((VII))].
-d[SAR]d=obs[SAR] (2)
因此可以得出,在高锰酸钾过量的情况下,高锰酸钾氧化沙拉沙星的反应是假一级反应.

图1 不同浓度高锰酸钾氧化降解沙拉沙星的时间进程
[SAR]0=10µmol/L,=21℃,pH =7
将拟合得到的obs(min-1)与KMnO4浓度进行拟合,结果如图2所示.可以看出,随着高锰酸钾浓度从250µmol/L增加到1300µmol/L,假一级反应速率常数obs从0.0088min-1增加到了0.0383min-1,高锰酸钾初始浓度和假一级反应速率常数存在线性关系,拟合结果为:
obs=0.0288[Mn(VII)]+1.432 (3)
从式3可以得到obs随着高锰酸钾浓度的提高而线性增加,这说明高锰酸钾与沙拉沙星反应符合二级动力学模型,KMnO4氧化降解SAR的二级反应速率常数为28.8L/(mol·min).
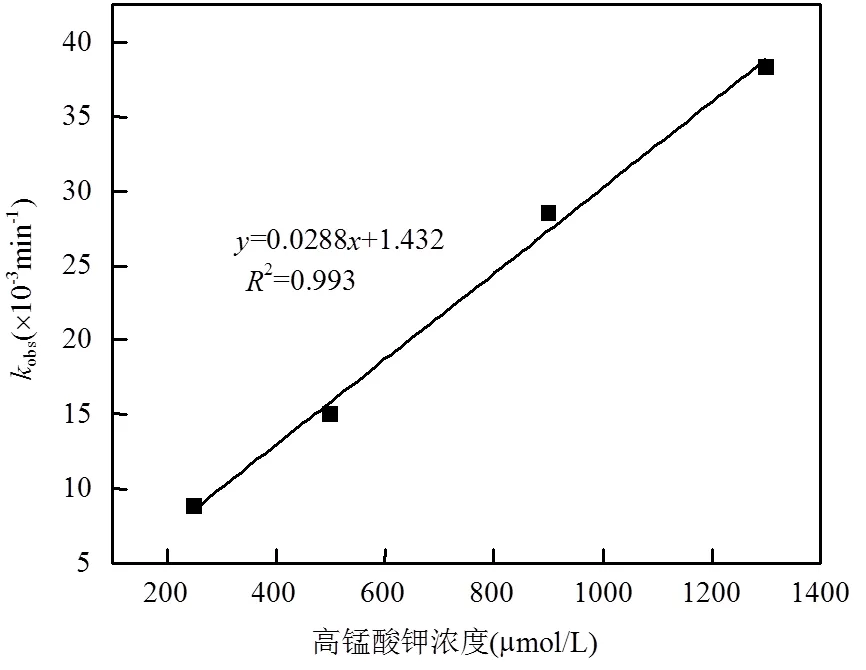
图2 高锰酸钾浓度与假一级反应动力学常数Kobs的关系
[SAR]0=10µmol/L,=21℃,pH =7
2.2 pH值对沙拉沙星氧化降解反应速率的影响
在反应温度为21℃,高锰酸钾初始浓度为250µmol/L,SAR初始浓度为10µmol/L的条件下,用相应的缓冲溶液控制反应体系的pH值在4,5,6,7,8,9,10,研究溶液pH值对反应速率的影响规律,结果如图3所示.
pH值是影响反应速率的一个重要因素,在pH=4时反应速率常数达到最大值,为91.28L/ (mol·min); pH值为4~7时,反应速率常数随着pH值的增大而减小,在pH=7时达到最小值,为30L/(mol·min);碱性条件下,随着pH值的增大,反应速率略有上升.
目前,pH值对高锰酸钾氧化沙拉沙星的影响机理还没有合理的解释,本文推测这主要是因为在不同的pH值条件下,体系中的沙拉沙星迁移和转化方式不同[16];另一方面,高锰酸钾的氧化性和氧化还原电位也受到pH值的影响,致使其氧化机理不同而得到不同的反应产物,酸性条件下高锰酸钾氧化反应中产生的MnO2会发生自催化反应,所以会加快此氧化反应的速率[17].

图3 pH与二级反应速率常数的关系
[SAR]0=10µmol/L,=21℃, [Mn( VII)]0=250µmol/L
2.3 温度对沙拉沙星氧化动力学的影响
图4给出了在反应体系pH值为7,高锰酸钾初始浓度为250µmol/L,SAR初始浓度为10µmol/L的条件下,KMnO4氧化降解SAR的二级反应速率常数[L/(mol·min)]与反应温度的关系.可以看出温度与呈指数关系.这是因为温度的升高降低了化学反应能垒,同时分子的平均动能增加,活化分子的数目及其碰撞次数增多,因而反应速率增加[19].

图4 温度与二级反应速率常数的关系
[SAR]0=10µmol/L, pH=7, [Mn(VII)]0=250µmol/L
为找出高锰酸钾氧化沙拉沙星的反应活化能,根据Arrhenius方程式,高锰酸钾去除SAR反应的活化能可通过下式计算:
ln=ln-Ea/R(4)
式中:a为反应的活化能;为频率因子(阿伦尼乌斯常数,单位与相同);为热力学温度,K;R 为气体通用常数, 8.314J/(mol·K).
根据由Arrhenius方程式拟合的曲线(见图5)可以得到高锰酸钾氧化沙拉沙星的反应活化能为:45.33kJ/mol,a<120kJ/mol,反应比较容易发生,反应的速率也较快[22].

图5 高锰酸钾氧化沙拉沙星的阿伦尼乌斯拟合
[SAR]0=10µmol/L, [Mn( VII)]0=250µmol/L, pH=7
2.4 高锰酸钾氧化氟喹诺酮类抗生素的动力学参数对比分析
为了进一步探究高锰酸钾氧化沙拉沙星的动力学规律与其他氟喹诺酮类抗生素的相似程度,综合其他研究[21-24]成果,分别从pH值和温度两因素出发进行参数对比分析.
2.4.1 pH值对氟喹诺酮类抗生素氧化动力学参数的影响对比 控制反应温度,高锰酸钾和沙拉沙星,恩诺沙星,氧氟沙星,环丙沙星,诺氟沙星的初始浓度不变,通过缓冲溶液控制反应pH值在所需值,得到不同pH值下高锰酸钾氧化降解5种抗生素的反应速率曲线,如图6显示.水环境pH值的变化对高锰酸钾氧化氧氟沙星影响最大,而其余4种抗生素受pH的变化影响相对较小.
从图6中可以看出当pH=7时,高锰酸钾氧化这5类抗生素的反应速率常数在12~68L/(mol·min)范围内,其中高锰酸钾氧化氧氟沙星速率最大,恩诺沙星,环丙沙星,沙拉沙星的反应速率相差不大,诺氟沙星最小.由于实际水体的pH值大多呈中性,因此在实际水处理中,用高锰酸钾为氧化剂时,沙拉沙星与环丙沙星的反应速率较为接近.

图6 不同pH值下高锰酸钾氧化氟喹诺酮类抗生素的反应速率对比
抗生素浓度为10µmol/L, [Mn( VII)]0=250µmol/L,=21℃
2.4.2 温度对氟喹诺酮类抗生素氧化动力学参数的影响对比 图7给出了不同反应温度(4,21,28, 40℃)条件下高锰酸钾氧化降解氟喹诺酮类抗生素的反应速率曲线,从图中曲线趋势我们可以发现,温度对高锰酸钾氧化恩诺沙星,环丙沙星影响最大,对氧氟沙星,沙拉沙星氧化反应的影响较小,而对高锰酸钾氧化诺氟沙星反应影响最小.
研究[28-21]表明高锰酸钾去除恩诺沙星的反应活化能a为53.27kJ/mol;高锰酸钾去除环丙沙星的反应活化能a为44.93kJ/mol;氧化去除氧氟沙星的反应活化能为30.46kJ/mol;高锰酸钾去除诺氟沙星的反应活化能a为27.2kJ/mol.本实验研究得出高锰酸钾氧化降解沙拉沙星的反应活化能a为45.33kJ/mol.由此可以得出高锰酸钾氧化降解沙拉沙星所需反应活化能与高锰酸钾氧化降解环丙沙星所需活化能相差较小.

图7 不同温度下高锰酸钾氧化氟喹诺酮类抗生素的反应速率对比
抗生素浓度为10µmol/L, [Mn(VII)]0=250µmol/L, pH=7
通过表1中沙拉沙星和环丙沙星结构的对比,可以发现,两者结构的不同在于喹诺酮环上N1位置连接的是苯环还是环丙基.结合以上分析对比可以发现,两者结构上的差别并未对反应速率和反应活化能产生显著的差异影响.因此可以推测,在反应条件(pH值和温度)方面,两者的最适条件会比较相似.

表1 沙拉沙星,环丙沙星的理化性质
3 结论
3.1 高锰酸钾初始浓度对氧化反应速率有明显影响,随着高锰酸钾浓度的增大,氧化反应速率增快,高锰酸钾氧化沙拉沙星的反应对沙拉沙星和高锰酸钾均符合一级反应动力学模型,整体符合二级反应动力学模型,二级反应速率常数为28.8L/(mol·min).
3.2 在反应温度大于21℃时,在一定的反应时间内,高锰酸钾氧化去除沙拉沙星的去除率可以达到90%,根据Arrhenius模型求出沙拉沙星活化能为45.33kJ/mol.
3.3 反应体系pH值对沙拉沙星氧化去除效率的影响为:在pH=4~5酸性条件下去除速率最快,在中性条件下速率最低,在碱性条件下缓慢增高.
3.4 高锰酸钾氧化沙拉沙星的动力学参数与高锰酸钾氧化降解环丙沙星的动力学参数较为接近.
[1] 韦锦萍,杨 琳,于 飞.氟喹诺酮类药物进展及其分析方法 [J]. 有机氟工业, 2012,(4):47-51.
[2] 刘 娜.磺胺类及氟喹诺酮类药物兔单克隆抗体的制备与多残留检测技术研究 [D]. 杭州:浙江大学, 2013.
[3] Tyrpenou A E, Iossifidou E G, Psomas I E, et al. Tissue distribution and depletion of sarafloxacin hydrochloride after in feed administration in gilthead seabream (, L.) [J]. Aquaculture, 2003,215(1–4):291-300.
[4] Ma Y P, Miao L, Wu M M, et al. Occurrences and regional distributions of 20antibiotics in water bodies during groundwater recharge [J]. Science of the Total Environment, 2015,518-519C: 498-506.
[5] Bhandari A, Close L, Kim W. Occurrence of ciprofloxacin, sulfamethoxazole, and azithromycin in municipal wastewater treatment plants [J]. Practice Periodical of Hazardous Toxic & Radioactive Waste Management, 2008,12(4):275-281.
[6] 席北斗,卢 义,许其功.一种同时检测水体中氧氟沙星和沙拉沙星的方法:中国, CN103344732A [P]. 2013.
[7] Cao Z. Potential toxicity of sarafloxacin to catalase: spectroscopic, ITC and molecular docking descriptions [J]. Spectrochimica Acta Part A Molecular & Spectroscopy Biomolecular, 2013,115(11): 457-463.
[8] 宋艳岭.氟喹诺酮类兽药-钴离子配位印迹聚合物的识别特性及应用研究 [D]. 河北:河北大学, 2010.
[9] 夏清海.氟喹诺酮类抗生素分析新方法及其应用的研究[D]. 昆明:昆明理工大学, 2014.
[10] 米铁军.动物性食品中喹诺酮类药物残留的荧光偏振免疫分析研究 [D]. 北京:中国农业大学, 2013.
[11] Bing,Li. Biodegradation and adsorption of antibiotics in the activated sludge process[J]. Environmental Science & Technology, 2010,44(9):3468-73.
[12] Wang Y F, Zhu J X, Huang H O, et al. Carbon nanotube composite membranes for microfiltration of pharmaceuticals and personal care products: Capabilities and potential mechanisms[J]. Journal of Membrane Science, 2015,479:165-174.
[13] Cho Hyun-Hee, Huang Haiou, Schwab Kellogg. Effects of solution chemistry on the adsorption of ibuprofen and triclosan onto carbon nanotubes[J]. Langmuir the ACS Journal of Surfaces and Colloids, 2011,27(21):12960-12967.
[14] Yargeau Viviane, Huot Jennifer Caitlin, Rodayan Angela, et al. Im- pact of degradation products of sulfamethoxazole on mammalian cultured cells[J]. Environmental Toxicology, 2008, 23(4):492-498.
[15] Song W.Free-radical-induced oxidative and reductive degradation of N,N'-diethyl-m-toluamide (DEET): Kinetic studies and degradation pathway[J]. Water Research, 2009, 43(3):635-42.
[16] Rubert Kennedy F, Pedersen Joel A. Kinetics of oxytetracycline reaction with a hydrous manganese oxide[J]. Environmental Science & Technology, 2006,40(23):7216-7221.
[17] 梅丽芸.食品中氟喹诺酮类抗生素酶联免疫吸附分析法及苯乙醇胺A免疫亲和色谱法的研究[D]. 苏州:苏州大学, 2014.
[18] 徐勇鹏,赵丽伟,王在刚.高锰酸钾氧化水中恩诺沙星的动力学研究[J]. 哈尔滨工业大学学报, 2013,45(4):44-47.
[19] 赵丽伟.高锰酸盐降解水中恩诺沙星和环丙沙星的应用基础研究 [D]. 哈尔滨:哈尔滨工业大学,2012.
[20] 万晓辉.高锰酸钾氧化氟喹诺酮类抗生素的动力学和反应历程研究 [D].哈尔滨:哈尔滨工业大学,2012.
[21] XU Y P, LIU S Y, GUO F, et al. Oxidation of Enrofloxacin with Permanganate: Kinetics, Multivariate Effects, Identification of Oxidation Products, and Determination of Residual Antibacterial Activity[J]. Journal of Chemistry, 2015,2015:1-8.
[22] 高鸿宾.实用有机化学辞典[M]. 北京:高等教育出版社, 1997: 196-199.
致谢:感谢徐勇鹏老师,刘志泉老师在实验过程中的指导和帮助.
Kinetics study on sarafloxacin oxidization by permanganate in aqueous environment.
LI Xuan1, LIU Zhi-quan1, ZHOU Qi-hao3, ZHU Shi-jun1, XU Yong-peng1,2*
(1.National Engineer Research Center of Urban Water Resources, Harbin Institute of Technology, Harbin 150090, China;2.School of Environment, Harbin Institute of Technology, Harbin 150090, China;3.China Academy of Urban Planning & Design, Beijing 100044, China)., 2018,38(3):917~922
By evaluating the effects of initial concentration of KMnO4, pH and temperature, experimental studies of sarafloxacin oxidation kinetics by potassium permanganate were investigated. Meanwhile, the kinetics parameters of other fluoroquinolones (e.g. enrofloxacin, ofloxacin, ciprofloxacin, norfloxacin)were compared with those of sarafloxacin, thus providing a feasible approach for degradation and removal of sarafloxacin in the aquatic environment. The results indicated that the kinetic rate of sarafloxacin oxidizationby potassium permanganate in the aqueous solution followed the second-order kinetics model. An increase in the initial KMnO4concentration or temperature corresponded to an increase in the reaction rate. Furthermore, the reaction rate [=66~91.28L/(mol·min)] under acidic conditions (pH=4~5) was obviously higher than that [=30~47L/(mol·min)] under the neutral and alkaline conditions. The kinetic parameters of sarafloxacin were similar to those of ciprofloxacin, which could be validated for the determination of relevant parameters of sarafloxacin.
sarafloxacin (SAR);fluoroquinolones;oxidation;potassium permanganate;kinetics
TU991.2
A
1000-6923(2018)03-0917-06
李 绚(1992-),女,河北石家庄人,硕士研究生,主要从事抗生素动力学的研究.
2017-08-16
国家水体污染控制与治理科技重大专项(2014ZX07405002)
* 责任作者, 教授, xuyongpeng@hit.edu.cn

