低浓度甲缩醛水溶液-萃取剂液液相平衡数据的测定与关联
时米东,王利平,何高银,于雪敏,李青松
(中国石油大学(华东)化学工程学院重质油国家重点实验室,山东青岛 266580)
甲缩醛是一种重要的溶剂和化工原料[1-5],可由甲醇与甲醛之间的羟醛缩合得到[6-8]。在上述反应系统中,水是反应的副产物。在酸性水溶液中,甲缩醛不稳定,容易发生分解[3,6],分解反应方程式如式(1)所示。
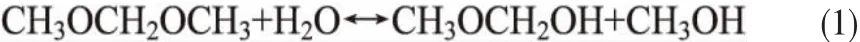
在化学工业中,精馏是一种常用的分离方法,而精馏法分离酸性甲缩醛水溶液,容易强化甲缩醛的分解[2,6]。因此,为获得更高的甲缩醛产物,需要先将水除去。
液液萃取法是一种可取的分离方法。在以前的研究中,课题组选用了环己烷和正庚烷为萃取剂分离甲缩醛水溶液[7]。为了研究更多萃取剂萃取分离甲缩醛水溶液的能力,测定了水-甲缩醛-对二甲苯和水-甲缩醛-甲苯体系在30℃、40℃和大气压力下的液液相平衡数据。因为在20℃下,甲缩醛在水中的溶解度为32%,所以实验中甲缩醛水溶液的甲缩醛浓度均低于这个值。根据测定的液液相平衡数据,估算出了甲缩醛的分配系数和萃取剂的选择性因子,并以此对萃取剂的萃取能力进行了评价。另外,采用NRTL[8]和UNIQUAC[9]热力学模型对数据进行了关联。
1 实验部分
1.1 实验药品
甲缩醛,w>99.00%,上海阿拉丁生化科技股份有限公司;甲苯,w≥99.50%,国药集团化学试剂有限公司;对二甲苯,w>99.00%,天津科密欧化学试剂有限公司;水经过两次蒸馏得到。
1.2 实验步骤
测定了水-甲缩醛-对二甲苯和水-甲缩醛-甲苯体系在30℃、40℃和大气压力下的液液相平衡数据。实验过程如下:
首先将一定浓度的三元混合物加入到一个50mL的相平衡釜中;恒温水浴维持相平衡釜中混合物的温度稳定;用不确定度为0.1℃的温度计测定混合物体系的温度;剧烈搅拌混合物2.0h后,静置4.0h左右,以便物料达到相平衡;待达到相平衡之后,用Agilent GC6820气相色谱测定相平衡釜中上下层相的组成。气相色谱安装有TCD检测器和Porapak N 色谱柱(3mm×3m),色谱条件为:载气流速60mL/min、进样室和检测器的温度分别为250℃、色谱柱温度为120~250℃。在上述的测定条件下,每一相样品测定三次,并取其平均值为相组成。通过改变混合物中甲缩醛的量改变混合物体系的组成,测定一系列的液液相平衡数据。
2 结果与讨论
2.1 实验数据
水-甲缩醛-对二甲苯和水-甲缩醛-甲苯体系在30℃、40℃和大气压力下时的液液相平衡数据如表1和表2所示。每一相的组成用物质的量分数表示。从两个表格的数据可以看出,随着体系中甲缩醛浓度的增大,有机相中甲缩醛的物质的量分数快速增大,而水的物质的量分数增大缓慢;在水相中对二甲苯和甲苯的物质的量分数分别小于0.0010和0.0050,说明甲缩醛在对二甲苯和甲苯中具有较好的溶解性,而对二甲苯和甲苯在水中的溶解度却极低。因此将它们作为萃取剂萃取甲缩醛水溶液时,绝大部分的萃取剂可以循环利用。

表1 在30℃、40℃和100 kPa下,水(1)-甲缩醛(2)-对二甲苯(3)体系的液液相平衡数据a
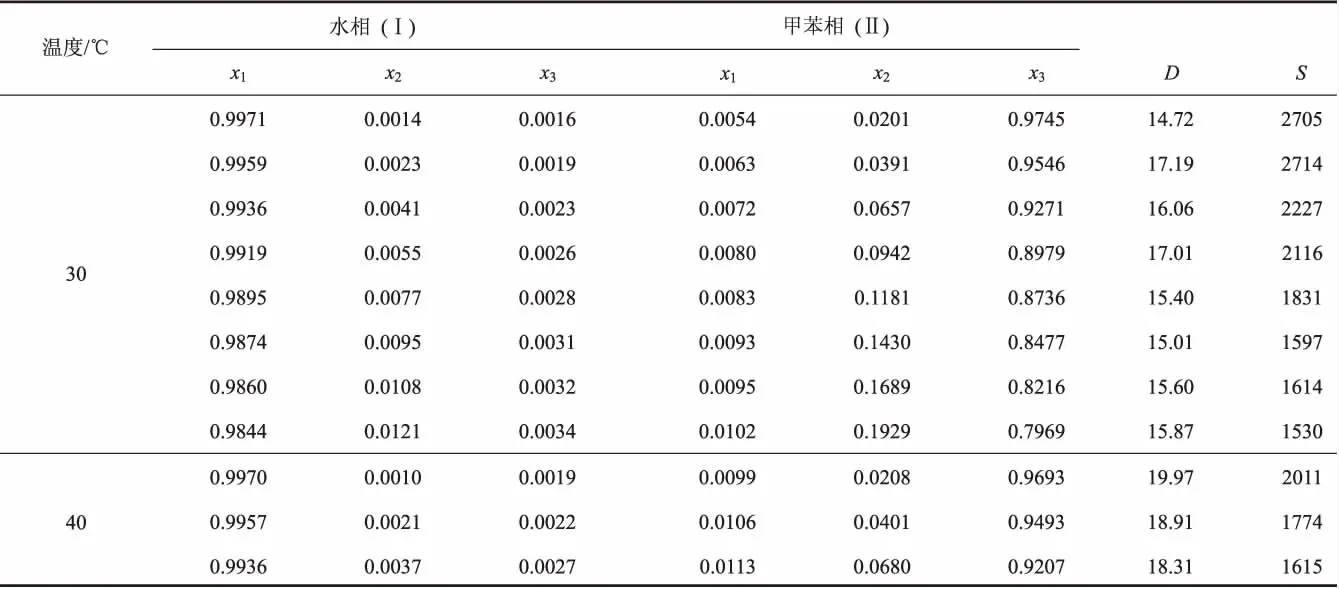
表2 在30℃、40℃和100kPa下,水(1)-甲缩醛(2)-甲苯(3)体系的液液相平衡数据a
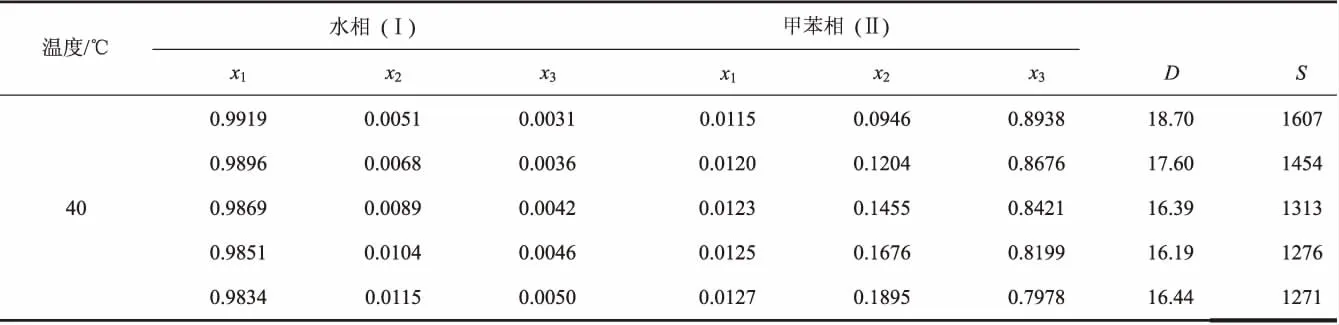
续(表2)
2.2 液液相平衡体系的三元相图
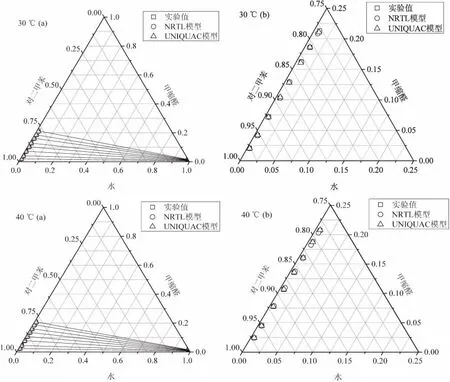
图1 水-甲缩醛-对二甲苯体系在30℃和40℃时的三元相图

图2 水-甲缩醛-甲苯体系在30℃和40℃时的三元相图
水-甲缩醛-对二甲苯和甲苯体系的三元相图如图1和图2所示。由两个体系的相图可以看出,每一相图中右下角(水相组成)相点几乎汇聚成一点,且靠近纯水组成点,说明萃取剂和甲缩醛在水中的浓度非常低;相图左下角(有机相组成)相点贴近萃取剂组成线,且随着体系中甲缩醛浓度的增加,相点向萃取剂零组成点移动,说明体系中增加的甲缩醛主要向萃取剂相转移。比较同一体系在两个温度下的相图发现,非共溶区没有明显变化,表明温度对两个体系的非共溶区的影响可以忽略。比较两个体系的三元相图,发现两体系的非共溶区没有明显变化,说明对二甲苯、甲苯对甲缩醛具有一致的萃取能力。
2.3 萃取能力评价
为了评价对二甲苯和甲苯对甲缩醛的萃取能力,根据实验数据估算了甲缩醛的分配系数和萃取剂的分离因子。计算公式[10-12]如式(2)、(3)所示。

式中:x2Ⅱ和x1Ⅱ分别是有机相中甲缩醛和水的物质的量分数;x2Ⅰ和x1Ⅰ分别是水相中甲缩醛和水的物质的量分数。
分配系数和分离因子的估算结果如表1和表2所示。它们随有机相中甲缩醛浓度的变化关系如图3和图4所示。从图3可以看出,随着有机相中甲缩醛浓度的增加,甲缩醛的分配系数有降低的趋势。比较两个温度下的分配系数,发现两体系40℃的分配系数略高于30℃的。比较同一温度下两个体系的分配系数发现,甲苯为萃取剂时,甲缩醛的分配系数略高。说明甲苯对甲缩醛具有更强的萃取能力。图4中分离因子随着有机相中甲缩醛浓度的提高也有降低趋势。对于水-甲缩醛-对二甲苯体系,40℃时的选择性因子略大,而水-甲缩醛-甲苯体系,30℃时的选择性因子略大。比较两个体系的选择性因子,对二甲苯体系的选择性因子略大,因此从选择性看,对二甲苯的萃取能力更好。综上可知,对二甲苯和甲苯对甲缩醛均具有优异的萃取能力。
2.4 液液相平衡数据的可靠性
水-甲缩醛-对二甲苯和甲苯体系实验数据的可靠性由 Othmer-Tobias[13](式(4))和 Hand[14](式(5))方程验证。
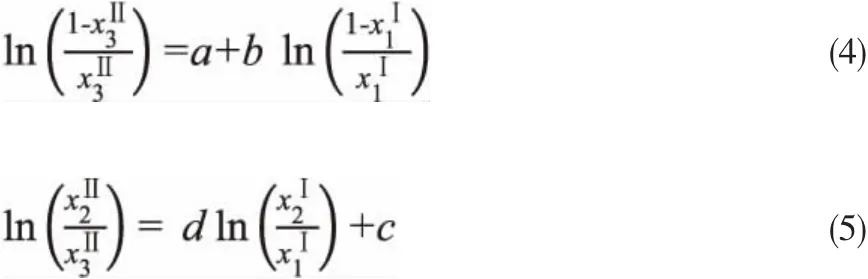

图3 水-甲缩醛-对二甲苯和甲苯体系中甲缩醛的分配系数
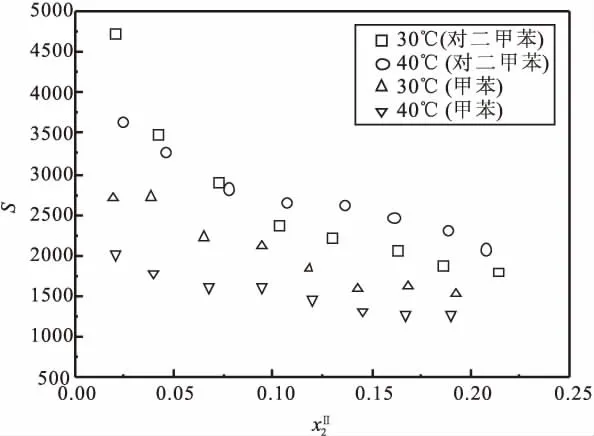
图4 水-甲缩醛-对二甲苯和甲苯体系中萃取剂的选择性因子
式中:x2Ⅱ、x3Ⅱ分别是有机相中甲缩醛和萃取剂的物质的量分数;x2Ⅰ、x1Ⅰ分别是水相中甲缩醛和水的物质的量分数;a、b、c、d是方程常数。上述两个方程的线性关系分别如图5和图6所示,线性相关度(R2)和方程常数的值如表3所示。从表3可以看出,在30℃和 40℃下,Othmer-Tobias和 Hand方程的线性相关度均在0.99以上,说明液液相平衡数据具有较高的可靠性。

表3 两体系在30℃和40℃时Othmer-Tobias和Hand方程的常数和线性相关性
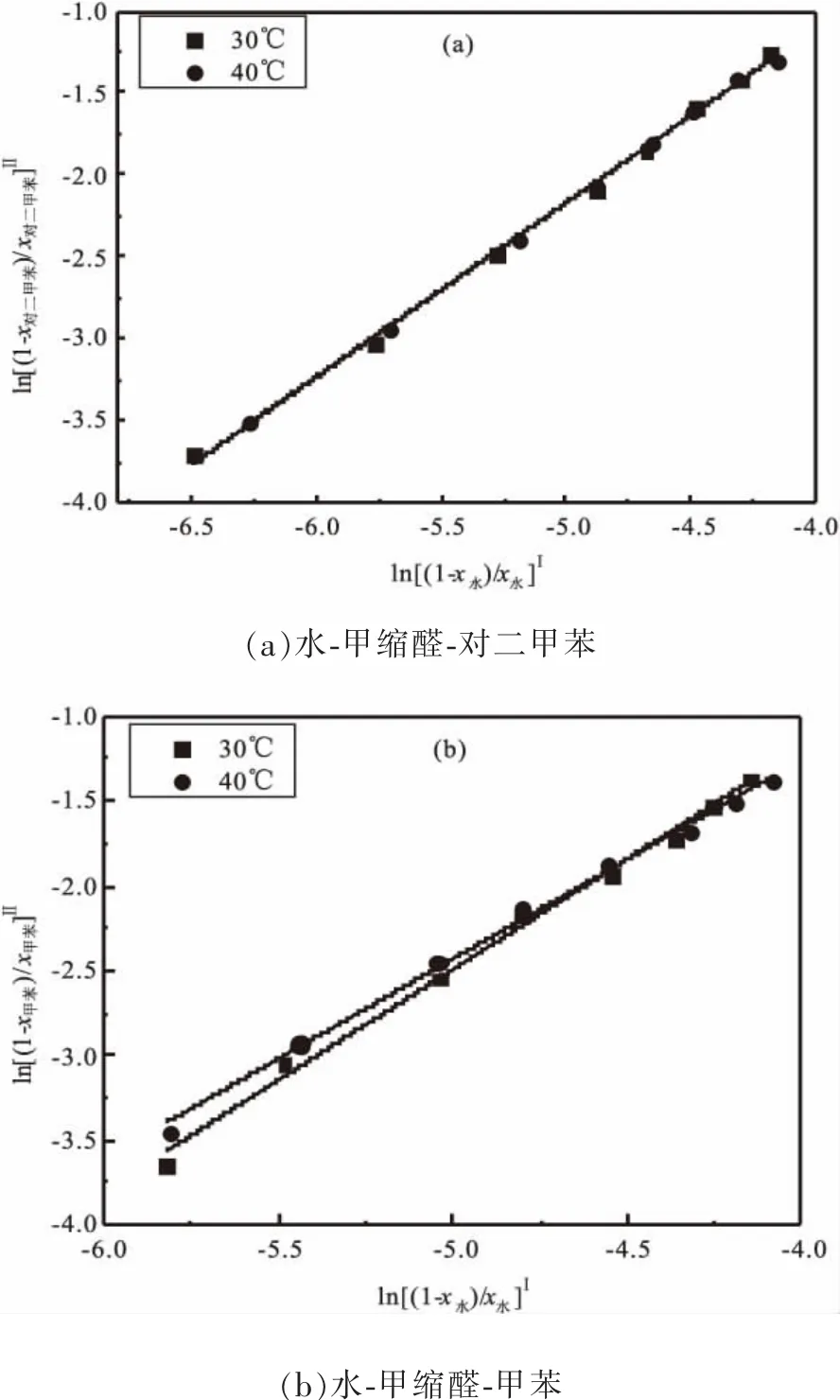
图5 三元体系的Othmer-Tobias方程曲线

图6 三元体系的Hand方程曲线
3 数据回归
水-甲缩醛-对二甲苯和甲苯两个体系的液液相平衡数据由NRTL和UNIQUAC模型关联。

表4 UNIQUAC模型结构参数
UNIQUAC模型中所需的纯组分的结构参数r和q如表4所示。NRTL模型的非随机性参数取值为0.2和0.3,如表5和表6所示。模型中二元交互能量参数可以通过最小化目标函数(OF)[15]获得,目标函数如式(6)所示。实验和估算数据的一致性可由均方根偏差(RMSD)评估,均方根偏差公式[16]如式(7)所示。

式中:M表示连接线数;x是组分的实验值; 是组分的估算值;下标i、j和k分别表示组分数、相数和连接线数。
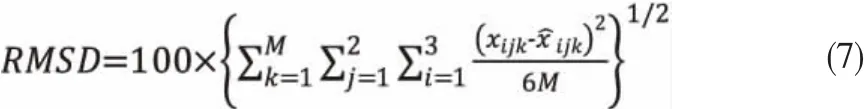

表5 水-甲缩醛-对二甲苯体系的模型二元能量参数

表6 水-甲缩醛-甲苯体系的模型二元能量参数
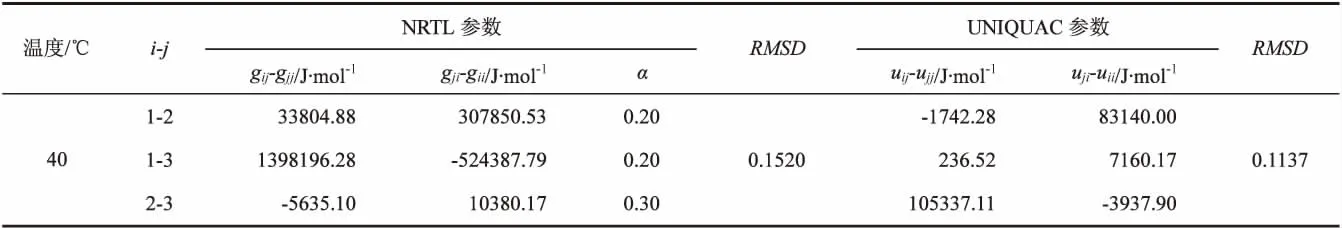
续(表6)
液液相平衡数据由NRTL和UNIQUAC模型进行关联,并获得了两个模型的二元交互能量参数,关联结果如表5和表6所示。两模型估算值同样显示在图1和图2中,可以看出,两模型估算值与实验值均具有良好的一致性。对于NRTL模型,40℃时的RMSD略低,说明该模型在此温度下估算值更精确;UNIQUAC模型却在30℃时估算更精确。比较两个模型关联结果发现,UNIQUAC模型关联结果计算得到的RMSD值略低,说明对于所研究的体系该模型比NRTL模型具有更高的精确度。
4 结论
在30℃和40℃及大气压力下,测定了水-甲缩醛-对二甲苯和水-甲缩醛-甲苯体系的液液相平衡数据。实验结果表明,对二甲苯和甲苯对甲缩醛均表现出优异的萃取能力。采用Othmer-Tobias和Hand方程对数据的可靠性分析发现,实验数据具有良好的可靠性。采用NRTL和UNIQUAC模型对实验数据进行关联,关联结果显示出良好的一致性,且UNIQUAC模型具有更高的精确性。此实验测定的液液相平衡数据可以为萃取分离甲缩醛水溶液提供基础数据参考。
[1] LojewskaJ,Wasilewski J,T relak K,et al.Selective oxidation ofmethylalasanew catalytic route to concentrated formaldehyde:Reaction kinetic profile in gradientless flow reactor [J].Catal Commun,2008,9:1833-1837.
[2] Zheng Y Y,Tang Q,Wang T F,et al.Kinetics of synthesisofpolyoxymethylene dimethylethersfrom paraformaldehyde and dimethoxymethane catalyzed by ion-exchange resin[J].Chem Eng Sci,2015,134:758-766.
[3] Burger J,Strǒfer E,Hasse H.Chemical equilibrium and reaction kinetics of the heterogeneously catalyzed formation of poly(oxymethylene)dimethyl ethers from methylal and trioxane[J].Ind Eng Chem Res,2012,51:12751-12761.
[4] Wu Q,Wang M,Hao Y.Synthesis of polyoxymethylenedimethyl ethers catalyzed by bronsted acid ionic liquids with alkanesulfonicacid groups[J].Ind Eng Chem Res,2014,53:16254-16260.
[5] Burger J,Siegert M,Ströfer E,et al.Poly(oxymethylene)dimethyl ethers as components of tailored diesel fuel:Properties,synthesis and purification concepts[J].Fuel,2010,89:3315-3319.
[6] Zhang J Q,Fang D Y,Liu D H.Evaluation of Zr-alumina in production of polyoxymethylened imethyl ethers from methanoland formaldehyde:Performance testsand kinetic investigations[J].Ind Eng Chem Res,2014,53:13589-13597.
[7] Shi M D,He G Y,Gan F,et al.Extraction of low concentration aqueous solution of methylal:Liquid-liquid equilibrium in water+methylal+(cyclohexane and nheptane)ternary systems[J].J Chem Eng Data,2017,62:2183-2190.
[8] Renon H,PrausnitzJM.Localcompositionsin thermodynamic excess functions for liquid mixtures[J].AIChE J,1968,14:135-144.
[9] Abrams D S,Prausnitz J M.Distribution of phenolic solutes between water and non-polar organic solvents[J].AIChE J,1975,7:61-72.
[10] Doman′ska U,Walczak K.Ternary liquid-liquid equilibria for mixtures of{ionic liquid+thiophene or benzothiophene+heptane}at T=308.15 K [J].J Solution Chem,2015,44:382-394.
[11] Cai F F,Xiao G M.Liquid–liquid equilibria for ternary systems ethanol+ heptane+phosphoric-based ionic liquids[J].Fluid Phase Equilib,2015,386:155-161.
[12] Hekayati J,Roosta A,Javanmardi J.Liquid-liquid equilibria in the quinary aqueous two-phase system of poly(ethylene glycol)6000+sodium sulfate+water in the presence ofglucose and ethanol:Experimental investigation and thermodynamic modeling[J].Thermochimica Acta,2016,625:47-52.
[13] Othmer D F,Tobias P E.Liquid-liquid extraction data-The line correlation [J].Ind Eng Chem,1942,34:693-696.
[14] Hand D B.Dineric distribution[J].J Phys Chem,1929,34:1961-2000.
[15] Zafarani-Moattar M T,Shekaari H,Jafari P,et al.The effect of temperature and molar mass on the (liquid+liquid)equilibria of(poly ethylene glycol dimethyl ether+di-sodium hydrogen citrate+water)systems:Experimental and correlation[J].J Chem Thermodynamics,2015,91:435-444.
[16] Cháfer A,Torre J D L,Lladosa E,et al.Study of liquidliquid equilibria at different temperatures of water+ethanol+1-butyl-1-methylpyrrolidinium bis(trifluoromethylsulfonyl)imide ternary system[J].Fluid Phase Equilib,2016,426:3-9.

