甲基营养型芽孢杆菌BH21对葡萄灰霉病菌的拮抗作用
魏新燕,黄媛媛,黄亚丽,杜克久
甲基营养型芽孢杆菌BH21对葡萄灰霉病菌的拮抗作用
魏新燕1,黄媛媛2,黄亚丽2,杜克久1
(1河北农业大学林学院/国家北方山区农业工程技术研究中心,河北保定 071001;2河北省科学院生物研究所,石家庄 050051)
【目的】甲基营养型芽孢杆菌()BH21是一株对葡萄灰霉病菌()有较好拮抗作用的海洋源细菌,鉴定该菌株脂肽类抗菌物质合成基因,检测脂肽粗提物对葡萄灰霉病菌的拮抗作用,为应用该菌株防治葡萄灰霉病提供科学依据。【方法】通过特异引物的基因组PCR法检测甲基营养型芽孢杆菌BH21菌株合成脂肽的能力;盐酸沉淀和甲醇抽提法从无菌发酵液中提取脂肽粗提物;排油圈法检测脂肽粗提物的表面活性;采用菌丝生长速率法检测脂肽粗提物对灰霉病菌菌丝生长的抑制作用并计算有效中浓度EC50;利用高效液相色谱技术(HPLC)对脂肽粗提物洗脱分离,并采用菌丝生长速率法检测各组分对葡萄灰霉病菌的抑制能力;采用反相高效液相色谱(RP-HPLC)分析主要抑菌成分的脂肽类型。采用离体叶片接种法检测脂肽粗提物对葡萄灰霉病的防治效果。【结果】选取11对特异引物对菌株BH21基因组扩增,其中7对引物扩增出预期核酸片段;扩增产物经测序、BLAST比对分析,结果显示扩增产物与相关菌株脂肽基因相似度为96%—99%,扩增产物翻译的蛋白与相关菌株的脂肽合成蛋白相似度为96%—100%,表明甲基营养型芽孢杆菌BH21基因组中含有、、、,该菌株具有合成surfactin、iturin及fengycin等多种脂肽类抗菌物质的能力。盐酸沉淀和甲醇抽提从LB无菌发酵液中获得脂肽粗提物,得率为428 mg·L-1。排油圈检测结果显示,脂肽粗提物使橄榄油膜形成排油圈,表明脂肽粗提物具有表面活性。脂肽粗提物对葡萄灰霉病菌菌丝生长具有显著的抑制作用,脂肽粗提物浓度为440 μg·mL-1时,对葡萄灰霉病菌菌丝生长的相对抑制率为82.8%。根据毒力方程计算,抑制葡萄灰霉病菌菌丝生长的脂肽粗提物EC50为144.39 μg·mL-1。HPLC分离纯化脂肽粗提物获得6个组分,只有组分BH21-2和BH21-3抑制葡萄灰霉病菌的生长,RP-HPLC色谱图分析表明组分BH21-2和BH21-3属于fengycin家族脂肽。葡萄灰霉病离体叶片试验结果表明,脂肽粗提物浓度为400 μg·mL-1时,对葡萄叶片灰霉病防病效果为100%;脂肽粗提物浓度为220 μg·mL-1时,对葡萄叶片病斑扩展相对抑制率为94.4%。【结论】甲基营养型芽孢杆菌菌株BH21具有合成surfactin、iturin及fengycin等多种脂肽类抗菌物质的基因,该菌株脂肽粗提物对葡萄灰霉病菌具有较强的拮抗作用,在葡萄灰霉病生物防治中具有应用潜力。
甲基营养型芽孢杆菌;葡萄灰霉病菌;抗真菌活性;脂肽;葡萄灰霉病
0 引言
【研究意义】葡萄灰霉病是由灰葡萄孢()引起的真菌病害,不仅在生长期危害,也是葡萄采后重要病害之一[1]。随着化学农药的长期、大量使用,其防控效果因葡萄灰霉病菌产生抗药性而降低,积极开发微生物农药具有实际应用价值[1-2]。甲基营养型芽孢杆菌()是芽孢杆菌属的一个新成员[3],是植物根际促生菌,也是植物病害生物防治中重要组成部分[4-6]。甲基营养型芽孢杆菌BH21分离自沧州渤海海域,前期研究表明该菌株的无菌发酵液对葡萄灰霉病菌有较强的抑制作用(另文发表),明确其抑菌活性物质对该菌在灰霉病生物防治上的应用具有重要意义。【前人研究进展】伏波等[7]研究表明,小麦内生细菌枯草芽孢杆菌()Em7对葡萄灰霉病菌有良好的抑制作用,离体果实相对防治效果为78.92%;周泠璇等[8]从红提葡萄中分离得到5株对葡萄灰霉病菌有较好拮抗作用的内生菌,其中内生菌枯草芽孢杆菌NR4-1对葡萄灰霉病菌抑菌效果最强,抑菌率为68.7%;Ge等[9]从长白山休眠火山土壤中分离到一株甲基营养型芽孢杆菌NKG-1,其不仅对番茄幼苗灰霉病具有60%的防治效果,且对番茄植株具有促生作用。芽孢杆菌产生多种抗菌化合物,其中环脂肽(LPs)是一类具有表面活性剂特性的抗菌物质,主要包括伊枯草菌素(iturin)、丰原素(fengycin)和表面活性素(surfactin)等3大类,具有抑菌、促生、诱导防御酶活性等特点[10]。Mora等[11]对64株芽孢杆菌进行了脂肽基因鉴定,结果表明48.4%的菌株含有2—4个脂肽基因,环脂肽是拮抗芽孢杆菌的主要抑菌活性物质;向亚萍等[12]对55株拮抗芽孢杆菌分泌的脂肽抗生素的定性定量分析结果表明,芽孢杆菌脂肽类抗生素是抑制植物病原真菌的主要成分,具有多样性;iturin结构的变化及其分泌量与抑菌活性有相关性;吕倩等[13]从南海沉积样品中分离出甲基营养型芽孢杆菌SHB114,其主要抗菌物质为iturin的bacillomycin Lc脂肽化合物;Liu等[14]发现从碱蓬根际分离的海洋芽孢杆菌()B-9987产生的抗菌物质是脂肽类物质,其中Marinhysin A是一种新结构的环脂肽类化合物;李德全等[15]验证海藻中分离的枯草芽孢杆菌NH-8拮抗草莓灰霉病的主要活性物质为iturin。【本研究切入点】目前,灰霉病的生物防治研究主要集中在番茄[16-17]等草本植物,葡萄等木本植物灰霉病的生物防治研究相对较少,生防微生物大多来自陆生环境,海洋源甲基营养型芽孢杆菌在葡萄灰霉病防治中的应用鲜有报道。【拟解决的关键问题】鉴定甲基营养型芽孢杆菌BH21菌株脂肽类抗菌物质合成基因,检测脂肽粗提物对葡萄灰霉病菌的拮抗作用,推测有效活性成分的脂肽类别,为防控植物灰霉病提供依据。
1 材料与方法
试验于2016年在河北省科学院生物研究所和河北农业大学林木病理实验室完成。
1.1 供试材料
灰霉病菌菌株B-20由河北农业大学从罹病葡萄叶片上分离、鉴定,在PDA培养基上培养和保存。
拮抗芽孢杆菌BH21菌株分离于沧州渤海湾海洋样品,经形态特征、生理生化、16S rDNA和基因序列分析,鉴定为甲基营养型芽孢杆菌,保藏于中国微生物菌种保藏委员会普通微生物菌种保藏中心(CGMCC No. 11840)。该菌株具有耐高盐、高浓度甲醇的特性,对灰霉菌具有较强的拮抗作用。BH21菌株菌悬液与25%甘油按1﹕1比例混合,保存于-80℃超低温冰箱。
供试葡萄品种为维多利亚(Victoria),采自河北省衡水市饶阳县。
PDA培养基[8]、LB培养基[18]、ZoBell’s 2216E培养基[19]:蛋白胨5 g,酵母膏1 g,FePO40.1 g,琼脂粉12 g,陈海水定容至1 L,pH 7.6。
1.2 菌株培养
将保存于4℃的灰霉病菌以菌饼接种于PDA培养基平板中心,(23±1)℃黑暗培养5 d,备用。用接种环取一环保存于-80℃冰箱的BH21菌株,接种于ZoBell’s 2216E培养基,(23±1)℃黑暗培养24 h,活化备用。
1.3 芽孢杆菌产脂肽基因检测
根据Cao等[20]方法,分别合成ituA1F/ituA1R、bamB1F/bamB1R、bamC2F/bamC2R、ITUCF1/ITUCR3、ituD2F/ituD2R、FenB1F/FenB1R、FNDF1/FNDR1、110F/110R、Sbo1F/Sbo1R、Qk1F/Qk1R和147F/147R等11对引物,并按照各引物扩增程序进行PCR扩增。反应体系为25 μL:10×PCR Buffer 2.5 μL,2.5 mmol·L-1dNTP 2.0 μL,Taq DNA聚合酶1.25 U,DNA模板(菌悬液)1.0 μL,25 μmol·L-1上下游引物各0.5 μL,加ddH2O至总体积25 μL。PCR产物用1%的琼脂糖凝胶电泳,染色剂为GoldView。凝胶成像系统GDS-8000检测,并记录检测结果。将琼脂糖凝胶电泳检测符合要求的PCR产物交由上海立菲生物技术有限公司纯化测序。将所得核酸序列通过NCBI的比对工具BLAST进行在线比对。
1.4 脂肽粗提物的提取和表面活性检测
菌株BH21培养:LB培养基、100 mL/250 mL三角瓶装量、28℃、180 r/min恒温摇床振荡培养72 h。发酵液经8 000 r/min离心20 min,取上清发酵液用孔径为0.22mm无菌过滤器过滤,获得无菌发酵液。采取盐酸沉淀和甲醇抽提法从无菌发酵液中获得脂肽粗提物[13]。采用排油圈法[21]检测粗提物表面活性。将粗提物配置成10 mg·mL-1的甲醇溶解液,用孔径为0.22mm无菌过滤器过滤。取适量橄榄油,加入苏丹黑Ⅲ染色剂,混匀。取直径9 cm的洁净培养皿,加入60 mL纯净水,缓慢加入染色的橄榄油使水面形成一层油膜。用移液器吸取脂肽粗提物的甲醇溶解液,向培养皿油膜中心持续滴加,看有无排油圈形成。以滴加甲醇的为对照。
1.5 脂肽粗提物对葡萄灰霉病菌菌丝生长的影响
采用菌丝生长速率法[8]测定脂肽粗提物的生物活性。用无菌水配置成初浓度为22 mg·mL-1的脂肽溶液,并将该水溶液加入融化的PDA培养基中制成脂肽浓度为440、220、110、55 μg·mL-1的脂肽平板,以加等量无菌水的PDA平板为对照。在平板中央接种直径为8 mm的灰霉病菌菌块,每处理重复3次,23℃培养4 d。采用十字交叉法测量菌落直径,计算抑制率。相对抑制率(%)=[(对照菌落直径-脂肽粗提物处理菌落直径)/对照菌落直径]×100。根据浓度对数()与菌落生长相对抑制率的概率值(),利用Excel软件求取脂肽粗提物对灰霉病菌菌丝生长的毒力回归方程=a+b和相关系数(),并计算抑制菌落生长的有效中浓度EC50。
1.6 脂肽粗提物对离体葡萄叶片灰霉病的防治效果
采用离体组织接种法[22],用无菌水分别制成440、220、110、55、27.5 μg·mL-1的脂肽溶液。选取大小相近葡萄健康叶片,分别用不同浓度的脂肽溶液将葡萄叶片两面浸湿5 min,晾干,以无菌水处理的葡萄叶片为对照。在叶片正面的3个不同部位接种直径为0.8 cm的灰霉病菌菌饼(培养7 d,具有大量孢子)。22℃保湿4 d,记录发病情况及病斑直径,利用SPSS软件分析防治效果。
1.7 脂肽粗提物洗脱分离及抑菌检测
1.7.1 脂肽粗提物洗脱分离 采用高效液相色谱进行BH21产生的脂肽物质的洗脱分离,色谱柱为TricornTM10/300 column;流动相:A液95%去离子水,5%乙腈,0.1%三氟乙酸,B液5%去离子水,95%乙腈,0.1%三氟乙酸;洗脱条件:0.1% HFA乙腈,0→100% 线性洗脱120 min;检测波长:215 nm;流速:3 mL·min-1;进样量:10 mL;柱温:室温。使用之前将A液和B液超声处理30 min,以去除液体中的气泡。
1.7.2 分离物各组分对灰霉病菌的抑制作用 根据各组混合物洗脱时,A液和B液所占比例,配置相对应的洗脱液(均值)作为对照。采用琼脂扩散法检测分离物各组分对灰霉病菌的抑制作用。具体操作:向PDA平板中央接种直径为8 mm的灰霉病菌菌饼,距中心3 cm处打孔,分别加入50 μL洗脱液和相对溶剂,(23±1)℃黑暗培养。
1.7.3 脂肽分离物有效组分分析 将对灰霉病菌有抑制作用的脂肽分离物通过反相高效液相色谱分析。色谱柱:waters Xbridge Peptide BEHC18,300 A,5 μm;流动相:0.1% HFA Water,0.1% HFA乙腈;洗脱条件:0.1% HFA乙腈,0→100% 梯度洗脱80 min;检测波长:215 nm;流速:1 mL·min-1;进样量:1 mL;柱温:30℃。
2 结果
2.1 BH21菌株脂肽基因的检测
2.1.1 Iturin合成的相关基因序列分析 引物ituA1F/ituA1R、bamB1F/bamB1R、ITUCF1/ITUCR3和ituD2F/itud2R的PCR分别得到880、512、560、643 bp核酸片段,与Cao等[20]报道的大小相近。Nucleotide blast工具分析结果表明,4对引物获得的核酸序列分别与inturin合成基因、、、相关,与相关菌株相似度为97%—99%(表1)。核酸序列产物分别为iturin A合成酶A、bacillomycin D合成蛋白BmyB、iturin A合成酶C、D,与相关菌株相似度为96%—98%。
2.1.2 Fengycin合成的相关基因序列分析 引物FNDF1/FNDR1扩增获得288 bp核酸片段,Nucleotide blast工具分析结果表明,此核酸片段与解淀粉芽孢杆菌(subsp.)SQR9的相似度为99%(表1),其产物是fengycin合成酶FenD。FNDF1/FNDR1扩增产物翻译的蛋白序列与枯草芽孢杆菌MBI600FenD蛋白序列的相似度为100%。
2.1.3 Sufactin合成的相关基因序列分析 引物110F/110R扩增获得307 bp核酸片段,此核酸片段与解淀粉芽孢杆菌SQR9的相似度为96%(表1),其产物是sufactin合成酶SrfAB。110F/110R扩增产物翻译的蛋白序列与枯草芽孢杆菌SQR9的SrfAB蛋白序列相似度为96%。
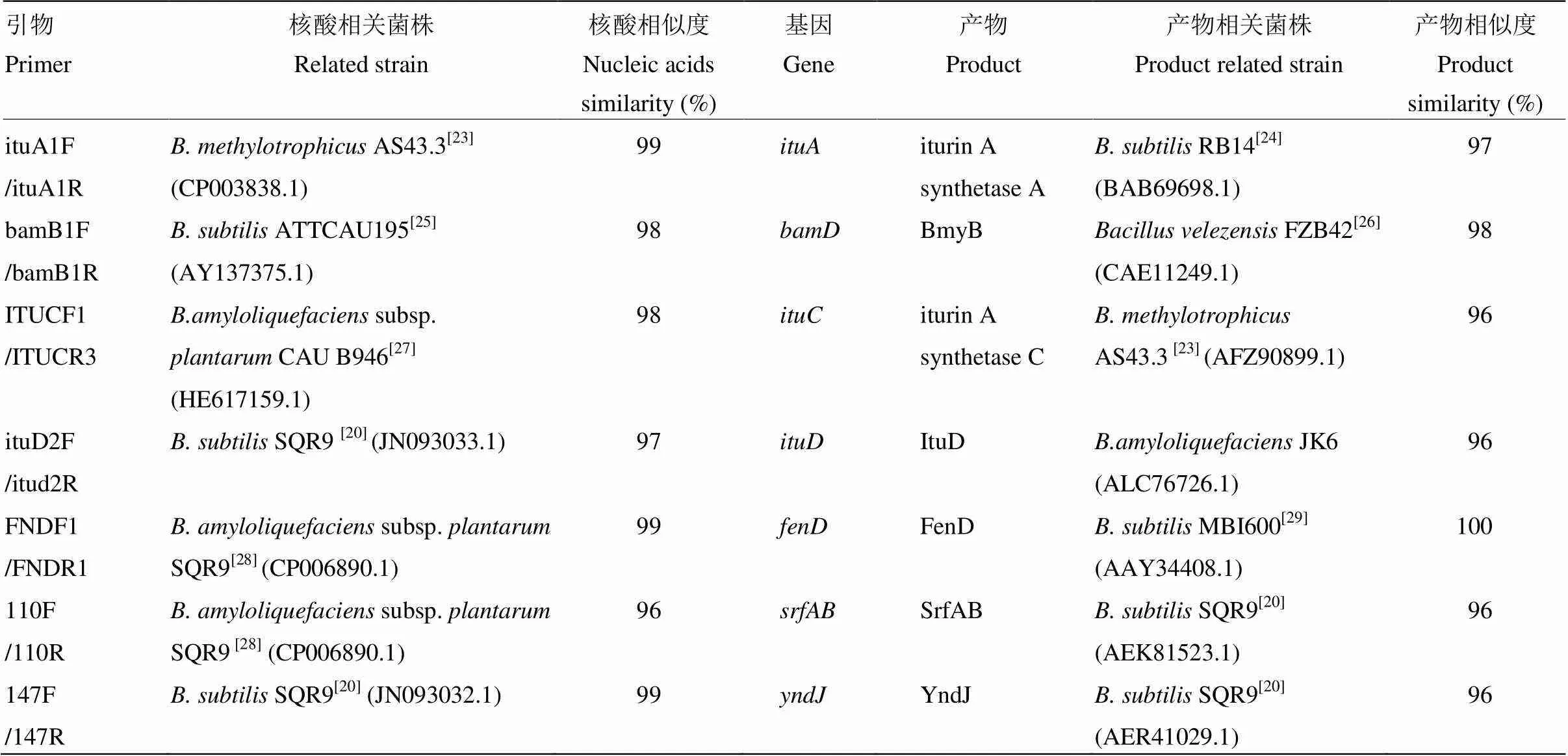
表1 PCR产物核酸序列与相关基因的相似度
2.1.4 假定蛋白YndJ合成的相关基因序列分析 引物147F/147R扩增获得215 bp核酸片段,此核酸片段与枯草芽孢杆菌SQR9的相似度为99%(表1),其产物是假定蛋白合成酶YndJ。扩增产物翻译的蛋白序列与枯草芽孢杆菌SQR9的YndJ蛋白序列相似度为96%。
2.2 脂肽粗提物的提取和表面活性检测
采用盐酸沉淀和甲醇抽提法从菌株BH21发酵液中提取脂肽粗提物,冷冻干燥后确定该粗提物的得率为428 mg·L-1。滴加该粗提物的甲醇溶解液可以在橄榄油油膜上形成排油圈,而甲醇对照则不能产生排油圈,进一步验证该提取物为脂肽类物质,具有较强的表面活性。
2.3 BH21脂肽粗提物对葡萄灰霉病菌菌丝生长的抑制作用
葡萄灰霉病菌菌块在含不同浓度BH21脂肽粗提物的PDA培养基上23℃培养4 d后,与对照相比,试验浓度的BH21脂肽物质均对灰霉病菌菌丝生长有一定的抑制作用,而且随着脂肽浓度的增加,菌丝生长受到的抑制作用增强,其中440 μg·mL-1脂肽物质对灰霉病菌菌丝生长的抑制率为82.8%(表2)。根据浓度对数()与菌落生长相对抑制率的概率值(),菌株BH21脂肽粗提物对灰霉菌菌丝生长抑制的毒力方程为=1.097+3.1157,相关系数(2=0.921),根据此方程计算菌株BH21产生的脂肽类混合物对灰霉病菌菌丝抑制的EC50为144.39 μg·mL-1。

表2 BH21脂肽粗提物对灰霉病菌菌丝生长的抑制作用
2.4 BH21脂肽粗提物对离体葡萄叶片灰霉病的防治效果
采用不同浓度的BH21脂肽粗提物稀释液处理葡萄叶片,保湿培养4 d后进行灰霉病病斑的测定(图1、表3)。与对照相比,不同浓度的脂肽粗提物稀释液对葡萄叶片灰霉病都有明显防治效果,脂肽粗提物浓度越高,病斑直径越小,其中浓度为440 μg·mL-1的BH21脂肽溶液的防治效果最好,接种部位不发病。根据病斑直径计算BH21脂肽粗提物对灰霉病病斑扩展相对抑制率为32.8%—100%,防治效果显著(表3)。

1: 440 μg·mL-1; 2: 220 μg·mL-1; 3: 110 μg·mL-1; 4: 55 μg·mL-1; 5: 27.5 μg·mL-1

表3 BH21脂肽粗提物对离体葡萄叶片灰霉病病斑数和病斑扩展的影响
同列数据后不同小写字母表示在<0.05水平差异显著
Data with different lowercases in the same column indicate significant difference at<0.05 level
2.5 菌株BH21脂肽粗提物的分离及抑菌效果检测
2.5.1 脂肽粗提物洗脱分离 根据制备型液相色谱的峰值,BH21脂肽粗提物中共有6个明显的单峰,根据峰值共收集了6个样品,依据收集顺序分别命名为组分1、组分2、……、组分6。根据各峰出现时洗脱液的成分比例,计算得到相应洗脱液的平均值(表4)。
2.5.2 各组分对灰霉病菌生长的抑制作用 接种培养4 d后,各组分及其相对应的洗脱液对灰霉菌菌丝的生长均有一定的抑制作用,并且洗脱液的挥发也使灰霉病菌生长受到抑制。组分1、4、5、6与其相对应的洗脱液1、4、5、6对灰霉菌丝的抑制作用基本相同,说明这4个成分无抑菌活性。组分2和组分3对灰霉菌抑制作用明显大于其相应的缓冲液(图2),其中组分2的抑菌带宽度为(6.3±0.6)mm,组分3的抑菌带宽度为(2.8±0.3)mm,由此判断组分2和组分3在菌株BH21对灰霉病菌的拮抗中起主要作用,且组分2的抑菌活性大于组分3,将这两个活性成分分别命名为BH21-2和BH21-3。
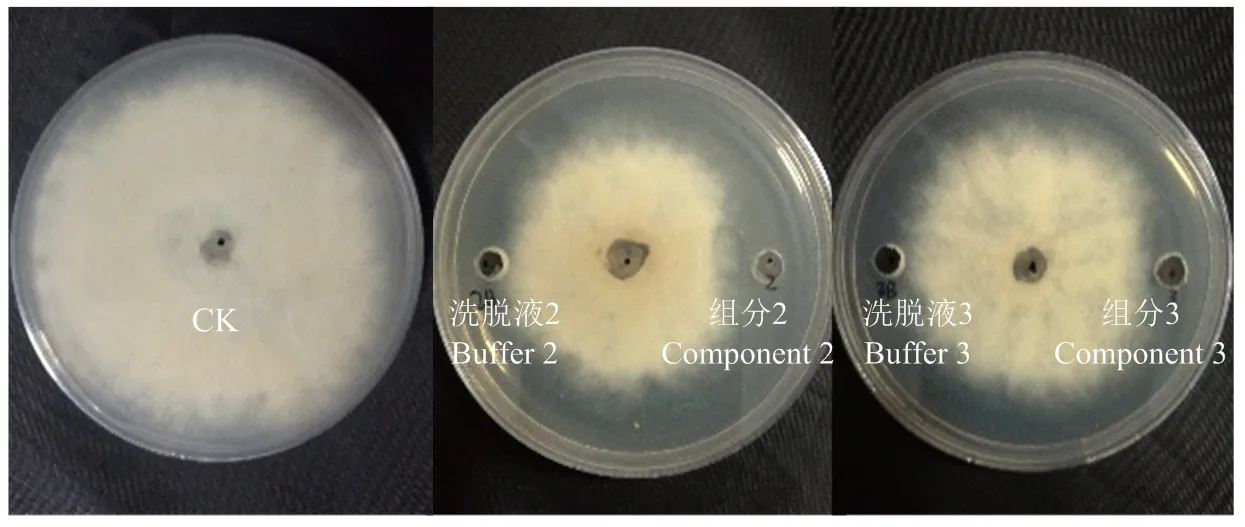
图2 脂肽粗提物分离物对灰霉病菌的拮抗活性
2.5.3 脂肽粗提物分离物BH21-2和BH21-3的反相高效液相色谱检测 将组分BH21-2和BH21-3分别进行RP-HPLC检测,结果表明组分BH21-2、BH21-3保留时间范围分别在43—51、48—55 min,两个组分各包含多个小峰,两者之间还有部分重叠(图3)。此出峰时间与相似条件下fengycin类脂肽出峰时间相符(34—56 min)[30],因此推断组分BH21-2和BH21-3均为fengycin类脂肽。

图3 BH21-2和BH21-3反相高效液相色谱图
3 讨论
灰霉病生防菌株的筛选一直是灰霉病安全防控研究的重点,随着陆地拮抗微生物筛选和研究的深入,人们将目光转向生境独特的海洋微生物资源[31]。高伟等[32]研究发现,从渤海潮间带盐生植物碱蓬根际分离的海洋芽孢杆菌B-9987对番茄灰霉病具有良好的拮抗作用;李德全等[15]从南通近海海藻中分离到枯草芽孢杆菌NH-8,该菌能够增强草莓系统抗性,促进草莓植株生长。然而,由于活体微生物资源的应用效果受外界条件影响较大,对拮抗菌株所产生的抑菌活性物质的分离、鉴定具有更为重要的意义。其中脂肽是芽孢杆菌产生的一类重要抑菌活性物质,吕倩等分别从海洋细菌发酵液中获得了具有抑菌活性的bacillomycin Lc和Marinhysin A等脂肽类物质[13-14]。李德全等[15]的研究发现,海洋枯草芽孢杆菌NH-8中的主要抗菌物质为iturin,其粗提物对灰霉菌的抑菌率为82.7%。本研究的拮抗菌株BH21是从沧州渤海湾海洋样品中分离的甲基营养型芽孢杆菌,其菌体和无菌发酵液对灰霉病菌均具有较强的拮抗作用,表明该菌株具有产生胞外抑菌物质的能力,初步研究表明该发酵液具有明显的表面活性,推测该菌产生的活性物质有可能为脂肽类物质(另文发表)。
本研究采用盐酸沉淀和甲醇抽提的方法进行BH21发酵液中的脂肽类物质的分离,通过平板和离体叶片试验方法测定了不同浓度脂肽粗提物对灰霉病菌生长和叶面病害的防治能力。离体试验是能够快速、准确反应菌株拮抗效果的试验方法,在拮抗菌株和抑菌物质筛选中多被采用[33-34]。本研究为了尽快确定BH21脂肽类粗提物的抑菌效果,采用葡萄离体叶片测定了脂肽粗提物对灰霉病的防治效果,在接种灰霉菌块的情况下,不同浓度的粗提物均对灰霉病有良好的防治作用,400 μg·mL-1稀释液对离体葡萄叶片的灰霉病防治效果为100%、55 μg·mL-1时的防治效果为55.0%,防病效果好于相关研究结果[15]。
对菌株产生的抑菌活性物质进行进一步纯化和鉴定是明确菌株拮抗机理的基础,对菌株脂肽类合成基因的检测可以确定菌株存在何种物质的合成能力。研究发现,脂肽类物质主要包括surfactin、iturin和fengycin等3大类,随着对这些物质合成基因研究的深入,研究者设计出多对特异性引物以进行菌株脂肽类物质的合成能力和种类的测定[35]。Cao等[20]应用已发表和自己设计的引物进行PCR扩增,鉴定出枯草芽孢杆菌SQR9中含有、、、、、、、和等9个脂肽合成基因;Mora等[11]则利用特异引物探针筛选出具有脂肽合成基因的拮抗菌株。本研究采用PCR方法并利用11对特异引物检测菌株BH21中是否存在脂肽物质的合成基因,确定菌株BH21含有、、、、、和,推测该菌株具有合成多种脂肽类物质的能力。此外,在选择的11对引物中只有7对引物扩增出与目标大小相近的产物,未得到扩增产物的4对引物分别为Sbo1F/Sbo1R(枯草芽孢杆菌素的)、FenB1F/ FenB1R(丰原素的)、bamC2F/bamC2R(芽孢菌霉素的)、Qk1F/Qk1R(枯草杆菌蛋白酶)。这4对引物虽多次调整扩增程序或始终无扩增产物或产生非特异性片段,推测其没有特异产物的原因,其一可能由于菌株BH21没有相似的基因序列,也可能是基因序列与特异引物不匹配,而后者则有可能是由于海洋细菌中含有特异成分所引起的。
那么,菌株BH21发酵液的甲醇粗提物中拮抗灰霉病菌的脂肽物质有几类呢?本研究通过制备型HPLC进行了脂肽粗提物的分离,并将不同出峰时间的脂肽分离物进行抑制灰霉病菌的活性验证。对峙试验结果表明组分2和组分3具有明显的抑菌活性,其中组分2抑菌能力最强。反相高效液相色谱图显示组分2和组分3与fengycin类脂肽[29]出峰时间相符合,特异引物PCR也验证菌株BH21含有fengycin类脂肽合成基因。然而,组分2和组分3中均含有多个小峰,其分子结构仍需采用核磁共振等方法进行鉴定。另外,其他4种组分的功能性质、菌株所具有的iturin和surfactin类脂肽合成基因是否表达需要进一步研究。
甲基营养型芽孢杆菌SHB114[13]是来自南海深海沉积物的一株对黄瓜炭疽病菌()有较强抑制作用的生防菌株,其产生的脂肽为iturins类的bacillomycin LC。本文的菌株BH21同样是一株海洋源甲基营养型芽孢杆菌,其对葡萄灰霉病菌有效的活性成分是fengycin类脂肽,不仅为葡萄灰霉病的生物防控提供了备选资源,同时也扩展了海洋源甲基营养型芽孢杆菌的抑菌范围。
4 结论
来自海洋环境的甲基营养型芽孢杆菌菌株BH21具有产生多种抗菌脂肽的潜力,发酵液脂肽粗提物对葡萄灰霉病菌具有较强的拮抗作用,其有效活性成分为fengycin类脂肽,在葡萄灰霉病生物防治中具有潜在应用价值。
[1] 张玮, 乔广行, 黄金宝, 王忠跃, 李兴红. 中国葡萄灰霉病菌对嘧霉胺的抗药性检测. 中国农业科学, 2013, 46(6): 1208-1212.
Zhang W, Qiao G X, Huang J B, Wang Z Y, Li X H. Evaluation on resistance of grape gray mold pathogento pyrimethanil in China.,2013, 46(6): 1208-1212. (in Chinese)
[2] 严红, 燕继晔, 王忠跃, 李亚宁, 金桂华, 李兴红. 葡萄灰霉病菌对3种杀菌剂的多重抗药性检测. 果树学报, 2012, 29(4): 625-629.
Yan H, Yan J Y, Wang Z Y, Li Y N, Jin G H, Li X H. Multiple fungicide resistance offrom grapevine to three fungicides., 2012, 29(4): 625-629. (in Chinese)
[3] Madhaiyan M, Poonguzhali S, Kwon S W, Sa T M.sp. nov., a methanol-utilizing, plant- growth-promoting bacterium isolated from rice rhizosphere soil., 2010, 60(10): 2490-2495.
[4] 王洪梅, 吴云成, 沈标. 青枯病生防菌N5的特性及其生物学效应. 土壤, 2013, 45(6): 1082-1090.
Wang H M, Wu Y C, Shen B.Characterization and biological effects of antagonistic N5 against., 2013, 45(6): 1082-1090. (in Chinese)
[5] 刘伟, 宋双, 沈小英, 安天赐, 牛小义, 安德荣. 番茄灰霉病拮抗芽孢杆菌LW-6-1的筛选、鉴定及抑菌活性研究. 西北农林科技大学学报(自然科学版), 2013, 41(11): 73-79.
Liu W, Song S, Shen X Y, An T C, Niu X Y, An D R. Screening, identification and antibacterial activity of antagonistic bacteria LW-6-1 against., 2013, 41(11): 73-79. (in Chinese)
[6] 黄霄, 陈波, 周登博, 谭昕, 张锡炎. 菌株BM-24的分离鉴定及对香蕉枯萎病菌的抑菌活性. 植物保护学报, 2013, 40(2): 121-127.
Huang X, Chen B, Zhou D B, Tan X, Zhang X Y.Isolation, identification of BM-24 strains and its antifungal activity of antagonistic bacteria againstf. sp.., 2013, 40(2): 121-127. (in Chinese)
[7] 伏波, 姚娟妮, 高小宁, 黄丽丽, 康振生, 韩青梅. 植物内生枯草芽孢杆菌Em7菌株对葡萄灰霉病菌的抑菌活性. 农药学学报, 2016, 18(4): 465-471.
FU B, YAO J N, GAO X N, HUANG L L, KANG Z S, HAN Q M. Antifungal activity of plant endophyticstrain Em7 against., 2016, 18(4): 465-471. (in Chinese)
[8] 周泠璇, 刘娅. 红提葡萄内生细菌的分离鉴定及灰霉病拮抗菌的筛选. 生物技术通报, 2016, 32(4): 184-189.
Zhou L X, Liu Y.Isolation and identification of endophytic bacteria in red grape, and screening of antagonistic bacteria against., 2016, 32(4): 184-189. (in Chinese)
[9] Ge B B, Liu B H, Nwet T T, zhao W J, Shi L M, ZHANG K.strain NKG-1, isolated from Changbai Mountain, China, has potential applications as a biofertilizer or biocontrol agent., 2016,11(11): e0166079.
[10] Ongena M, Jacques P.lipopeptides: versatile weapons for plant disease biocontrol., 2008, 16(3): 115-125.
[11] Mora I, Cabrefiga J, Montesinos E. Cyclic lipopeptide biosynthetic genes and products, and inhibitory activity of plant- associatedagainst phytopathogenic bacteria., 2015, 10(5): e0127738.
[12] 向亚萍, 陈志谊, 罗楚平, 周华飞, 刘永锋.芽孢杆菌的抑菌活性与其产脂肽类抗生素的相关性. 中国农业科学, 2015, 48(20): 4064-4076.
Xiang Y P, Chen Z Y, Luo C P, Zhou H F, Liu Y F.The antifungal activities ofspp. and its relationship with lipopeptide antibiotics produced byspp.., 2015, 48(20): 4064-4076. (in Chinese)
[13] 吕倩, 胡江春, 王楠, 王雪梅, 王书锦. 南海深海甲基营养型芽孢杆菌SHB114抗真菌脂肽活性产物的研究. 中国生物防治学报, 2014, 30(1): 113-120.
LÜ Q, Hu J C, Wang N, Wang X M, Wang S J. Anti-fungal lipopeptides produced bySHB114 isolated from south China sea., 2014, 30(1): 113-120. (in Chinese)
[14] Liu R F, Zhang D J, Li Y G, Li M T, Li T. A new antifungal cyclic lipopeptide fromB-9987., 2010, 93(12):2419-2425.
[15] 李德全, 钱亚明, 周鸣鸣, 谈蓉, 邓自发, 袁素霞. 海洋细菌NH-8防治草莓灰霉病机理及其抗菌物质分析. 植物保护学报, 2016, 43(2): 215-221.
Li D Q, Qian Y M, Zhou M M, Tan R, Deng Z F, Yuan S X. The mechanism of biological control of strawberry gray mould using the marine bacterial NH-8 strain and analysis of the antifungal substances from the strain., 2016, 43(2): 215-221. (in Chinese)
[16] 赵杨, 苗则彦, 李颖, 白元俊. 番茄灰霉病防治研究进展. 中国植保导刊, 2014, 34(7): 21-29.
Zhao Y, Miao Z Y, Li Y, Bai Y J. Research progress on controlling against tomato gray mold., 2014, 34(7): 21-29. (in Chinese)
[17] 陈宇飞, 文景芝, 李立军. 葡萄灰霉病研究进展. 东北农业大学学报, 2006, 37(5): 693-699.
Chen Y F, Wen J Z, Li L J. Research advance of grape grey mould., 2006, 37(5): 693-699. (in Chinese)
[18] 方中达. 植病研究方法. 北京: 中国农业出版社, 1998.
FANG Z D.. Beijing: China Agriculture Press, 1998. (in Chinese)
[19] 孙菽蔚, 王子峰, 岳海东, 肖天. 一株海洋几丁质酶产生菌的筛选及其产酶条件的初步研究. 海洋科学, 2007, 31(5): 10-16.
Sun S W, Wang Z F, Yue H D, Xiao T. Screening of chitinase-producing marine bacterial strains and preliminary studies on chitinase-producing conditions., 2007, 31(5): 10-16. (in Chinese)
[20] Cao Y, Xu Z H, Ling N, Yuan Y J, Yang X M, Chen L H, Shen B, Shen Q R. Isolation and identification of lipopeptides produced bySQR 9 for suppressing Fusarium wilt of cucumber., 2012, 135(1): 32-39.
[21] 曹小红, 廖振宇, 王春玲, 哈志瑞, 杨亚静, 鲁梅芳, 励建荣.TK-1产脂肽的纯化、抑菌活性及其表面活性剂特性. 中国生物工程杂志, 2008, 28(1): 44-48.
Cao X H, Liao Z Y, Wang C L, Ha Z R, Yang Y J, Lu M F, Li J R. Purification and antimicrobial activity of lipopeptide produced byTK-1 and its surfactant property., 2008, 28(1): 44-48. (in Chinese)
[22] 黄大野, 周婷, 姚经武, 刘晓艳, 曹春霞, 杨妮娜, 胡洪涛, 龙同, 杨自文. 死亡谷芽孢杆菌NBIF-001防治灰霉病研究. 中国蔬菜, 2016(10): 63-66.
Huang D Y, ZHOU T, Yao J W, Liu X Y, Cao C X, Yang N N, Hu H T, Long T, Yang Z W. Studies on controlling effect ofNBIF-001 on gray mold., 2016(10): 63-66. (in Chinese)
[23] Dunlap C A, Kim S J, Kwon S W, ROONEY A P. Phylogenomic analysis shows thatsubsp.is a later heterotypic synonym of., 2015, 65(7): 2104-2109.
[24] Tsuge K, Akiyama T, Shoda M. Cloning, sequencing, and characterization of the iturin A operon., 2001, 183(21): 6265-6273.
[25] Moyne A L, Cleveland T E, Tuzun S. Molecular characterization and analysis of the operon encoding the antifungal lipopeptide bacillomycin D., 2004, 234(1): 43-49.
[26] Koumoutsi A, Chen X H, Henne A, Liesegang H, Hitzeroth G, Franke P, Vater J, Borriss R. Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides instrain FZB42., 2004, 186(4): 1084-1096.
[27] Blom J, Rueckert C, Niu B, WANG Q, BORRISS R. The complete genome ofsubsp.CAU B946 contains a gene cluster for nonribosomal synthesis of iturin A., 2012, 194(7): 1845-1846.
[28] Zhang N, Yang D Q, Wang D D, Miao Y Z, Shao J H, Zhou X, Xu Z H, Li Q, Feng H C, Li S Q, Shen Q R, Zhang R F. Whole transcriptomic analysis of the plant-beneficial rhizobacteriumSQR9 during enhanced biofilm formation regulated by maize root exudates., 2015, 16(1): 685.
[29] Joshi R, Gardener B B M. Identification and characterization of novel genetic markers associated with biological control activities in., 2006, 96(2): 145-154.
[30] Arrebola E, Jacobs R, Korsten L. Iturin A is the principal inhibitor in the biocontrol activity ofPPCB004 against postharvest fungal pathogens., 2010, 108(2): 386-395.
[31] 刘淼, 王继红, 姜健, 杨宝灵, 温小红, 陈玉飞, 刘丽. 海洋微生物应用于生物农药的研究进展. 中国农学通报, 2014, 30(3): 232-236.
Liu M, Wang J H, Jiang J, Yang B L, Wen X H, Chen Y F, Liu L.Advances in the studies on the application of marine microorganism in biological pesticides., 2014, 30(3): 232-236. (in Chinese)
[32] 高伟, 田黎, 张久明, 周俊英, 郑立, 崔志松, 李元广. 海洋芽孢杆菌B-9987菌株对番茄灰霉病和早疫病的作用机制初探. 植物保护, 2010, 36(1): 55-59.
Gao W, Tian L, Zhang J M, Zhou J Y, Zheng L, Cui Z S, Li Y G. A primary study on the biocontrol mechanisms ofB-9987 against the tomato gray mold and early blight., 2010, 36(1): 55-59. (in Chinese)
[33] 巩文峰, 李月飞, 上官妮妮, 赵新贝, 王阳, 马青. 出芽短梗霉对苹果采后灰霉病的防治. 中国生物防治学报, 2016, 32(2): 251-257.
Gong W F, Li Y F, Shangguan N N, Zhao X B, Wang Y, Ma Q. Control of apple postharvest gray mold by., 2016, 32(2): 251-257. (in Chinese)
[34] 申顺善, 张莹莹, 张维娜, 吕雅悠, 朱卓琳, 朴凤植. 绿针假单胞菌HL5-4对番茄灰霉菌的抑制活性及其定殖能力. 园艺学报, 2016, 43(6): 1195-1202.
Shen S S, Zhang Y Y, Zhang W N, LÜ Y Y, Zhu Z L, Piao F Z. Antifungal activity ofHL5-4 against tomato gray mold and its colonization ability., 2016, 43(6): 1195-1202.(in Chinese)
[35] Hsieh F C, Lin T C, Meng M, Kao S S. Comparing methods for identifyingstrains capable of producing the antifungal lipopeptide iturin A., 2008, 56(1): 1-5.
(责任编辑 岳梅)
Antagonism ofstrain BH21 to
WEI XinYan1, HUANG YuanYuan2, HUANG YaLi2, DU KeJiu1
(1College of Forestry, Hebei Agricultural University/National Engineering Research Center for Agriculture in Northern Mountainous Areas, Baoding 071001, Hebei;2Institute of Biology, Hebei Academy of Sciences, Shijiazhuang 050051)
【Objective】strain BH21 is a marine derived bacterium that has a good antagonistic effect on. The objective of this study is to identify the lipopeptide synthesis genes of the strain BH21 and investigate the antagonism of the crude extracts of lipopeptide to, and to provide a scientific basis for the prevention and control of. 【Method】To determine the mechanisms of the antagonistic strain, PCR was used to screen strain BH21 for genes involved in biosynthesis of antimicrobial lipopeptide. Crude lipopeptide was extracted from the culture broth by hydrochloric acid precipitation and methanol extraction. surface activity of the crude lipopeptide was determined by oil spreading method. The inhibition ability of the crude lipopeptide on mycelial growth ofwas investigated by mycelial growth rate method and EC50was calculated. The crude lipopeptide was separated by liquid chromatography (HPLC) and the inhibition ability of each component towas detected by the mycelium growth rate method. Reversed phase high performance liquid chromatography (RP-HPLC) was used to analyze the types of the main antifungal components. the effect of the crude lipopeptide on the control ofin grape was detected by tissue inoculation. 【Result】A total of 11 pairs of specific primers were used for genomic amplification of strain BH21, and 7 gene fragments of the size expected to be correlated with biocontrol activities were efficiently amplified. after amplification, sequencing and BLAST analysis, the results showed that the similarity between the amplified products and the related lipopeptide genes was 96%-99%, the similarity between the protein produced by the nucleic acid fragment and the lipopeptide synthesized protein of the related strain was 96%-100%, which showed that the genome of strain BH21 contained,,,,,andgenes and the strain had the ability to synthesize antimicrobial lipopeptide such as surfactins, iturins and fengycins. Antifungal lipopeptide produced by BH21 was extracted by hydrochloric acid precipitation and methanol extraction, and the yield was 428 mg·L-1. The results of the oil spreading test showed that the crude lipopeptide had surface activity. The crude lipopeptide significantly inhibited mycelial growth ofwhen theconcentration was 440 μg·mL-1, the relative inhibition rate of mycelial growth ofwas 82.8%, and the effective medium concentration EC50was 144.39 μg·mL-1. Six fractions were collected with elution time through HPLC, only BH21-2 and BH21-3 inhibited the growth of. RP-HPLC chromatogram analysis showed that the components BH21-2 and BH21-3 belong to the fengycin family. Grape leaftest results showed that when the concentration of crude lipopeptide was 440 μg·mL-1,the control effect againstgrapegray leaf spot was 100%, while the concentration was 220 μg·mL-1, the relative inhibitory rate of grape leaf lesion was 94.4%.【Conclusion】The strain BH21 has the genes for synthesizing antimicrobial lipopeptide such as surfactins, iturins and fengycins, and the lipopeptide extracted from this strain has strong antagonism to, so it has potential application in the biological control of.
;; antifungal activity; lipopeptide; grapegray mold
2017-07-31;
2017-10-06
国家重点研发计划(2016YFC0501303)、河北省应用基础研究计划重点基础研究项目(15962904D)
魏新燕,E-mail:bdweixinyan@163.com。
黄亚丽,Tel:0311-83014618;E-mail:huangyali2291@163.com。通信作者杜克久,Tel:0312-7528491,E-mail:dukejiu@126.com

