不同方法学测定乙型肝炎病毒核心抗体的阳性率及其定量检测意义的研究
王红翠 林健聪 吴英松 董志宁 李志雄★
人体感染乙型肝炎病毒(hepatitis B virus,HBV)后最先产生的抗体为乙型肝炎病毒核心抗体(hepatitis B virus core antibody,anti⁃HBc),在HBV感染早期即可在血清中检测到,常持续存在终身[1]。目前,anti⁃HBc常用的检测方法有酶联免疫吸附测定法(enzyme⁃linked immunosorbent as⁃say,ELISA)、时间分辨免疫分析法、化学发光免疫分析法(chemiluminescence immunoassay,CLIA)等。其中,传统的ELISA方法,通常会将不稀释样本的检测结果作为流行病学调查,而将标本稀释检测的结果用于临床诊断,但据张碧莹等[2]的研究显示,ELISA稀释法检测低浓度anti⁃HBc时,易呈假阴性。据文献的报道可知,不同地区的正常人群中,anti⁃HBc的阳性率不一样,且普遍呈现阳性率高的状况[3⁃4]。仅从定性方面检测 anti⁃HBc并不能很好的解释它的临床意义。有研究显示,早期(30岁之前)发生HBeAg血清转换且HBV DNA持续检测不到的慢性乙肝患者,临床症状得到显著改善,肝纤维化可以逆转[5]。
本研究选用临床检测性能较好的CLIA试剂盒作为对比试剂,与ELISA试剂盒的稀释法、不稀释法同步测定标本的anti⁃HBc浓度,分析不同方法学测定 anti⁃HBc的阳性率,以探讨 anti⁃HBc检测试剂的性能。同时从定量角度探讨其不同浓度水平的临床意义,通过对HBeAg阳性慢性乙型病毒性肝炎(chronic hepatitis B,CHB)患者的anti⁃HBc、HBeAg浓度水平进行跟踪研究,以探讨anti⁃HBc定量测定的临床意义,并期望对乙型肝炎的治疗、预后观察有一定的参考意义。
1 对象与方法
1.1 对象
随机选取健康查体者的病例400例,年龄在20~60(32±11.54)岁之间,男性 272例,女性 128例,采集血清标本,共400例标本。另外选取97例CHB 患者(anti⁃HBc、HBeAg、HBsAg临床检测均为阳性的患者,即大三阳患者),年龄在15~73(39±13.62)岁之间,男性69例,女性28例,采集其抗乙肝病毒治疗前后的血清标本,共194例有效标本。所有标本均来源于福建福州传染病医院。
1.2 仪器与试剂
雅培贸易(上海)有限公司(以下简称“雅培公司”)的全自动免疫分析仪ARCHITECT i2000sr及配套的anti⁃HBc测定试剂盒、校准品和专用质控品。厦门优迈科医学仪器有限公司的全自动化学发光免疫分析仪Caris200,配套广州市达瑞生物技术股份有限公司(以下简称“达瑞公司”)的anti⁃HBc测定试剂盒和HBeAg测定试剂盒及专用的质控品。上海科华生物工程股份有限公司(以下简称“科华公司”)的anti⁃HBc检测试剂盒及质控品,配套BIO⁃RAD公司的酶标仪PR 4100。
1.3 方法
1.3.1 试剂定标
根据雅培公司和达瑞公司的anti⁃HBc测定试剂盒的要求,使用定标品进行定标,定标合格后,再进行下一步的检测操作。每天进行测试前先测定质控品浓度,保证定标曲线的可靠性。科华公司的anti⁃HBc检测试剂盒,根据说明书的要求,每次实验使用对照品进行定标,并测定质控品,以保证实验的可靠性。
1.3.2 标本采集
对于随机抽取的400例健康查体者,经其本人同意将体检检测的剩余标本用于科研研究后,采集检测剩余的血清标本2 mL,于2~8℃短期保存,-20℃长期储存。将在医院进行抗病毒治疗的CHB患者纳入研究,在获得病人同意的情况下,采集药物治疗前检测剩余的血清标本2 mL,经3个月治疗后,再次采集检测剩余的血清标本2 mL,其中排除除了抗病毒药物治疗还进行其他治疗的患者、标本采集相隔时间不是3个月的患者、未取得知情同意的患者后,共有97例CHB患者,共194份标本,于2~8℃短期保存,-20℃长期储存。
1.3.3 标本检测
分别采用雅培公司、达瑞公司和科华公司的anti⁃HBc试剂盒对400例健康查体者的标本进行同步测定,统计分析各试剂盒检测anti⁃HBc的阳性率。
使用雅培公司、达瑞公司和科华公司的anti⁃HBc试剂盒和达瑞公司的HBeAg测定试剂盒,对97例临床CHB患者药物治疗前后收集的共194份血清标本进行检测,并分析评价药物治疗前后anti⁃HBc和HBeAg的浓度变化。
所有实验操作过程,严格按照各公司试剂盒的说明书进行。
1.4 统计分析
采用SPSS 18.0统计软件进行数据处理与统计分析,计数资料以百分率表示;CHB患者在药物治疗前后anti⁃HBc浓度变化的比较,采用配对t检验统计分析;评价不同anti⁃HBc浓度水平治疗前后HBeAg的血清学转换率,采用卡方检验统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同厂家试剂检测anti⁃HBc的阳性率比较
对于CHB患者在治疗前后收集的共194份血清标本,达瑞公司与其他两家公司的anti⁃HBc试剂盒检测结果均为阳性,其阴阳性符合率为100.0%,统计结果详见表1。
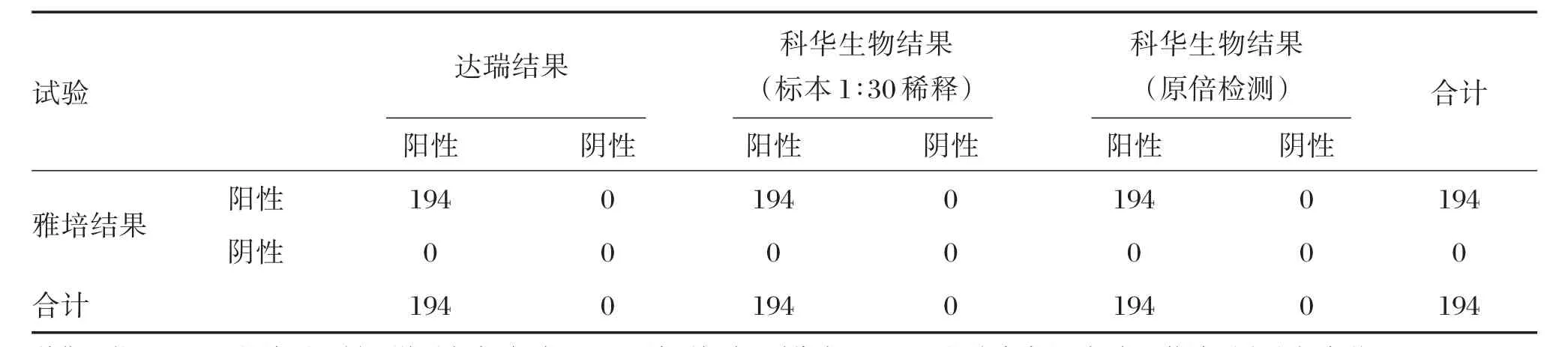
表1 CHB患者治疗前后anti⁃HBc的阴阳性结果统计表(n)Table 1 The results of anti⁃HBc before and after treatment of CHB patients(n)
对随机选取400例健康查体者标本进行anti⁃HBc检测,达瑞公司与雅培公司的阴阳性符合率为100.0%;科华生物(标本1∶30稀释)与雅培公司的阳性符合率为35.71%,阴性符合率为100.0%,总符合率为73.0%;科华生物(原倍检测)与雅培公司的阳性符合率为100.0%,阴性符合率为63.21%,总符合率为63.0%,统计结果见表2。不同厂家之间的符合率结果详见表3。
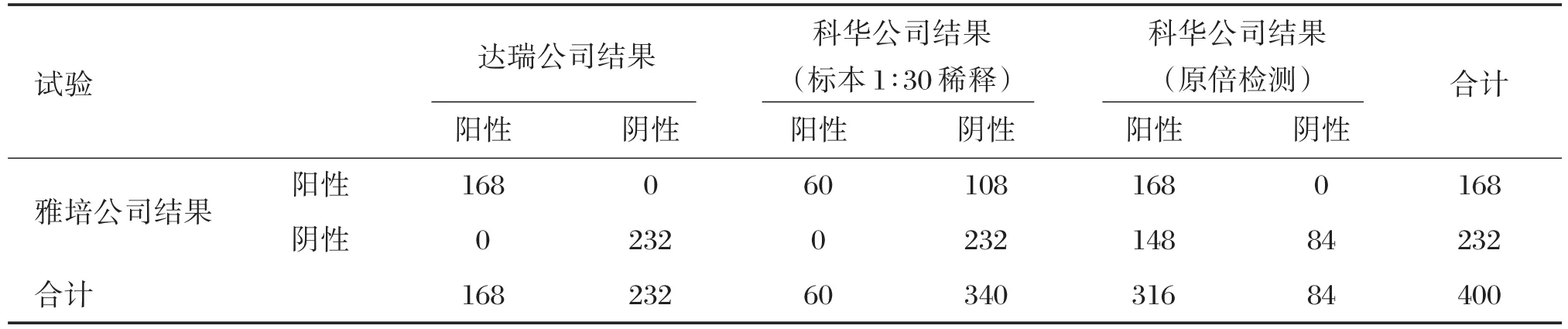
表2 健康查体者的anti⁃HBc阴阳性结果统计表(n)Table 2 The statistics of anti⁃HBc results of healthy testing groups(n)
2.2 抗病毒治疗中的anti⁃HBc水平及其预测意义
2.2.1 CHB患者治疗前后的anti⁃HBc浓度变化
采用达瑞anti⁃HBc测定试剂盒对97例CHB患者抗病毒治疗前后的标本进行测定,并对CHB患者治疗前后的anti⁃HBc浓度水平进行配对t检验,检验结果见表4。结果显示在抗病毒治疗前后,CHB患者的anti⁃HBc浓度无显著性差异(P>0.05)。
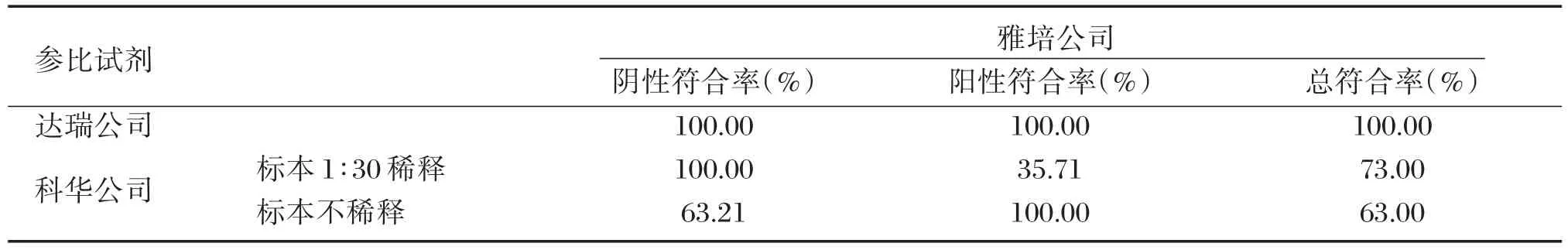
表3 健康查体者的anti⁃HBc检测符合率统计表Table 3 The coincidence rate of anti⁃HBc results of healthy testing groups
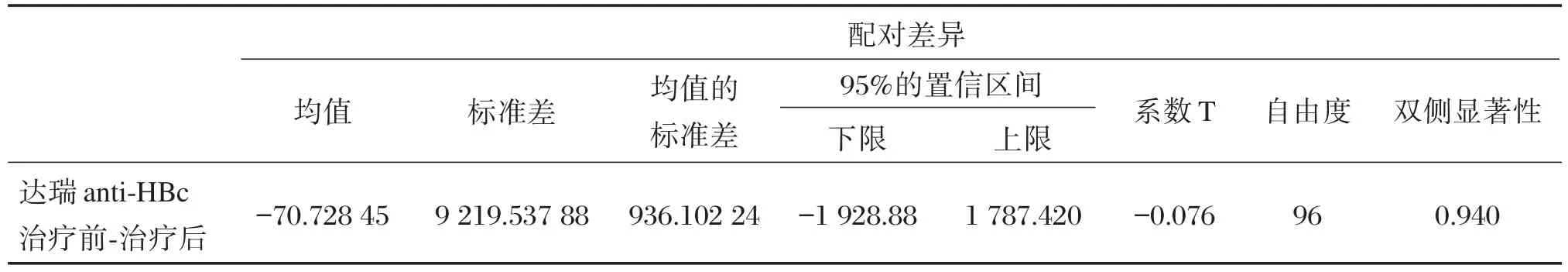
表4 CHB患者治疗前后anti⁃HBc浓度变化配对t检验Table 4 The result of t⁃test pairs of anti⁃HBc before and after treatment of CHB patients
2.2.2 CHB患者治疗前后的HBeAg阳性率变化
采用达瑞HBeAg测定试剂盒对97例CHB患者在抗病毒治疗前后的标本进行测定,统计分析结果见表5。结果显示,97例HBeAg阳性的CHB患者经过治疗后,有11例患者发生了HBeAg血清学转换,即HBeAg变为阴性,血清学转换率为11.34%。
2.2.3 不同anti⁃HBc浓度水平的患者在治疗前后HBeAg阳性率的变化
根据达瑞anti⁃HBc定量试剂盒测定CHB患者治疗前标本的anti⁃HBc浓度水平,将97例CHB患者标本分成anti⁃HBc高浓度(≥9 000 IU/mL)和an⁃ti⁃HBc低浓度(<9 000 IU/mL)两组,对比两组患者的HBeAg血清学转换率,结果显示anti⁃HBc高浓度组(≥9 000 IU/m)的患者经过治疗后,其HBeAg血清学转换率为20.83%;anti⁃HBc低浓度组(<9 000 IU/mL)的患者经过治疗后,其HBeAg血清学转换率为2.04%。经卡方检验,anti⁃HBc高浓度组HBeAg血清学转换率比anti⁃HBc低浓度组的明显增高,具有统计学意义(P<0.05)。结果详见表6、表7所示。
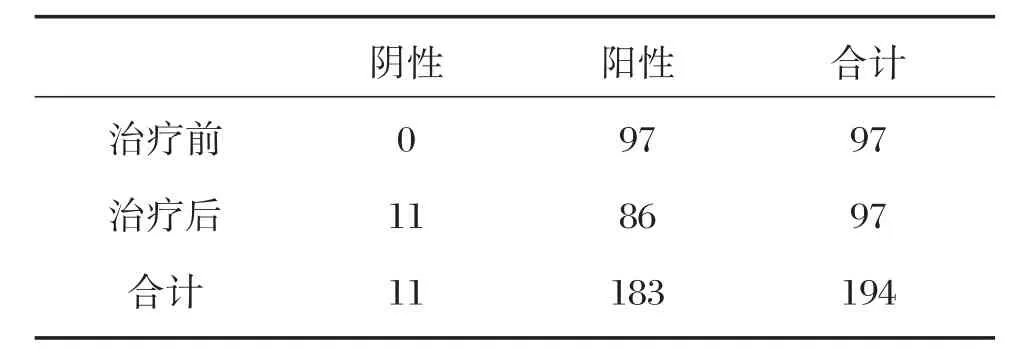
表5 CHB患者治疗前后HBeAg阴阳性的变化情况Table 5 The results of HBeAg before and after treatment of CHB patients

表6 anti⁃HBc高低浓度组间治疗前后HBeAg发生血清学转换的统计Table 6 The results of HBeAg seroconversion between high and low anti⁃HBc concentration groups
3 讨论
HBcAg主要存在于肝细胞内和血清Dana颗粒中,与anti⁃HBc具有很强的亲和力,能迅速结合形成免疫复合物,故难以在血清中测得游离的HBcAg,所以临床上以检测anti⁃HBc来间接反映HBcAg的水平[6]。由于HBcAg较HBV表面抗原有更高的免疫原性,故anti⁃HBc较其他HBV抗体更早产生,并且有更高的血清水平,以及更长久的存在时间,无论肝病是否存在或病毒已否消除,anti⁃HBc 可持续存在数十年,因此 anti⁃HBc 成为了临床诊断HBV与流行病学调查最有价值的血清标志物之一[7]。作为流行病学调查的标志物之一,不同地区、不同年龄段的人群,其anti⁃HBc检测的阳性率均有所差异,此外检测的方法学和试剂,也是影响其检测阳性率的重要因素[8⁃9]。
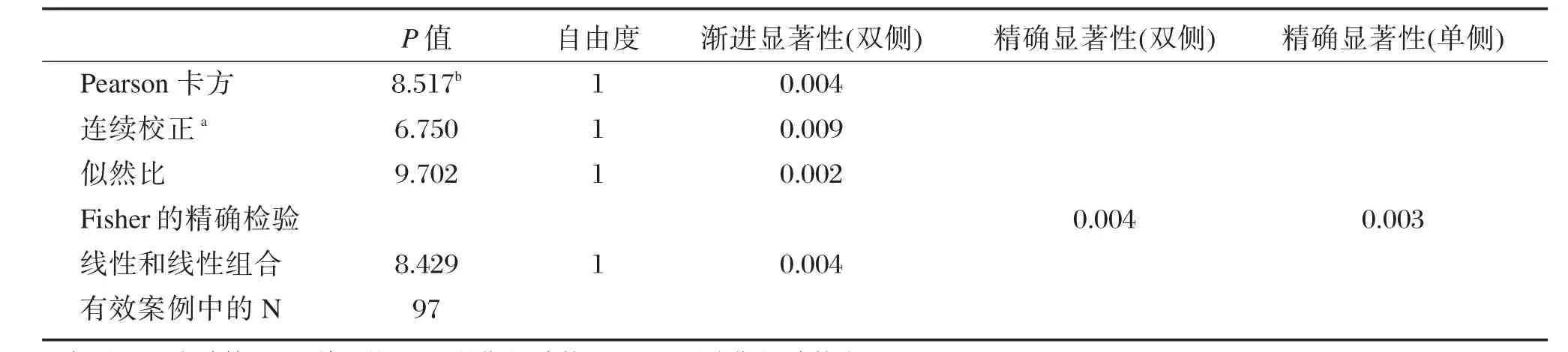
表7 anti⁃HBc高低浓度组间治疗前后HBeAg血清学转换的卡方检验Table 7 The chi⁃square test of HBeAg seroconversion between high and low anti⁃HBc concentration groups
在本次研究中,使用两种CLIA的检测试剂盒、一种ELISA的检测试剂盒,对400例健康查体者的标本进行了anti⁃HBc检测,其中达瑞公司与雅培公司的阳性率均为42.0%,阴阳性符合率为100.0%,说明两家公司anti⁃HBc试剂盒的检测结果符合率高,具有很高的一致性。另外,本研究的实验结果显示,科华公司的ELISA法anti⁃HBc检测试剂盒,其测定不稀释的健康查体者标本时,anti⁃HBc的阳性率为79.0%,比CLIA试剂盒的更高,而测定经过稀释的健康查体者标本时,其阳性率为15.0%,比CLIA 试剂盒的低,该结果与陆盈[10]、汪咏新等[11]等的研究结果一致。以雅培公司的检测结果作为测定anti⁃HBc的金标准,则达瑞公司的检测结果与雅培公司一致,ELISA试剂盒测定不稀释的标本时,假阳性率较高,测定稀释标本时,出现漏检率较高。对于该情况,李金明[12]教授提出一种理论,认为anti⁃HBc的假阳性,可能是由血清(浆)中存在交叉反应性抗体或干扰物质导致的,如前母B淋巴细胞的非特异激活,导致未感染HBV的IgA或IgM相关分子的产生,可能会导致anti⁃HBc假阳性。在这种情况下,使用还原剂,如二硫苏糖醇、重亚硫酸钾和半胱氨酸等预处理血清标本将明显改善anti⁃HBc检测的特异性。其中雅培公司、达瑞公司的anti⁃HBc测定试剂盒,均需要对标本进行预处理,本研究中使用其测定健康查体者的阳性率均为42.0%,明显低于无预处理的ELISA anti⁃HBc试剂盒测定不稀释标本的79.0%,高于测定稀释标本的15.0%。由于雅培公司的检测结果更受国内外市场的认可,故临床上建议选用与雅培公司测值符合率较高的国产CLIA anti⁃HBc试剂盒,以降低ELISA anti⁃HBc试剂盒测定不稀释标本的假阳性率和测定稀释标本的漏检率。
根据《慢性乙型肝炎防治指南》(2015年版)[13]的指导意见,HBeAg阳性患者,药物治疗的满意终点是停药后获得持续的病毒性应答,谷丙转氨酶复常,并伴有HBeAg血清学转换,故本研究对97例CHB患者的anti⁃HBc水平和HBeAg水平进行了跟踪检测,结果显示在抗病毒治疗前后,CHB患者的anti⁃HBc浓度无显著性差异(P>0.05);97例HBeAg阳性的CHB患者经过治疗后,HBeAg血清学转换率为11.34%,anti⁃HBc高浓度(≥9 000 IU/mL)组的HBeAg血清学转换率为20.83%,明显高于anti⁃HBc低浓度(<9 000 IU/mL)组的2.04%,该差异具有统计学意义(P<0.05)。故通过测定HBeAg阳性CHB患者的anti HBc水平,可预测患者抗病毒药物治疗的效果,anti⁃HBc浓度高(≥9 000 IU/mL)的患者,其HBeAg血清学转化率高,抗病毒药物的治疗效果更好;而低浓度anti⁃HBc(<9 000 IU/mL)的患者,HBeAg血清学转化率低,对治疗不敏感。据袁权、Fan 等[1,14⁃16]的报道,在接受ADV和PegIFN治疗的HBeAg阳性病人中,基线anti⁃HBc水平能有效预测治疗后HBeAg血清学转换应答情况,基线anti⁃HBc水平高的病人(ADV治疗病人≥29 000 IU/mL;PegIFN治疗病人≥9 000 IU/mL)较基线anti⁃HBc水平低者治疗后(随访终点)HBeAg血清学转换率更高。该研究结果与本研究的发现一致,本研究进一步验证了anti⁃HBc这一经典HBV血清学指标的定量检测,对HBeAg阳性CHB患者的药物治疗效果有预测作用,对anti⁃HBc的进一步临床应用、CHB患者的治疗和预后观察有着重大的意义。
[1]袁权.隐匿性HBV感染中的HBsAg变异株研究及Anti⁃HBc定量水平的临床新意义探索[D].厦门:厦门大学,2012.
[2]张碧莹,邢延芳,王珍珠,等.血清稀释与否对检测乙型肝炎核心抗体结果的影响[J].中国实验诊断学,2014,18(3):428⁃430.
[3]范殿英,于素芳,韩风文等.乙型肝炎核心抗体在正常人群中的分布及其传染源作用[J].天津医药,1985(6):331⁃334.
[4]张晓琍,王金龙,林光华等.免疫人群乙肝抗体阳性率调查及乙肝核心抗体检测方法探讨[J].中国人兽共患病学报,2015,31(3):289⁃292.
[5]Hui CK,Leung N,Shek TW,et al.Sustained disease remission after spontaneous HBeAg seroconversion is associated with reduction in fibrosis progression in chronic hepatitis B Chinese patients.Hepatology,2007,46:690⁃698.
[6]陈冲,张毅,卓其斌,等.乙型肝炎核心抗体定量检测的研究进展[J]. 肝脏,2016,21(9):781⁃784.
[7]何宗忠,裘宇容.乙型肝炎病毒生物标志物检测的研究进展[J]. 分子诊断与治疗杂志,2009,1(2):135⁃140.
[8]马海芳.1783例乙型肝炎病毒血清学标志物检测结果分析[J]. 医学综述,2010,16(22):3516⁃3517.
[9]张晓琍,王金龙,林光华,等.免疫人群乙肝抗体阳性率调查及乙肝核心抗体检测方法探讨[J].中国人兽共患病学报,2015,31(3):289⁃292.
[10] 陆盈.单项乙型肝炎病毒核心抗体阳性的原因及其临床意义[J]. 海南医学,2013,24(11):1636⁃1638.
[11] 汪咏新,刘军.乙型肝炎病毒核心抗体原倍血清与不同稀释比例对实验结果的影响[J].医学检验与临床,2008,19(4):53⁃54.
[12] 李金明.乙型肝炎病毒血清标志物测定及结果解释的若干问题[J].中华检验医学杂志,2006,29(5):385⁃389.
[13] 中华医学会肝病学分会.慢性乙型肝炎防治指南(2015年版)[J].中国肝脏病杂志:电子版,2015,19(5):1⁃19.
[14] 袁权,宋浏伟,周文彬,等.Anti⁃HBc定量检测方法及其在监控慢性乙肝患者病情发展和预测治疗疗效中的用途:中国,103217533[P].2013⁃07⁃24.
[15] Fan R,Sun J,Yuan Q,et al.Baseline quantitative hep⁃atitis B core antibody titre alone strongly predicts HBeAg seroconversion across chronic hepatitis B pa⁃tients treated with peginterferon or nucleos(t)ide ana⁃logues[J].Gut,2016,65(2):313⁃320.
[16] Yuan Q,Song LW,Cavallone D,et al.Total hepatitis B core antigen antibody,a quantitative non⁃invasive marker of hepatitis B virus induced liver disease[J].PLoS One,2015,26,10(6):e0130209.