以脓血便为首发症状的抗中性粒细胞胞浆抗体相关性血管炎一例报道并文献复习
席月,刘东屏
血管炎是指血管壁的炎症,根据受累血管的类型、大小以及是否有相关的纤维素样坏死和/或肉芽肿形成,血管炎可分为不同类型[1],其中抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAV)是一组累及多系统的寡免疫复合物型小血管炎,表现为血液中可检测出ANCA、小血管存在坏死性炎性反应。据报道,AAV年发病率约为20/200万,自然病程病死率高,预后差,5年病死率约为25%[2]。AAV可累及全身血管及器官,临床表现复杂且缺乏特异性,不易于临床明确诊断。血管炎胃肠道表现少见并且具有非特异性,但如果胃肠道主要血管严重受累(穿孔、肠缺血、溃疡)可出现危及生命的情况。故早期诊断和治疗AAV对提高患者长期生存率至关重要。本文报道了中国医科大学附属第一医院收治的1例以脓血便为首发症状的AAV患者,本例患者症状易与消化内科疾病溃疡性结肠炎混淆,特报道如下,以提高临床医生对血管炎导致的胃肠道病变的认识。
本文创新点:
本文报道了1例以胃肠道表现为首发症状的血管炎的诊治经过,通过文献复习,对抗中性粒细胞胞浆抗体(ANCA)相关性血管炎的病理机制、临床症状、治疗进行讨论,以提高临床医师对ANCA相关性血管炎胃肠道表现的认识。尤其需要与溃疡性结肠炎及其肠外表现进行鉴别。有助于促进风湿免疫、消化交叉学科疾病的诊治。
1 病例简介
患者,女,57岁,因间断腹泻伴黏液脓血便3年,加重伴皮肤破溃1个月于2016-06-24收住院。患者3年前出现无明显诱因腹泻,5~6次/d,水样便,附着鲜血及脓液,不伴腹痛,于当地医院行肠镜检查提示“结肠炎,结肠息肉”,给予结肠散剂、康复新灌肠治疗后好转,此后间断发作,每于着凉后症状加重,每次灌肠治疗后均好转。1年前再次出现便次增多,7~8次/d,黏液脓血便伴腹痛;1个月前上述症状加重,同时出现左足及右胫前皮肤破溃,伴有发热寒战,于中国医科大学附属盛京医院行肠镜检查(见图1):进镜至距肛门16 cm处时局部管腔狭窄,镜身无法继续通过,肠镜检查示大肠黏膜充血破溃,散在息肉样隆起,表面被覆薄白苔,取病理组织4块,质地脆,触之极易出血。病理提示:肠溃疡性病变伴淋巴细胞增生。对症治疗后患者症状略好转。出院后黏液脓血便、腹痛症状再次加重,同时皮肤破溃进一步扩大,因病情加重来本院就诊。
查体:体温36.8 ℃,脉搏76次/min,血压105/45 mm Hg(1 mm Hg=0.133 kPa),意识清晰,心肺未见异常,腹平坦,腹软,无压痛、反跳痛及肌紧张。左足背及左侧外踝部皮肤可见一处溃疡,大小为10 cm×10 cm,基底见新鲜肉芽组织,上覆少量黄色脓性分泌物,边界清楚(见图2)。右胫前可见7 cm×8 cm的皮肤破损,红肿、散在小溃疡,覆白苔,部分变黑,中间可见2 cm×3 cm的溃疡,基底覆新鲜肉芽组织(见图2)。双下肢及双足明显凹陷性水肿。
血常规:白细胞计数(WBC) 6.96×109/L,中性粒细胞分数(NE%)0.541,红细胞计数(RBC)3.45×1012/L,血红蛋白(Hb)95 g/L,血小板计数(PLT) 418×109/L。肝功能:总蛋白(TP)47.5 g/L,清蛋白(ALB)19.9 g/L。离子:K+ 2.60 mmol/L,Ca2+ 1.83 mmol/L。凝血四项:纤维蛋白原(Fg)5.12 g/L,凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、国际标准化比值(INR)正常。红细胞沉降率56 mm/1 h。C反应蛋白116.00 mg/L。

图 1 肠镜结果Figures 1 Results of intestinal endoscopic examination

图 2 患者入院时下肢溃疡表现Figures 2 Lower limb ulcers of the patient upon admission
血清降钙素原(PCT)0.23 ng/ml。血清蛋白电泳:Alb 34.5%,α1球蛋白9.4%,α2球蛋白16.4%,γ球蛋白25%。核周型ANCA(pANCA)阳性。抗蛋白酶3抗体(PR3-ANCA)阳性。抗核抗体(ANA)++1:80。感染结核T细胞斑点试验:阳性,A孔9,B孔21。结核菌素试验(PPD)硬结6 mm×6 mm。
便常规:白细胞360个/高倍视野,红细胞56个/高倍视野。便隐血试验:阳性。粪便球菌:粪便杆菌=1:5。尿常规:潜血微量,酮体微量,尿比重(SG) 1.011,红细胞6.8/高倍速视野,白细胞14.49/高倍视野。
尿系列:正常形态红细胞80%。血清肿瘤标志物、补体C3、补体C4、免疫球蛋白、抗心磷脂抗体、结明试验、人类免疫缺陷病毒(HIV)、梅毒未见异常。
全腹增强CT(64排):升结肠管壁略增厚,浆膜面毛糙,增强扫描可见强化(见图3)。肺CT平扫(64排):双肺下叶间质改变,双肺及胸膜陈旧病变。肠系膜上下动脉非创伤性血管成像技术(CTA)(64排):未见异常。四肢深静脉彩超:左侧小腿肌间静脉血栓形成可能性大。
内镜检查:(2013-05-06,当地医院)电子肠镜:横结肠距肛缘约50 cm可见一枚无蒂息肉,大小为0.4 cm×0.4 cm,表面光滑,质软,取材1块,乙状结肠距肛缘约20 cm至直肠可见黏膜呈弥漫性充血水肿糜烂,触之易出血。直肠黏膜弥漫性充血水肿糜烂,质脆,易出血,取材2块,距肛缘约7 cm直肠右侧壁可见一空洞样改变。病理检查示:横结肠腺瘤,直肠慢性炎症。
皮肤病理检查示:真皮全层溃疡,结脓痂,皮下浅层见中等大小血管管壁纤维素样坏死,管壁中性粒细胞浸润(见图4)。病理检查示:溃疡,血管炎。皮肤溃疡处分泌物结核分枝杆菌DNA检测阴性。
诊治经过:患者主因“间断腹泻伴黏液脓血便3年,加重伴皮肤破溃1个月”入院,pANCA及PR3-ANCA阳性,皮肤病理提示血管管壁纤维素样坏死,诊断考虑为血管炎,但需与溃疡性结肠炎及肠外表现坏疽性脓皮病相鉴别,溃疡性结肠炎表现为反复发作性黏液脓血便、腹痛,可伴有坏疽性脓皮病,肠镜表现为从直肠开始的弥漫性病变,黏膜成颗粒状,质脆易出血,结肠袋消失为其典型表现,黏膜活检病理检查示隐窝炎、隐窝脓肿可帮助诊断。
诊断明确并排除活动性结核可能,在抗感染基础上应用激素治疗,醋酸泼尼松片30 mg,1次/d口服,辅以抑酸、补钙及促进钙吸收治疗。同时应用人免疫球蛋白20 g,1次/d静脉滴注(连续3 d)抗感染及封闭抗体治疗。并予以美沙拉秦肠溶片1.0 g/次,1次/6 h口服治疗肠道溃疡,拜瑞妥15 mg,1次/d口服抗血栓。1周后患者黏液脓血便消失,腹痛较前好转,皮肤溃疡好转出院。1个月后门诊复查,皮肤溃疡面积逐渐缩小,部分愈合(见图5)。6个月后,醋酸泼尼松片逐渐减量至10 mg/d,无脓血便,无腹痛,皮肤溃疡进一步愈合(见图6)。

图 4 皮肤病理结果(HE染色)Figure 4 Pathological results of skin biopsy

图 3 全腹增强CT检查结果Figure 3 Abdominal CT manifestations
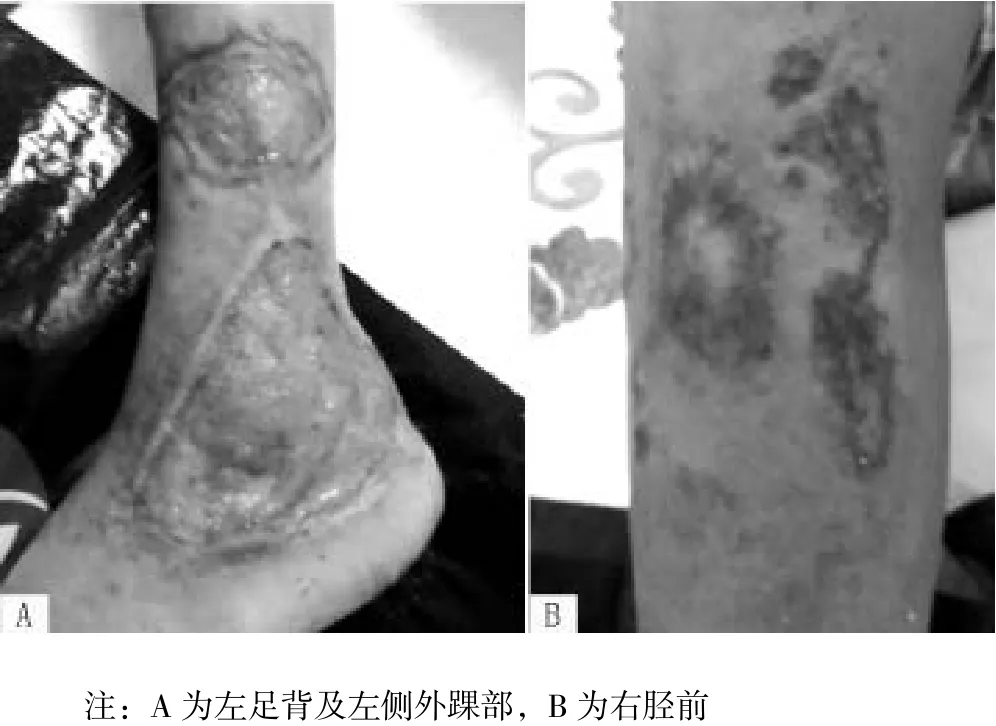
图 5 患者出院1个月后下肢溃疡表现Figures 5 Lower limb ulcers of the patient1 month after discharge
2 讨论
2.1 本文研究背景及目的 AAV发病率低,病死率高,预后差,且临床症状不典型,易被临床医生忽视,本文报道的患者以腹泻、黏液脓血便为首发症状,肠镜表现为直肠、乙状结肠(距肛缘20 cm)黏膜弥漫性充血水肿糜烂,肠道症状时轻时重持续3年,直至皮肤出现溃烂,进行相应的免疫检查才确诊,因此有必要建议临床医生警惕肠道反复发生的充血、糜烂,炎性息肉,溃疡,以提高临床医生对血管炎导致的肠道病变的认识。

图 6 患者出院6个月后下肢溃疡表现Figure 6 Lower limb ulcers of the patient6 months after discharge
2.2 分类及发病机制 根据Chapel Hill会议Chapel Hill Consensus Conference(CHCC)2012分类方法[3],可将AAV分为肉芽肿性血管炎(GPA)、显微镜下多血管炎(MPA)、嗜酸性肉芽肿性血管炎(EGPA)和单器官损害ANCA相关性血管炎[4]。AAV一般好发于中老年人,目前病因及发病机制尚未完全阐明[5]。
目前普遍认为AAV的发病与环境、感染、遗传、ANCA及细胞免疫等多个因素相关。ANCA是系统性坏死性血管炎的血清学特征性抗体之一,其主要靶抗原为蛋白酶-3(PR3)和髓过氧化物酶(MPO)。AAV与ANCA密切相关,GAP多与PR3相关,MPA多与MPO相关[6]。约50%的EGPA患者ANCA阳性,且大多是MPO-ANCA,其主要临床表现是小血管炎,而ANCA阴性亚组的主要临床表现为嗜酸粒细胞的组织浸润[7]。临床观察以及体外和体内研究均提示ANCA参与AAV的发病机制;体外研究表明,ANCA 可刺激中性粒细胞释放细胞因子,从而诱导中性粒细胞产生脱颗粒作用,促使氧自由基和裂解酶释放,最终导致血管内皮细胞裂解、破坏[8]。动物模型体内研究显示,通过把小鼠抗MPO免疫球蛋白G(IgG)注入正常的野生型小鼠,可能导致坏死性新月体性肾小球肾炎[9]。但与GPA相关的PR3-ANCA动物模型研究目前不太成功。
2.3 胃肠道表现 20%~30%的AAV患者出现胃肠道受累[4],引起局部或弥漫性的消化道病理改变,如溃疡、黏膜下水肿、出血、麻痹性肠梗阻、肠系膜缺血、穿孔等[10]。变应性肉芽肿性血管炎(Churg-Strauss综合征,CSS,2012年Chapel Hill会议上更名为EGPA)的消化道症状可出现与嗜酸粒细胞胃肠炎相关的腹痛和腹泻[11]。肠系膜血管受累可导致消化道溃疡、缺血、穿孔。在AAV(包括GPA、MPA、EGPA)中,消化道受累可增加CSS患者的复发风险[12]。1996年设计的用于预后评价的五因素评分(FFS)基于5项指标:严重血管炎相关性消化道表现,中枢神经系统表现,和/或心肌病,血清肌酐>140μmmol/L,和/或蛋白尿>1 g/24 h[13]。用于EGPA的修订版FFS为:严重血管炎相关性消化道表现,和/或心脏表现,血清肌酐>150 μmmol/L,年龄>65岁,和/或无耳鼻咽喉症状[14]。韦格纳肉芽肿(Wegener's granulomatosis,WG,2012年Chapel Hill会议上更名为GPA)的消化道症状包括吞咽痛、腹痛、恶心、呕吐、腹泻和消化道出血,可出现穿孔或缺血,并引起腹膜炎体征[15]。有研究表明10%~24%的WG患者可出现胃肠道受累[16],另外消化道受累一般在首发症状出现很久之后才发生[17]。MPA的胃肠道表现较多见,腹痛占30%~58%,消化道出血占29%[18-20],也可表现为食管反流、肝功能异常、胰腺坏死和结肠溃疡等。在PAGNOUX等[1]的研究中,系统性坏死性血管炎患者的消化道症状与其他系统受累相关,包括周围神经(61%)、心脏(10%)、肾脏(37%)、皮肤(44%)或肺部(19%)受累等。
由于炎症性肠病与AAV相关性缺血可以引起相似的临床症状,因此诊断很困难,HUMBERT等[4]认为在有消化道表现的AAV患者中应该评估是否有炎症性肠病的可能。同理,炎症性肠病患者同时存在肠外表现时也应考虑是否为AAV所致多系统受累。本例AAV患者,先出现消化道症状(腹泻、腹痛、黏液脓血便),持续约3年后出现双下肢难治性皮肤溃疡,其临床表现应与溃疡性结肠炎及其肠外表现坏疽性脓皮病相鉴别。入院后行免疫相关检查及皮肤活检最终明确诊断为血管炎。
对于胃肠道受累的血管炎,内镜检查时重要的特征是缺血性小肠结肠炎和溃疡。据以往报道,消化道受累的系统性血管炎内镜下活检诊断的灵敏度很低[21],而LATUS等[22]的研究再次证明了这一点。CT表现包括肠壁增厚所致靶征和肠系膜血管充血所致梳征[23]。内镜知识以及胃肠道影像学表现可以帮助医生早期诊断,并建立治疗方案。
2.4 治疗 目前血管炎的基本治疗药物为糖皮质激素(GCs),酌情加用免疫抑制剂、生物制剂。其治疗分为诱导缓解和维持治疗两个阶段。AAV治疗的关键目标是实现快速和持久的缓解病情且不良反应最小。当选择应用诱导缓解疾病活动的初始治疗方案时,临床医生必须决定是否应用GCs静脉给药冲击治疗,GCs的起始剂量以及口服GCs如何减量,以维持治疗效果和不良反应之间的平衡。然而目前尚未有AAV诱导缓解治疗中GCs给药量的共识及GCs减量方案。KALLENBERG等[24]通过文献复习发现,无论治疗方案是否包括GCs静脉冲击治疗,口服类固醇方案均以1.0 mg ·kg-1·d-1开始,通常第1个月减量至30~40 mg/d,3个月减至10~20 mg/d。进一步减量的速度主要取决于GCs治疗的持续时间。
目前关于血管炎相关消化道表现研究较少,缺乏大样本研究。本病例报道有助于提高临床医生对消化道受累的血管炎的认识,临床医生应树立系统性疾病的思维,不能观局部而忘全身。AAV的病理机制及个体化治疗仍需进一步探索。
作者贡献:席月进行研究设计与实施、资料收集整理、撰写论文并对文章负责;刘东屏进行质量控制及审校。
本文无利益冲突。
[1]PAGNOUX C,MAHR A,COHEN P,et al.Presentation and outcome of gastrointestinal involvement in systemic necrotizing vasculitides:analysis of 62 patients with polyarteritis nodosa, microscopic polyangiitis,Wegener granulomatosis,Churg-Strauss syndrome,or rheumatoid arthritis-associated vasculitis[J].Medicine(Baltimore),2005,84(2):115-128.DOI:10.1097/01.md.0000158825.87055.0b.
[2]毕礼明,王朝晖,俞海瑾.对ANCA相关性血管炎的认识和争议[J].医学争 鸣 ,2016,7(2):60-63. DOI:10.13276/j.issn.1674-8913.2016.02.017.BI L M,WANG Z H,YU H J.Antineutrophil cytoplasm antibodyassociated vasculitis:understandings and controversies[J].Negative,2016,7(2):60-63.DOI:10.13276/j.issn.1674-8913.2016.02.017.
[3]JENNETTE J C,FALK R J,BACON P A,et al.2012 revised international chapel hill consensus conference nomenclature of vasculitides[J].Arthritis Rheum,2013,65(1):1-11. DOI:10.1002/art.37715.
[4]HUMBERT S,GUILPAIN P,PUÉCHAL X,et al.Inflammatory bowel diseases in anti-neutrophil cytoplasmic antibody-associated vasculitides:11 retrospective cases from the French Vasculitis Study Group[J].Rheumatology (Oxford),2015,54(11):1970-1975.DOI:10.1093/rheumatology/kev199.
[5]BONATTI F,REINA M, NERI T M,et al.Genetic susceptibility to ANCA-associated vasculitis:state of the art[J].Front Immunol,2014,5:577.DOI:10.3389/fimmu.2014.00577.
[6]王诚,钟清.ANCA相关性血管炎发病机制及相关研究进展[J].现 代 医 药 卫 生 ,2016,32(15):2339-2342.DOI:10.3969/j.issn.1009-5519.2016.15.023.WANG C,ZHONG Q.Antineutrophil cytoplasm antibody-associated vasculitis: pathogenesis and research progress[J].Modern Medicine Health,2016,32(15):2339-2342.DOI:10.3969/j.issn.1009-5519.2016.15.023.
[7]KELLER S F,MILOSLAVSKY E M.Corticosteroids in antineutrophil cytoplasmic Antibody-associated vasculitis[J].Rheum Dis Clin North Am,2016,42(1):91-101.DOI:10.1016/j.rdc.2015.08.010.
[8]SCHREIBER A,KETTRITZ R.The neutrophil in antineutrophil cytoplasmic autoantibody-associated vasculitis[J].J Leukoc Biol,2013,94(4):623-631.DOI:10.1189/jlb.1012525.
[9]ROWAIYE O O,KUSZTAL M,KLINGER M.The kidneys and ANCA-associated vasculitis:from pathogenesis to diagnosis[J].Clin Kidney J,2015,8(3):343-350.DOI:10.1093/ckj/sfv020.
[10]HA H K,LEE S H,RHA S E,et al.Radiologic features of vasculitis involving the gastrointestinal tract[J].Radiographics,2000,20(3):779-794.DOI:10.1016/j.ejor.2006.07.002.
[11]HOKAMA A,KINJO F,HIRATA T.Image of the month.Churg-Strauss syndrome[J].Gastroenterology,2004,126(3):642,945.
[12]PAVONE L,GRASSELLI C,CHIERICI E,et al.Outcome and prognostic factors during the course of primary small-vessel vasculitides[J].J Rheumatol,2006,33(7):1299-1306.
[13]GUILLEVIN L,LHOTE F,GAYRAUD M,et al.Prognostic factors in polyarteritis nodosa and Churg-Strauss syndrome: a prospective study in 342 patients[J].Medicine (Baltimore),1996,75(1):17-28.
[14]GUILLEVIN L,PAGNOUX C,SEROR R,et al.The French Vasculitis Study Group (FVSG).The Five-Factor Score revisited:assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group (FVSG) cohort[J].Medicine (Baltimore),2011,90(1):19-27.DOI:10.1097/MD.0b013e318205a4c6.
[15]DEGER S M,SAHIN T,VURAL C,et al.Wegener's granulomatosis with massive gastrointestinal hemorrhage due to jejunal and colonic involvement:report of a case[J].Surg Today,2008,38(2):166-169.DOI: 10.1007/s00595-007-3574-9.
[16]FAUCI A S, KATZ H B F, WOLFF P,et al.Prospective clinical and therapeutic experience with 85 patients for 21 years[J].Ann Intern Med,1983,98(1):76-85.
[17]STEELE C,BOHRA S,BROE P,et al.Acute upper gastrointestinal haemorrhage and colitis: an unusual presentation of Wegener's granulomatosis[J].Eur J Gastroenterol Hepatol,2001,13(8):993-995.
[18]SPAHN T W,ULLERICH H J,LETITZ P,et al.Gastrointestinal bleeding secondary to hepatic artery involvement of microscopic polyangiitis:case report and review of the literature[J].Digest Dis Sci,2007,52(6):1558-1561.DOI:10.1007/s10620-006-9267-1.
[19]UEDA S,MATSUMOTO M,AHN T,et al.Microscopic polyangiitis complicated with massive intestinal bleeding[J].J Gastroenterol,2001,36(4):264-270.DOI:10.1007/S005350170114.
[20]KOMANDURI S,JAKATE S,KESHAVARZIAN A.Focal rectal capillaritis:microscopic polyangiitis presenting as painless rectal bleeding[J].J Clin Gastroenterol,2002,35(2):157-159.DOI:10.1039/b905841a.
[21]VALLAT M,VALLAT J M,JULIEN J,et al.Periarteritis nodosa with fatal liver and gallbladder involvement.Arteriographic aspects[J].Sem Hop,1977,53(36):1953-1954.
[22]LATUS J,KOETTER I,FRITZ P,et al.Gastrointestinal involvement in granulomatosis with polyangiitis and microscopic polyangiitis:histological features and outcome[J].Int J Rheum Dis,2014,17(4):412-419.DOI: 10.1111/1756-185X.12203.
[23]HOKAMA A,KISHIMOTO K,IHAMA Y,et al.Endoscopic and radiographic features of gastrointestinal involvement in vasculitis[J].World J Gastrointest Endosc,2012,4(3):50-56.DOI:10.4253/wjge.v4.i3.50.
[24]KALLENBERG C G.Churg-Strauss syndrome: just one disease entity?[J].Arthritis Rheum,2005,52(9):2589-2593.DOI:10.1002/art.21253.

