低分子量肝素对恶性肿瘤合并静脉血栓栓塞症患者生存影响的Meta分析
钟绿,汤绍辉
低分子量肝素(LMWH)是由普通肝素解聚制备而成的一类分子量较低的肝素的总称[1]。常见的LMWH有依诺肝素钠、那屈肝素钙、达肝素钠及亭扎肝素等[2]。LMWH具有很高的抗凝血因子Ⅹa活性和较低的抗凝血因子Ⅱa活性,保留了普通肝素的抗血栓作用而降低了出血的风险[3]。目前LMWH广泛应用于预防与治疗肺栓塞(PE)和深静脉血栓形成(DVT)以及不稳定性冠状动脉疾病、缺血性脑卒中、肾病综合征等疾病[1-3]。
静脉血栓栓塞症(venous thromboembolism,VTE)是恶性肿瘤的常见并发症之一,一般包括DVT和PE。恶性肿瘤细胞表达组织因子或其他促凝物质,可直接激活凝血酶原[4]。此外,肿瘤细胞释放血管通透因子或血管内皮细胞生长因子,使微血管通透性增加,促凝因子进入血管激活全身凝血过程。恶性肿瘤组织坏死后还可产生大量内源性和外源性的凝血活酶,促进血栓形成[5-7]。因此恶性肿瘤患者凝血系统常被激活而处于高凝状态,这不仅容易导致VTE的发生,而且还有利于肿瘤的生长和转移[8]。部分恶性肿瘤患者在疾病的早期即可出现DVT,而到了疾病的进展期VTE发生率明显升高,但不同类型的恶性肿瘤患者VTE发生率有明显差异。研究显示,脑、卵巢、胰腺、结肠、胃、肺以及肾脏的恶性肿瘤VTE 发生率较高[9]。
为了探讨LMWH在恶性肿瘤患者中的治疗效果,有学者进行了一项临床随机对照试验(randomized controlled trial,RCT):385例不同类型的进展期实体瘤患者(入组时均未发现血栓事件),随机接受12个月的LMWH(LMWH预防性抗凝组)或者安慰剂(相等量的0.9%氯化钠溶液,对照组)治疗,结果显示LMWH预防性抗凝组患者生存率高于对照组[10]。部分学者为了进一步比较LMWH与其他抗凝药物在恶性肿瘤合并VTE患者中的治疗效果,进行了相关探索。LEE等[11]将恶性肿瘤合并VTE患者进行了RCT,该研究结果表明,对合并有VTE的恶性肿瘤患者,LMWH治疗可能带来一定的生存获益。但是随后CONTI等[12]研究结果显示,LMWH降低恶性肿瘤合并VTE患者病死率的疗效并不优于口服抗凝药物。由此可见,与其他抗凝药物相比,LMWH的疗效优势还存在争议。鉴于此,本研究运用循证医学方法,充分检索相关文献,探讨LMWH对恶性肿瘤合并VTE患者生存的影响,为临床上LMWH在恶性肿瘤患者抗凝治疗中的应用提供较可靠的证据。
1 资料与方法
1.1 检索策略 采用计算机检索PubMed、EMBase、Web of Science、The Cochrane Central Register of Controlled Trials、 中国知网、维普网、万方数据知识服务平台等数据库有关使用LMWH对恶性肿瘤合并VTE患者进行抗凝治疗的RCT,检索时间截至2015年2月。英文检索词包括low molecular weight heparin、venous thromboembolism、anticoagulants、cancer、malignancy、survival、mortality、effect;中文检索词包括低分子量肝素、静脉血栓、血栓性疾病、抗凝治疗、癌症、恶性肿瘤、生存率、病死率、疗效等。对综述性文献的参考文献进行二次检索。
1.2 文献纳入与排除标准 纳入标准:(1)RCT,设立平行对照,研究文献为全文,语种为中文或英文。(2)研究对象:合并有VTE的实体瘤患者。(3)干预措施:研究组给予LMWH,对照组给予普通肝素、维生素K拮抗剂及其他非低分子量肝素抗凝药物(Non-LMWH)。排除标准:(1)非RCT或Jadad评分<3分的RCT;(2)未提供患者结局或测量方法的试验;(3)综述;(4)重复报道。
1.3 数据提取 提取的数据包括发表信息(第一作者、发表时间);受试对象(样本量、性别、年龄、疾病组成);治疗方案(研究组和对照组干预措施、观察时间、主要观察结果)。
1.4 质量评价 主要根据Jadad评分标准(总分为5分,≥3分为高质量研究),从随机方法、盲法以及随访3个方面进行质量评价。
1.5 统计学方法 采用Cochrane协作网提供的RevMan 5.0版软件进行数据统计分析。采用I2检验和P值对纳入文献进行统计学异质性分析,当P≥0.1和I2≤50%时,表示各研究间无统计学异质性,采用固定效应模型进行分析;若P<0.1和I2>50%,表示各研究间存在统计学异质性,对异质性来源进行分析,若异质性仍较大,则采用随机效应模型进行分析。分类变量以相对危险度(RR)表示,区间估计均采用95%可信区间(95%CI)。以P<0.05为差异有统计学意义。
2 结果
2.1 纳入文献情况 共检索到国内外相关文献1 566篇,阅读文献题目、摘要以及全文后,共29篇[11,13-40]文献涉及29个RCT纳入本研究。共纳入4 346例恶性肿瘤合并VTE患者,其中研究组2 175例,对照组2 171例,文献筛选流程图见图1,纳入研究的基本特征见表1。
2.2 纳入文献质量评价 本研究纳入的文献有2篇[14,28]Jadad 评分为 5 分,有 4 篇[18,29,35,38]Jadad 评分为 4 分,其余试验[11,13,15-17,19-27,30-34,36-37,39-40]Jadad 评分均为 3 分,均达到高质量文献标准,各纳入研究的方法学质量评分详见表2。
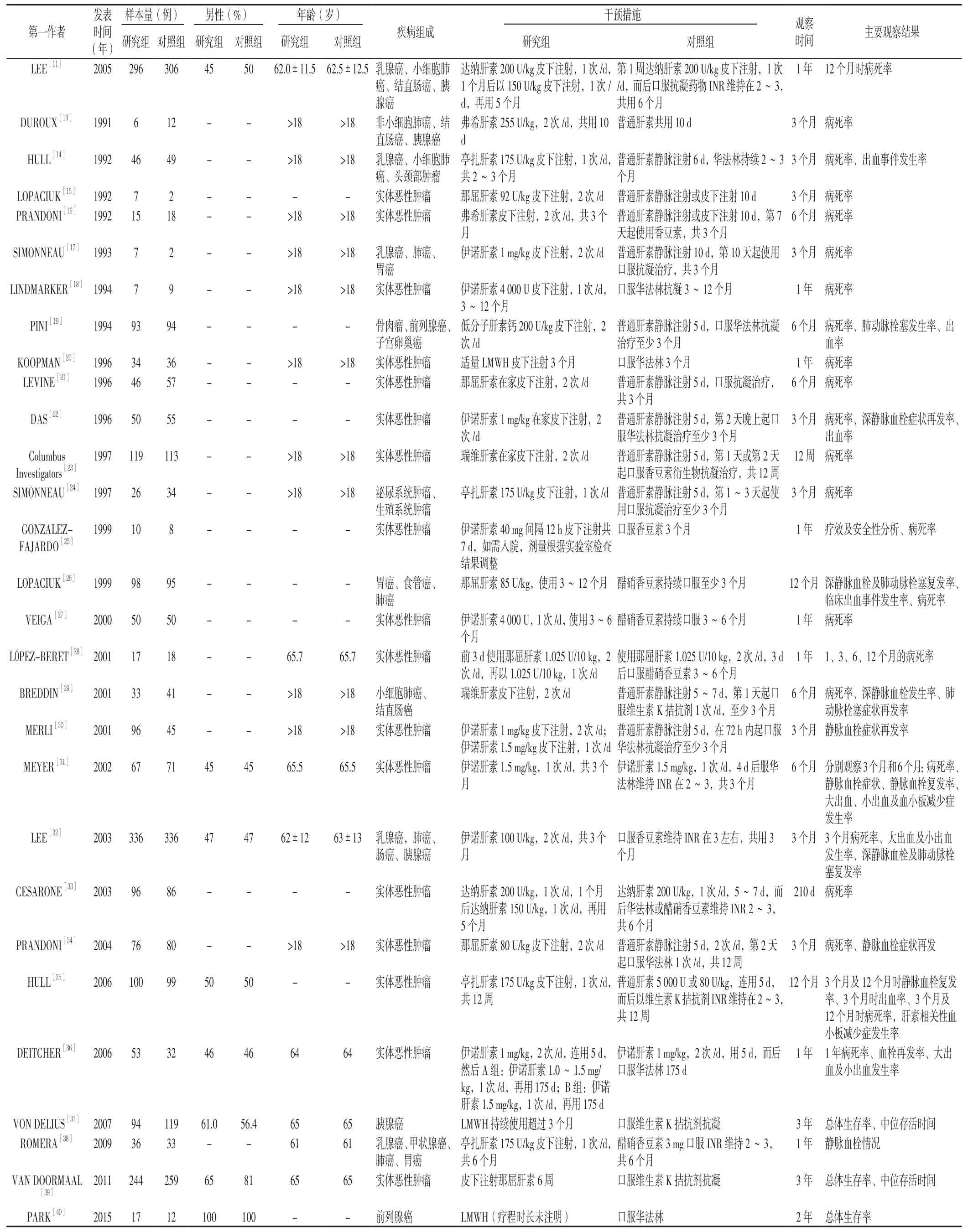
表1 纳入文献的基本特征Table 1 General characteristics of the included studies
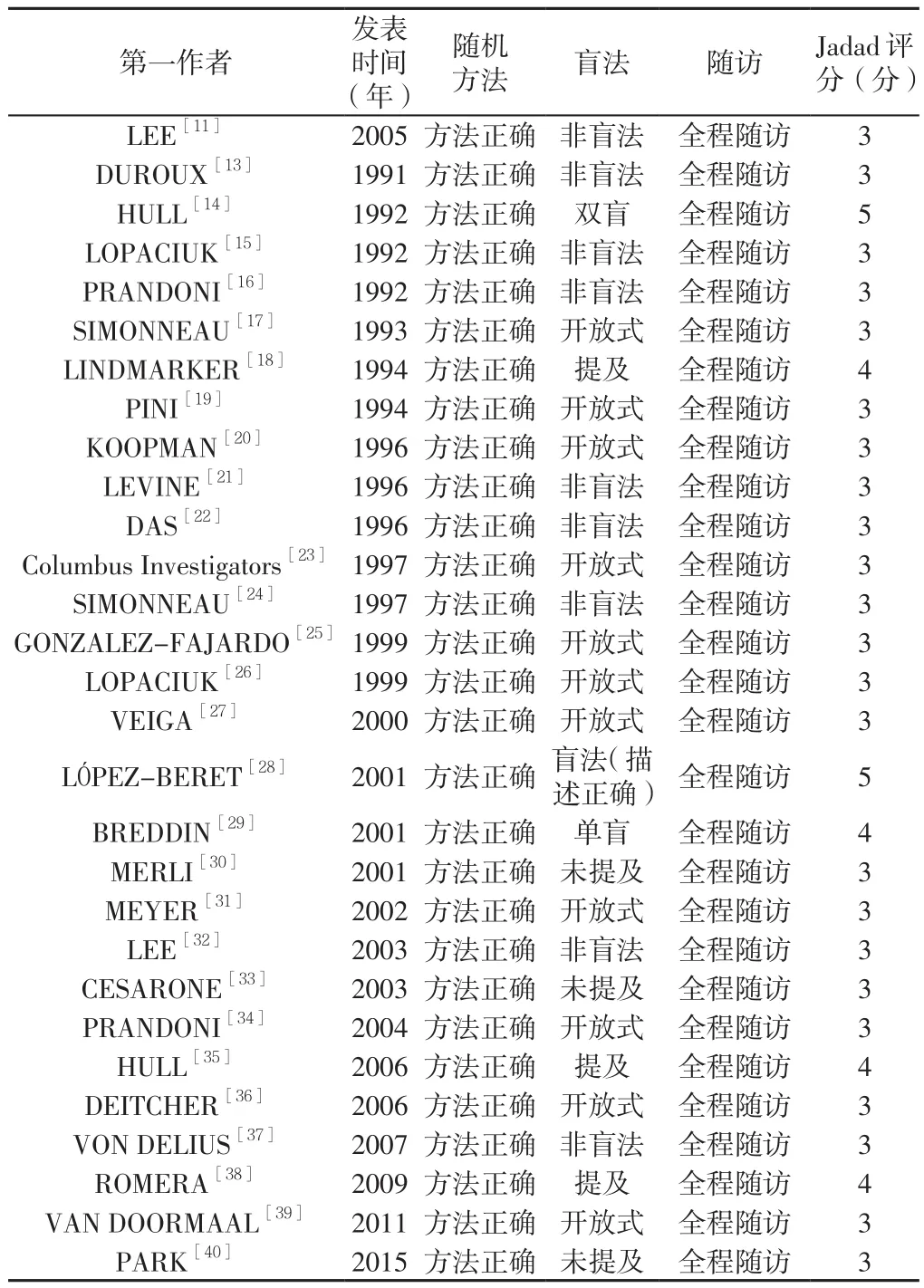
表2 纳入文献的质量评分Table 2 Jadad scores of the included studies
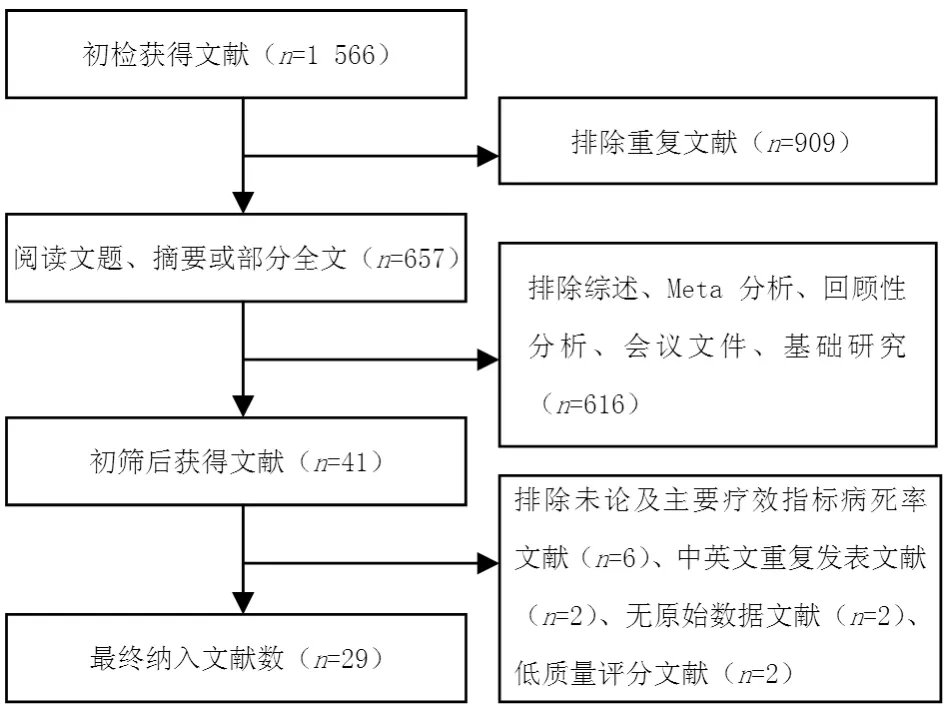
图1 纳入文献筛选流程图Figure 1 Flow chart of literature screening
2.3 Meta分析结果
2.3.1 病 死 率 27 篇[11,13-29,31-37,39-40]文献对 比 了 病死率,异质性检验结果显示各研究间无统计学异质性(I2=0,P=0.80),采用固定效应模型。Meta分析结果显示,研究组与对照组患者病死率比较,差异无统计学意义〔RR=0.94,95%CI(0.87,1.01),P=0.08,见图 2〕。
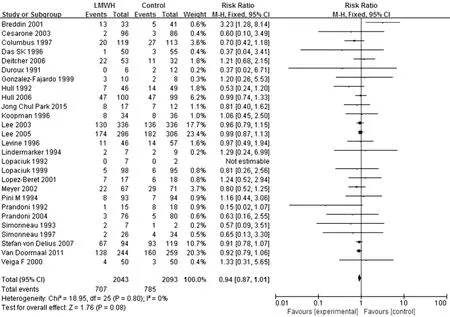
图2 研究组与对照组患者病死率比较的森林图Figure 2 Forest plot of the mortality of the study group versus the control group
根据对照组治疗方法分成4个亚组进行进一步分析,对照组为口服维生素K拮抗剂治疗的文献有9篇[18,20,25-27,32,37,39-40],对照组为普通肝素 + 口服维生素 K 拮抗剂序贯治疗的文献有 11 篇[14,16-17,19,21-24,29,34-35],对照组为LMWH+口服维生素K拮抗剂序贯治疗的文献有5篇[11,28,31,33,36],对照组为普通肝素的文献有 2 篇[13,15],因其中 1篇[15]治疗组和对照组的死亡人数均为零,故数据未能有效合成,未再进行亚组分析。3个亚组异质性检验结果显示各研究间无统计学异质性(I2=0,P=1.00;I2=34%,P=0.13;I2=0,P=0.76),均采用固定效应模型。Meta分析结果显示,研究组与口服维生素K拮抗剂亚组患者病死率比较,差异无统计学意义〔RR=0.93,95%CI(0.85,1.03),P=0.16,见图3〕;研究组与普通肝素+口服维生素K拮抗剂序贯治疗亚组患者病死率比较,差异无统计学意义〔RR=0.88,95%CI(0.71,1.08),P=0.23,见图4〕;研究组与LMWH+口服维生素K拮抗剂序贯治疗亚组患者病死率比较,差异无统计学意义〔RR=0.98,95%CI(0.86,1.11),P=0.75,见图 5〕。
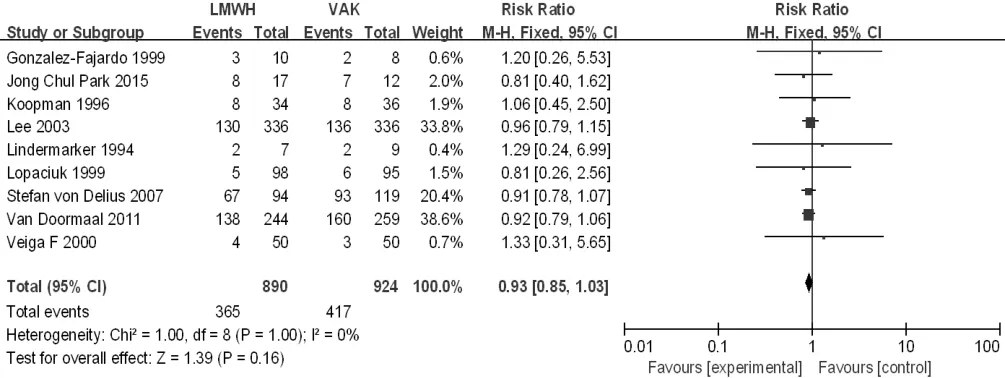
图3 研究组与口服维生素K拮抗剂亚组患者病死率比较的森林图Figure 3 Forest plot of the mortality of the study group versus the oral VKA subgroup
根据研究组LMWH抗凝治疗时间长短分成≤3个月亚组及>3个月亚组进行进一步分析,≤3个月亚组文献有14篇[13-17,20-21,23,25,31-32,34-35,39],>3 个月亚组文献有 12 篇[11,18-19,22,24,26-29,33,36-37],其中有 1 篇[40]抗凝治疗时间文献中未提及,未纳入亚组分析。2个亚组异质性检验结果显示各研究间无统计学异质性(I2=0,P=0.78;I2=0,P=0.52),均采用固定效应模型。Meta分析结果显示,≤3个月亚组患者病死率较对照组降低,差异有统计学意义〔RR=0.89,95%CI(0.80,0.99),P=0.02,见图6〕;>3个月亚组与对照组患者病死率比较,差异无统计学意义〔RR=1.01,95%CI(0.91,1.12),P=0.91,见图7〕。
2.3.2 血栓复发率 11 篇[19,22,26,29-32,34-36,38]文献对比了血栓复发率,异质性检验结果显示各研究间无统计学异质性(I2=40%,P=0.08),采用固定效应模型。Meta分析结果显示,研究组患者血栓复发率较对照组降低,差异有统计学意义〔RR=0.67,95%CI(0.51,0.89),P=0.005,见图8〕。
2.3.3 大出血发生率 8 篇[14,19,22,26,31-32,35-36]文献对比了大出血发生率,异质性检验结果显示各研究间无统计学异质性(I2=47%,P=0.07),采用固定效应模型。Meta分析结果显示,研究组与对照组患者大出血发生率比较,差异无统计学意义〔RR=0.76,95%CI(0.51,1.13),P=0.18,见图9〕。
2.3.4 小出血发生率 6 篇[14,26,31-32,35-36]文献对比了小出血发生率,异质性检验结果显示各研究间有统计学异质性(I2=65%,P=0.01),采用随机效应模型。Meta分析结果显示,研究组与对照组患者小出血发生率比较,差异无统计学意义〔RR=0.82,95%CI(0.50,1.35),P=0.44,见图 10〕。
2.3.5 血小板减少症发生率 2篇[31,35]文献对比了血小板减少症发生率,异质性检验结果显示各研究间无统计学异质性(I2=0,P=0.51),采用固定效应模型。Meta分析结果显示,研究组与对照组患者血小板减少症发生率比较,差异无统计学意义〔RR=1.04,95%CI(0.61,1.77),P=0.87,见图11〕。
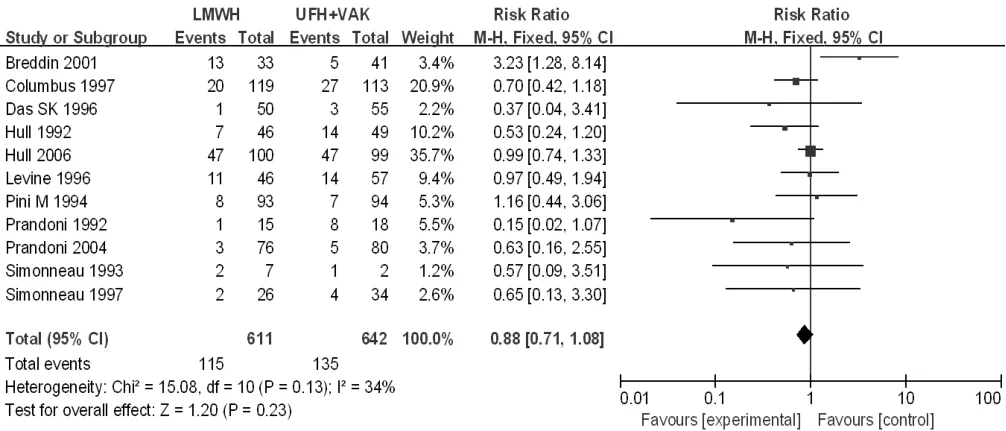
图4 研究组与普通肝素+口服维生素K拮抗剂序贯治疗亚组患者病死率比较的森林图Figure 4 Forest plot of the mortality of the study group versus the sequential treatment with UFH + oral VKA subgroup
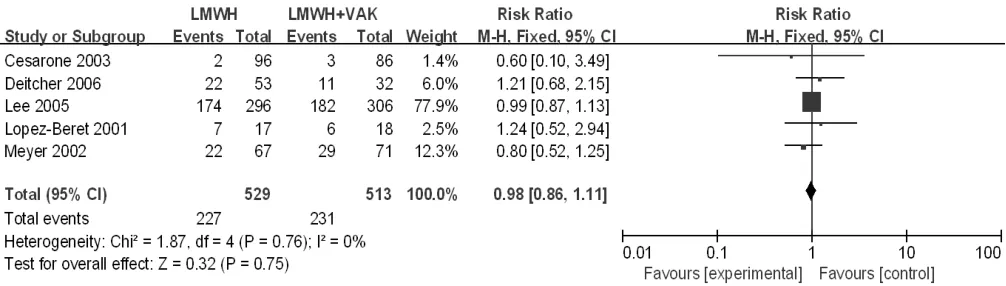
图5 研究组与LMWH+口服维生素K拮抗剂序贯治疗亚组患者病死率比较的森林图Figure 5 Forest plot of the mortality of the study group versus the sequential treatment with LMWH + oral VKA subgroup
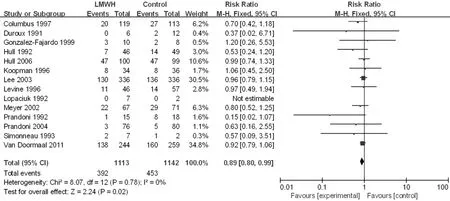
图6 ≤3个月亚组与对照组患者病死率比较的森林图Figure 6 Forest plot of the mortality of the LMWH treatment time ≤ 3 months subgroup versus the control group
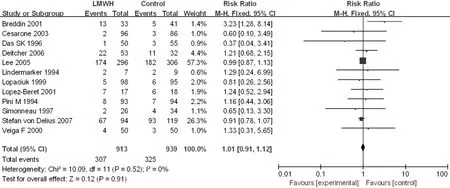
图7 >3个月亚组与对照组患者病死率比较的森林图Figure 7 Forest plot of the mortality of the LMWH treatment time > 3 months subgroup versus the control group

图8 研究组与对照组患者血栓复发率比较的森林图Figure 8 Forest plot of the recurrence rate of VTE in the study group versus the control group
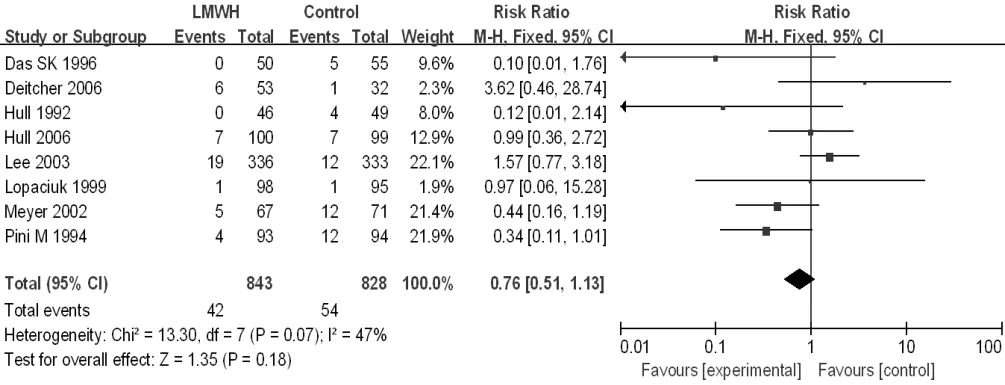
图9 研究组与对照组患者大出血发生率比较的森林图Figure 9 Forest plot of the rate of major bleeding in the study group versus the control group
2.4 敏感性分析与发表偏倚 针对病死率Meta分析分别采用固定效应模型和随机效应模型进行分析,结果基本一致;除去RR值最大的BREDDIN等[29]研究及RR值最小的PRANDONI等[34]研究,结果无较大变化,结论较稳定。漏斗图左右基本对称,未发现明显发表偏倚(见图12)。
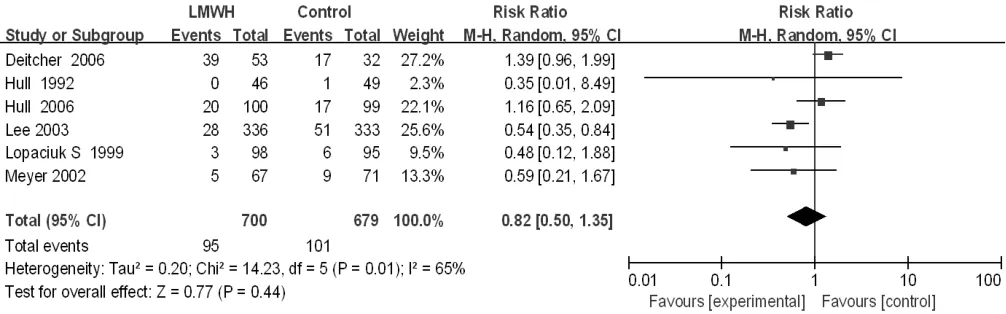
图10 研究组与对照组患者小出血发生率比较的森林图Figure 10 Forest plot of the rate of minor bleeding in the study group versus the control group
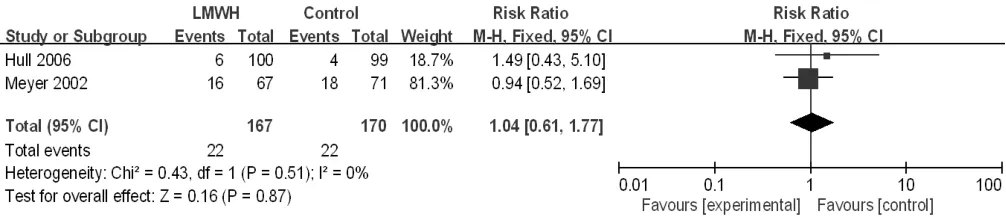
图11 研究组与对照组患者血小板减少症发生率比较的森林图Figure 11 Forest plot of the rate of thrombocytopenia in the study group versus the control group
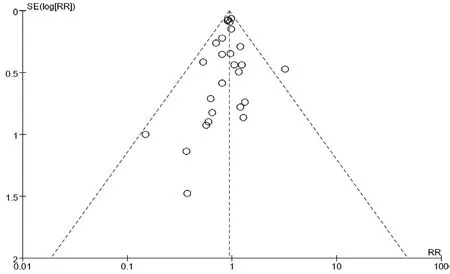
图12 发表偏倚的漏斗图Figure 12 Funnel plot of publication bias
3 讨论
3.1 恶性肿瘤与VTE VTE包括DVT和PE,是恶性肿瘤患者常见并发症之一,临床上观察发现4%~20%的患者可能发生VTE,VTE是导致患者预后差的主要原因之一[4]。肿瘤细胞通过上调细胞因子直接激活凝血酶原,诱导血小板聚集,或者通过调节内皮细胞或炎性反应从而导致凝血的发生。此外,恶性肿瘤细胞过表达组织因子,进一步引起血液高凝,并且增加了肿瘤的侵袭性及促进肿瘤性血管生成[41-42]。某些恶性肿瘤的治疗方法也可能导致VTE。接受他莫昔芬治疗的乳腺癌患者VTE的发病率可能增加2~5倍,联合使用他莫昔芬化疗患者VTE的风险也明显增高[43-44]。接受促红细胞生成素治疗的患者或接受化疗及重组人红细胞生成素治疗的宫颈癌患者,VTE的风险也明显增高[45]。
3.2 恶性肿瘤与抗凝治疗 恶性肿瘤的高凝状态不但引起患者发生VTE,而且还促进肿瘤的生长、侵袭和转移,常导致患者预后不良。因此,对一些发生VTE风险高的恶性肿瘤患者实施抗凝预防与治疗,对于改善其预后意义重大。目前常用的抗凝药物包括LMWH、普通肝素、维生素K拮抗剂如华法林等。国内外多项临床研究显示,LMWH抗凝治疗可使恶性肿瘤患者生存获益[46-50]。但也有研究持相反的结论。如SIDERAS等[51]报道其发现化疗联合LMWH组患者生存期并不长于单纯化疗组。而且,VAN DOORMAAL等[52]的RCT及CONTI等[12]的Meta分析显示,LMWH在降低合并有VTE的恶性肿瘤患者病死率方面并不优于口服抗凝药物。鉴于目前研究结果意见并不完全统一,为进一步比较LMWH与其他抗凝药物在恶性肿瘤合并VTE患者中的治疗效果,本研究对国内外发表的相关RCT进行Meta分析。
本研究根据循证医学原则,制定严格的纳入标准,充分检索文献,选择高质量(Jadad评分≥3分)的RCT进行Meta分析,以期更为客观地评价LMWH在恶性肿瘤合并VTE患者中的疗效,得出如下几方面结果。第一,研究组降低恶性肿瘤合并VTE患者的病死率与对照组(应用维生素K拮抗剂、普通肝素、普通肝素或LMWH+口服维生素K拮抗剂序贯治疗)相比无差异;根据对照组治疗方式不同分为口服维生素K拮抗剂、普通肝素、普通肝素+口服维生素K拮抗剂序贯治疗及LMWH+口服维生素K拮抗剂序贯治疗4个亚组(其中普通肝素亚组数据未能有效合成,未再进行亚组分析),结果显示研究组在降低恶性肿瘤合并VTE患者的病死率方面与各个亚组相比均无差异;根据LMWH抗凝治疗时间长短分成≤3个月亚组及>3个月亚组,结果显示,≤3个月亚组降低恶性肿瘤合并VTE患者的病死率优于对照组,>3个月亚组降低恶性肿瘤合并VTE患者的病死率与对照组相比无差异。本结果与CONTI等[12]的报道类似,其研究显示LMWH在降低恶性肿瘤合并VTE患者病死率方面与口服抗凝药物相似:但是,本研究的发现与AKL等[50]的结果不一致,其研究显示LMWH在降低恶性肿瘤合并VTE患者病死率方面优于普通肝素+口服维生素K拮抗剂序贯治疗。造成差异的原因可能与AKL等[50]纳入的RCT较少(仅9篇,而本研究纳入11篇)相关。第二,研究组的血栓复发率低于对照组,与AKL等[50]结果不一致,AKL等[50]研究显示在血栓复发率方面LMWH与普通肝素+维生素K拮抗剂序贯治疗组之间无差异,其原因也可能与本研究纳入的RCT较多相关。第三,研究组与对照组相比,大出血、小出血及血小板减少症发生率均无差异。上述结果提示,LMWH是一种治疗恶性肿瘤合并VTE患者的有效抗凝药物,与其他抗凝药物相比可减少血栓复发率;短期(≤3个月)治疗可改善这类患者生存状态,其疗效优于维生素K拮抗剂、普通肝素、普通肝素或LMWH+口服维生素K拮抗剂序贯治疗,长期治疗效果(>3个月)及大出血、小出血、血小板减少症发生率与维生素K拮抗剂、普通肝素、普通肝素或LMWH+口服维生素K拮抗剂序贯治疗类似。
但是,本研究存在一些不足:(1)纳入的文献中没有亚洲主要国家论文(如中国);(2)各研究的治疗时间不一致,跨度大(10 d~6个月);(3)各研究的肿瘤类型不一致,差异很大,有的研究未说明具体的肿瘤类型,或笼统称为实体瘤;(4)各研究的肿瘤分期不一致,或者未说明具体的肿瘤分期。但本研究纳入研究数量最多、文献质量均较高、评价指标较齐全,所得出的结论对于临床上LMWH在恶性肿瘤合并VTE患者中的抗凝治疗应用具有较重要的指导意义。
作者贡献:汤绍辉进行文章的构思与设计,负责文章的质量控制及审校;钟绿进行研究的实施与可行性分析,数据收集、整理,统计学处理,结果的分析与解释,撰写论文,论文的修订,对文章整体负责,监督管理。
本文无利益冲突。
[1]徐向东.临床常用药物手册[M].北京:人民军医出版社,2011:158-160.
[2]杨宝峰.药理学[M].7版.北京:人民卫生出版社,2008:58-59.YANG B F.Pharmacology[M].7th ed.Beijing:People's Medical Pubishing House,2008:58-59.
[3]刘松青.实用药物手册[M].成都:四川大学出版社,2007:132-133.LIU S Q.Practical drug handbook[M].Chengdu:Sichuan University Press,2007:132-133.
[4]KHORANA A A,FRANCIS C W,CULAKOVA E,et al.Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy[J].J Thromb Haemost,2007,5(3):632-634.DOI:10.1111/j.1538-7836.2007.02374.x.
[5]WAHRENBROCK M,BORSIG L,LE D,et al.Selectin-mucin interactions as a probable molecular explanation for the association of Trousseau syndrome with mucinous adenocarcinomas[J].J Clin Invest,2003,112(6) :853-862.DOI:10.1172/JCI18882.
[6]BOCCACCIO C,SABATINO G,MEDICO E,et al.The MET oncogene drives a genetic programme linking cancer to haemostasis[J].Nature,2005,434(7031):396-400.DOI:10.1038/nature03357.
[7]DVORAK H F,QUAY S C,ORENSTEIN N S,et al.Tumor shedding and coagulation[J].Science,1981,212(4497):923-924.DOI:10.1186/s12885-017-3442-y.
[8]AMIRKHOSRAVI A,MEYER T,AMAYA M,et al.The role of tisseactor pathway inhibitor in tumor growth and metstasis[J].Semin Thromb Hemost,2007,33(7):643-652.DOI:10.1177/1010428317712592.
[9]STEIN P D,BEEMATH A,MEYERS F A,et al.Incidence of venous thromboembolism in patients hospitalized with cancer[J].Am J Med,2006,119(1):60-68.DOI:10.1016/j.amjmed.2005.06.058.
[10]AGNELLI G,GUSSONI G,BIANCHINI C,et al.Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy:a randomized,placebo controlled,double-blind study[ J ].Lancet Oncol,2009,10(10):943-949.DOI:10.1016/S1470-2045(09)70232-3.
[11]LEE A Y,RICKLES F R,JULIAN J A,et al.Randomized comparison of low molecular weight heparin and coumarin derivatives on the survival of patients with cancer and venous thromboembolism[J].J Clin Oncol,2005,23(10):2123-2129.DOI:10.1200/JCO.2005.03.133.
[12]CONTI S,GUERCINI F,IORIO A.Low-molecular-weight heparin and cancer survival:review of the literature and pooled analysis of 1,726 patients treated for at least three months[J].Pathophysiol Haemost Thromb,2003,33(4):197-201.
[13]DUROUX P,NINET J,BACHET P,et al.A randomised trial of subcutaneous low molecular weight heparin (CY 216) compared with intravenous unfractionated heparin in the treatment of deep vein thrombosis.A collaborative European multicenter study[J].Thromb Haemost,1991,65(3):251-256.
[14]HULL R D,RASKOB G E,PINEO G F,et al.Subcutaneous lowmolecular-weight heparin compared with continuous intravenous heparin in the treatment of proximal-vein thrombosis[J].N Engl J Med,1992,326(15):975-982.DOI:10.1056/NEJM199204093261502.
[15]LOPACIUK S,MEISSNER A J,FILIPECKI S,et al.Subcutaneous low molecular weight heparin versus subcutaneous unfractionated heparin in the treatment of deep vein thrombosis:a Polish multicenter trial[J].Thromb Haemost,1992,68(1):14-18.
[16]PRANDONI P,LENSING A W,BÜLLER H R,et al.Comparison of subcutaneous low-molecular-weight heparin with intravenous standard heparin in proximal deep-vein thrombosis[J].Lancet,1992,339(8791):441-445.
[17]SIMONNEAU G,CHARBONNIER B,DECOUSUS H,et al.Subcutaneous low-molecular-weight heparin compared with continuous intravenous unfractionated heparin in the treatment of proximal deep vein thrombosis[J].Arch Intern Med,1993,153(13):1541-1516.
[18]LINDMARKER P,HOLSTRÖM M,GRANQVIST S,et al.Comparison of once-daily subcutaneous Fragmin with continuous intravenous unfractionated heparin in the treatment of deep vein thrombosis[J].Thromb Haemost,1994,72(2):186-190.
[19]PINI M,AIELLO S,MANOTTI C,et al.Low molecular weight heparin versus warfarin in the prevention of recurrences after deep vein thrombosis[J].Thromb Haemost,1994,72(2):191-197.
[20]KOOPMAN M M,PRANDONI P,PIOVELLA F,et al.Treatment of venous thrombosis with intravenous unfractionated heparin administered in the hospital as compared with subcutaneous lowmolecular-weight heparin administered at home.The Tasman Study Group[J].N Engl J Med,1996,334(11):682-687.DOI:10.1056/NEJM199603143341102.
[21]LEVINE M,GENT M,HIRSH J,et al.A comparison of lowmolecular-weight heparin administered primarily at home with unfractionated heparin administered in the hospital for proximal deep-vein thrombosis[J].N Engl J Med,1996,334(10):677-681.DOI:10.1056/NEJM199603143341101.
[22]DAS S K,COHEN A T,EDMONDSON R A,et al.Low-molecular-weight heparin versus warfarin for prevention of recurrent venous thromboembolism:a randomised trial[J].World J Surg,1996,20(5):521-526.DOI:10.1186/1471-2407-13-284.
[23]Columbus Investigators,BÜLLER H R,GENT M,et al.Lowmolecular-weight heparin in the treatment of patients with venous thromboembolism[J].N Engl J Med,1997,337(10):657-662.DOI:10.2147/CEOR.S126379.
[24]SIMONNEAU G,SORS H,CHARBONNIER B,et al.A comparison of low-molecular-weight heparin with unfractionated heparin for acute pulmonary embolism.The THESEE Study Group.Tinzaparine ou Heparine Standard:evaluations dans I'Embolie Pulmonaire[J].N Engl J Med,1997,337(10):663-669.DOI:10.1056/NEJM199709043371002.
[25]GONZALEZ-FAJARDO J,ARREBA E,CASTRODEZA J,et al.Venographic comparison of subcutaneous low-molecular-weight heparin with oral anticoagulant therapy in the long-term treatment of deep venous thrombosis[J].J Vasc Surg,1999,30:283-290.
[26]LOPACIUK S,BIELSKA-FALDA H,NOSZCZYK W,et al.Low molecular weight heparin versus acenocoumarol in the secondary prophylaxis of deep vein thrombosis[J].Thromb Haemost,1999,81(1):26-31.
[27]VEIGA F,ESCRIBÁ A,MALUENDA M P,et al.Low molecular weight heparin (enoxaparin) versus oral anticoagulant therapy(acenocumarol) in the long-term treatment of deep venous thrombosis in the elderly:a randomised trial[J].Thromb Haemost,2000,84(4):559-564.
[28]LÓPEZ-BERET P,ORGAZ A,FONTCUBERTA J,et al.Low molecular weight heparin versus oral anticoagulants in the long-term treatment of deep venous thrombosis[J].J Vasc Surg,2001,33(1):77-90.
[29]BREDDIN H K,HACH-WUNDERLE V,NAKOV R,et al.Effects of a low-molecular-weight heparin on thrombus regression and recurrent thromboembolism in patients with deep-vein thrombosis[J].N Engl J Med,2001,344(9):626-631.DOI:10.1056/NEJM200103013440902.
[30]MERLI G,SPIRO T E,OLSSON C G,et al.Subcutaneous enoxaparin once or twice daily compared with intravenous unfractionated heparin for treatment of venous thromboembolic disease[J].Ann Intern Med,2001,134(3):191-202.
[31]MEYER G,MARJANOVIC Z,VALCKE J,et al.Comparison of low-molecular-weight heparin and warfarin for the secondary prevention of venous thromboembolism in patients with cancer:a randomized controlled study[J].Arch Intern Med,2002,162(15):1729-1735.
[32]LEE A Y,LEVINE M N,BAKER R I,et al.Low-molecularweight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer[J].N Engl J Med,2003,349(2):146-153.DOI:10.1056/NEJMoa025313.
[33]CESARONE M R,LEDDA A,NICOLAIDES A,et al.Threemonth,outpatient,oral anticoagulant treatment in comparison with low-molecular-weight heparin in cancer patients[J].Circulation,2003,108(17):2875.
[34]PRANDONI P,CARNOVALI M,MARCHIORI A,et al.Subcutaneous adjusted-dose unfractionated heparin vs fixed-dose low-molecular-weight heparin in the initial treatment of venous thromboembolism[J].Arch Intern Med,2004,164(10):1077-1083.
[35]HULL R D,PINEO G F,BRANT R F,et al.Long-term lowmolecular-weight heparin versus usual care in proximal-vein thrombosis patients with cancer[J].Am J Med,2006,119(12):1062-1072.DOI:10.1016/j.amjmed.2006.02.022.
[36]DEITCHER S R,KESSLER C M,MERLI G,et al.Secondary prevention of venous thromboembolic events in patients with active cancer:enoxaparin alone versus initial enoxaparin followed by warfarin for a 180-day period[J].Clin Appl Thromb Hemost,2006,12(4):389-396.DOI:10.1177/1076029606293692.
[37]VON DELIUS S,AYVAZ M,WAGENPFEIL S,et al.Effect of low-molecular-weight heparin on survival in patients with advanced pancreatic adenocarcinoma[J].Thromb Haemost,2007,98(2):434-439.
[38]ROMERA A,CAIROLS M A,VILA-COLL R,et al.A randomised open-label trial comparing long-term sub-cutaneous low-molecular-weight heparin compared with oral-anticoagulant therapy in the treatment of deep venous thrombosis[J].Eur J Vasc Endovasc Surg,2009,37(3):349-356.DOI:10.1016/j.ejvs.2008.11.030.
[39]VAN DOORMAAL F F,DI NISIO M,OTTEN H M,et al.Randomized trial of the effect of the low molecular weight heparin nadroparin on survival in patients with cancer[J].J Clin Oncol,2011,29(15):2071-2076.DOI:10.1200/JCO.2010.31.9293.
[40]PARK J C,PRATZ C F,TESTFAYE A,et al.The effect of therapeutic anticoagulation on overall survival in men receiving first-line docetaxel chemotherapy for metastatic castration-resistant prostate cancer[J].Clin Genitourin Cancer,2015,13(1):32-38.DOI:10.1016/j.clgc.2014.04.008.
[41]RIKLES F R.Mechanisms of cancer-induced thrombosis in cancer[J].Pathophysiol Haemost Thromb,2006,35(1/2):103-110.DOI:10.1159/000093551.
[42]RAK J,MILSOM C,MAY L,et al.Tissue factor in cancer and angiogenesis:the molecular link between genetic tumor progression,tumor neovascularization,and cancer coagulopathy[J].Semin Thromb Hemost,2006,32(1):54-70.DOI:10.1055/s-2006-933341.
[43]FISHER B,COSTANTINO J,REDMOND C,et al.A randomized clinical trial evaluating tamoxifen in the treatment of patients with node-negative breast cancer who have estrogen-receptor-positive tumors[J].N Engl J Med,1989,320(8):479-484.DOI:10.1056/NEJM198902233200802.
[44]PRITCHARD K I,PATERSON A H,PAUL N A,et al.Increased thromboembolic complications with concurrent tamoxifen and chemotherapy in a randomized trial of adjucant therapy for women with breast cancer.Nathional Cancer Institute of Canada Clinical Trials Group Breast Cancer Site Group[J].J Clin Oncol,1996,14(10):2731-2737.DOI:10.1200/JCO.1996.14.10.2731.
[45]WUN T,LAW L,HARVEY D,et al.Increased incidence of symptomatic venous thrombosis in patients with cervical carcinoma treated with concurrent chemotherapy,radiation,and erythropoietin[J].Cancer,2003,98(7):1514-1520.DOI:10.1002/cncr.11700.
[46]KLERK C P,SMORENBURG S M,OTTEN H M,et al.The effect of low molecular weight heparin on survival in patients with advanced malignancy[J].J Clin Oncol,2005,23(10):2130-2135.DOI:10.1200/JCO.2005.03.134.
[47]顾爱琴,白皓,纪灏,等.低分子肝素联合化疗治疗非小细胞肺癌的随机研究[J].中国癌症杂志,2003,3(4):364-366.DOI:10.3969/j.issn.1007-3639.2003.04.026.GU A Q,BAI H,JI H,et al.Randomized study of low molecular weight heparin (LMWH) plus chemtherapy in advanced non-small cell lung cancer[J].China Oncology,2003,3(4):364-366.DOI:10.3969/j.issn.1007-3639.2003.04.026.
[48]LAZO-LANGNER A,GOSS G D,SPAANS J N,et al.The effect of low-molecular-weight heparin on cancer survival.A systematic review and meta-analysis of randomized trials[J].J Thromb Haemost,2007,5(4):729-737.DOI:10.1111/j.1538-7836.2007.02427.x.
[49]刘璠,封辰叶,刘廷威,等.低分子肝素单药抗凝治疗癌症相关急性肺血栓栓塞症疗效和预后分析[J].中国全科医学,2014,17(4):422-424.DOI:10.3969/j.issn.1007-9572.2014.04.015.LIU F,FENG C Y,LIU T W,et al.Outcome and prognosis of patients with cancer-associated acute pulmonary thromboembolism following anticoagulation therapies[J].Chinese General Practice,2014,17(4):422-424.DOI:10.3969/j.issn.1007-9572.2014.04.015.
[50]AKL E A,KAHALE L,NEUMANN I,et al.Anticoagulation for the initial treatment of venous thromboembolism in patients with cancer[J].Cochrane Database Syst Rev,2014,19(6):CD006649.DOI:10.1002/14651858.CD006649.
[51]SIDERAS K,SCHAEFER P L,OKUNO S H,et al.Lowmolecular-weight heparin in patients with advanced cancer:a phase 3 clinical trial[J].Mayo Clin Proc,2006,81(6):758-767.DOI:10.4065/81.6.758.
[52]VAN DOORMAAL F F,COHEN A T,DAVIDSON B L,et al.Idraparinux versus standard therapy in the treatment of deep venous thrombosis in cancer patients:a subgroup analysis of the Van Gogh DVT trial[J].Thromb Haemost,2010,104(1):86-91.DOI:10.1160/TH09-12-0870.

