3种饲料添加剂对吉富罗非鱼幼鱼生长性能、消化酶活性和肝、肠组织结构的影响
朱传忠,孙陆宇,解文丽,易敢峰
(1.北京大北农科技集团股份有限公司,北京 100190;2.福建大北农水产科技集团股份有限公司,福建诏安 363500;3.厦门大学海洋与地球学院,福建厦门 361005)
罗非鱼是我国主要养殖品种,目前总产量位居全国淡水鱼产量第五位[1]。吉富罗非鱼是遗传性状改良的尼罗罗非鱼(Oreochromisniloticus)[2],具有生长速度快、出肉率高的特点[3]。随着罗非鱼养殖业的快速发展,其病害问题时有发生。饲料中使用中草药提取物[4-6]、胆汁酸[7-8]、微生态制剂[9-11]可以提高鱼体生长性能,改善鱼体健康,增加鱼体免疫力。但这3种添加剂对吉富罗非鱼生长性能和健康的影响还鲜见报道。因此,本试验探讨饲料中添加中草药提取物、胆汁酸和微生态制剂对吉富罗非鱼生长性能、肠道消化酶活性、肝脏和肠道组织结构的影响,以期为罗非鱼高效环保配合饲料的配制提供理论依据。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕、菜粕等常规原料配制成基础饲料(见表1)。在每千克基础饲料中分别添加1、2 g的中草药提取物(福建大北农水产科技有限公司生产,由菌陈、大黄、郁金香等按一定比例复配后,经过超微粉碎制成);0.1、0.2 g的胆汁酸(山东龙昌动物科技有限公司生产);1、2 g的微生态制剂(福建大北农水产科技有限公司生产,由枯草芽孢杆菌和地衣芽孢杆菌通过闪蒸工艺制成的菌粉混合制剂)。共计配制7组饲料。试验饲料原料均经超微粉碎,保证有80%过80目筛,混合均匀后用MY120X2双螺杆膨化机(江苏牧羊机械装备有限公司)制粒,调质温度102 ℃制粒,50~70 ℃烘干后,置于-20 ℃冰箱中储藏备用。
1.2 试验用鱼与饲养管理
试验用吉富罗非鱼购自漳州市龙海市,运回实验室后,用基础饲料驯化2周,饥饿1 d后挑选大小均匀的483尾实验鱼(32.75±5.75) g,放养于21个养殖桶(有效容积500 L)中,每桶放鱼23尾。试验在循环流水养殖系统中进行,水源为曝气自来水。日投喂率为体重的3%,每天等量投喂2次(9∶00和17∶00),试验周期为45 d。试验过程中每周称重,以此为依据调整投喂量。试验期间水温23~27 ℃,pH 6~8,溶氧6~8 mg/L,氨氮含量<0.2 mg/L,亚硝酸盐含量<0.1 mg/L。
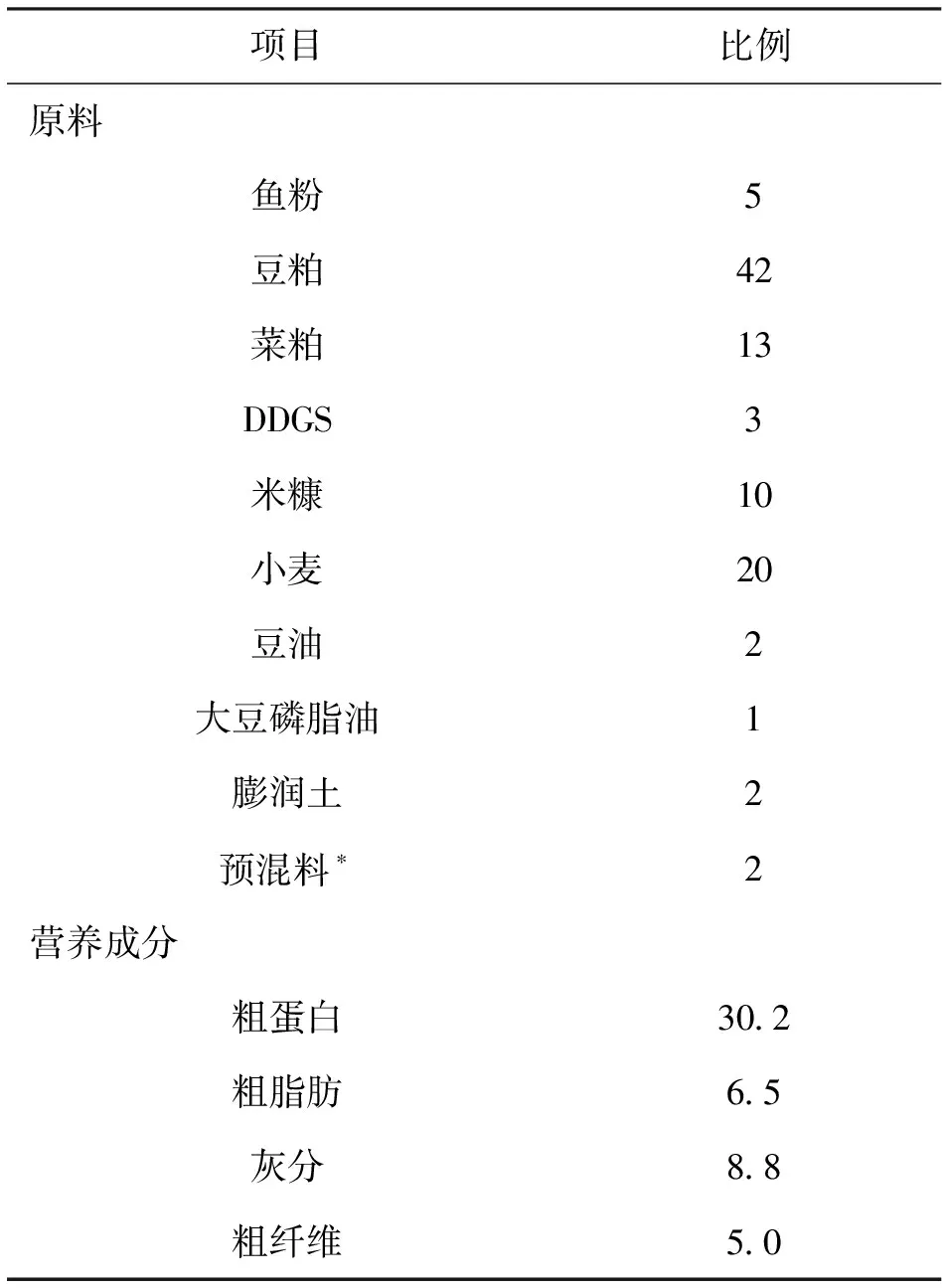
表1 基础饲料配方与饲料营养成分含量 Tab.1 Feed formulation and nutrient contents of the experimental diets %
注:*由大北农水产科技集团生产。
1.3 样品采集与制备
饲养试验结束后,饥饿24 h,分别称量每桶鱼的质量。随后,每处理组随机捞取6尾,将鱼体于冰盘中解剖,分离前肠、中肠和肝脏;肝脏、肠道(前肠、中肠)各切取0.5 cm置于Bouin氏固定液中固定;其余肝脏、肠道用液氮速冻后,放于-70 ℃冰箱保存。
1.4 指标计算、测定方法与切片观察
饲养期间,每周测定鱼体体重,每天记录鱼体摄食、死亡情况,试验开始和结束测定鱼体体重和体长。计算特定生长率、增重率、成活率、肥满度等。
特定生长率(SGR)=(lnW2-lnW1)×100%/t
增重率(WGR)=(W2-W1)÷W1×100%
成活率(SR)= (N1-N2)÷N1×100%
肥满度(CF,g/cm3)=(W/L3)×100
式中:W1为试验鱼初始体重(g);W2为试验结束时鱼的终末体重(g);t为饲养天数;N1为试验鱼初始尾数;N2为试验鱼终末尾数;W为试验结鱼的体重(g);L为体长(cm)。
1.4.2 消化酶活性的测定方法
肠道和肝脏剪碎称重后,以预冷的9倍体积的0.85%的生理盐水匀浆组织。将组织液于4 ℃下3 000 r /min离心10 min,取上清液用于测定消化酶活性。采用南京建成生物工程研究所的试剂盒测定蛋白酶、脂肪酶、淀粉酶的活性,按试剂盒说明书操作。蛋白酶的活性采用福林-酚试剂法测定;淀粉酶的活性采用碘-比色法测定;脂肪酶的活性采用聚乙烯醇橄榄油乳化液水解法测定。以37 ℃条件下,每分钟水解干酪素生成1 μg 酪氨酸作为1 个活性单位;脂肪酶以37 ℃条件下,每毫克组织在反应体系中与底物反应1 min 消耗1 μmol 底物为1 个活性单位;淀粉酶以37 ℃条件下,每mg组织与底物作用30 min,水解1 mg淀粉为1个活性单位。
1.4.3 肠道和肝脏切片制备与分析
取合适大小的肝脏组织置于Bouin氏固定液中4 ℃过夜,梯度酒精脱水,二甲苯透明,透蜡,包埋,切片,37 ℃过夜烘干;苏木精-伊红染色法(HE),中性树胶封片,显微镜下拍照。
肠道切片的测定指标:肠道绒毛数量;肌肉层厚度(每张图片随机取10个点测定后取平均值)。
1.5 数据处理与分析
实验所得数据采用SPASS 18.0进行单因素方差分析,用Duncan氏多重比较分析组间差异显著性。描述性统计值使用平均值±标准差表示,P< 0.05表示具有显著性差异。
2 结果
2.1 3种饲料添加剂对吉富罗非鱼幼鱼生长性能的影响
试验期间,试验鱼摄食情况良好,未发现试验鱼死亡。饲料中添加3种添加剂对吉富罗非鱼幼鱼生长性能和饲料利用效率的影响见表2。投喂饲料中添加0.2 g/kg胆汁酸的试验鱼增重率和特定生长率显著高于投喂饲料中添加2 g微生态制剂,其余各组之间差异不显著。各组间肥满度差异不显著。对照组饲料系数显著高于0.2 g/kg胆汁酸组,与其他各组间差异不显著。肥满度在各组间差异不显著。
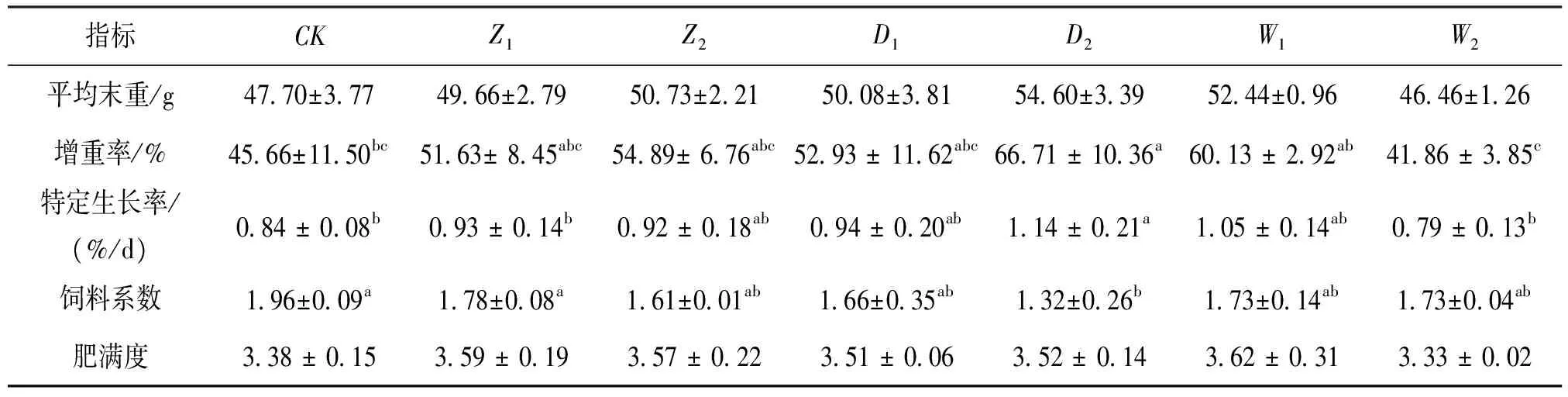
表2 饲料中添加3种添加剂对吉富罗非鱼生长性能的影响Tab.2 Effect of three additives on growth performance of O.niloticus
注:CK为对照组;Z1和Z2分别为中草药1、2g/kg组;D1和D2分别为胆汁酸0.1、0.2 g/kg组;W1和W2分别为微生态制剂1、2 g/kg组,下同。
2.2 3种饲料添加剂对吉富罗非鱼幼鱼肠道消化酶活性的影响
饲料中添加3种添加剂对吉富罗非鱼幼鱼肠道蛋白酶活性的影响见表3。由表3可见,各组之间肠道蛋白酶活性差异不显著。在投喂添加剂的试验组中,微生态制剂组幼鱼肠道蛋白酶活性最高为1 130 U/g prot,中草药组幼鱼肠道蛋白酶活性最低为890 U/g prot。从表3可以看出,虽然各处理组之间幼鱼肠道淀粉酶活性差异不显著,但摄食3种添加剂后的试验鱼肠道淀粉酶活性有升高的趋势,且低剂量的添加剂组肠道淀粉酶活性高于高剂量添加剂组。摄食添加剂的试验鱼中,Z1和D1组的幼鱼肠道淀粉酶活性最高为70 U/g prot,N2组幼鱼肠道淀粉酶活性最低为40 U/g prot。在添加中草药提取物组和添加胆汁酸组中,低剂量添加剂组幼鱼肠道脂肪酶活性高于高剂量组的,胆汁酸组幼鱼肠道脂肪酶活性最高为6.83 U/g prot,中草药组幼鱼肠道脂肪酶活性最低为2.59 U/g prot。饲料中添加2 g中草药提取物使得试验鱼的肠道脂肪酶活性显著低于微生态制剂组和饲料中添加0.1 g胆汁酸组。
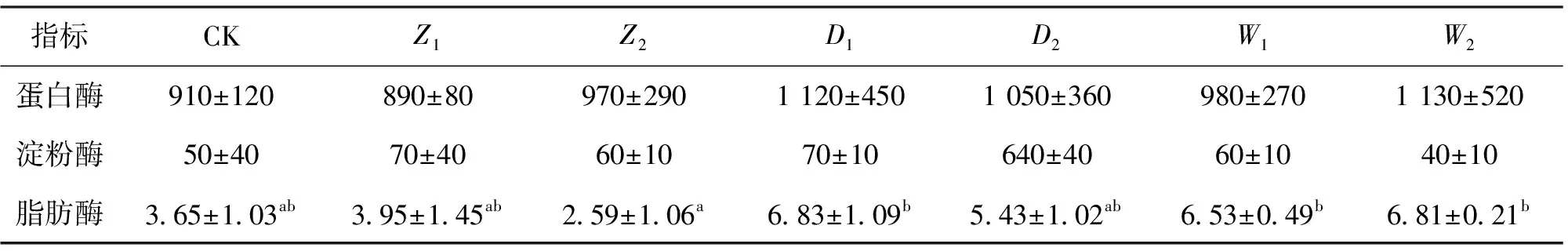
表3 饲料添加3种添加剂对吉富罗非鱼肠道消化酶活性的影响Tab.3 Effect of three additives on the digestive enzyme activity of O.niloticus U/g prot
2.3 3种饲料添加剂对吉富罗非鱼幼鱼肠道和肝脏形态的影响
2.3.1 3种饲料添加剂对吉富罗非鱼幼鱼肝脏形态的影响
对照组的试验鱼肝细胞排列整齐,大小均一,细胞膜分界明显,肝细胞索明显,肝脏细胞健康。中草药组试验鱼肝细胞核偏移,细胞内存在大量脂肪液滴等现象;胆汁酸组试验鱼的肝细胞形态正常,两组肝细胞形态相近;微生态制剂组的试验鱼肝细胞排列紧密,细胞核居中,细胞膜分界明显(图1)。
2.3.2 3种饲料添加剂对吉富罗非鱼幼鱼肠道形态的影响
由表4可知,在前肠组织中,摄食微生态制剂组的厚度最大,摄食饲料添加0.1 mg/kg微生态组次之,但各组间实验鱼的前肠肠道肌层厚度差异不显著。在中肠组织中,摄食饲料中添加1 g/kg中草药,添加0.2 g/kg胆汁酸组,而各组间也差异不显著。前肠绒毛长度在各组间无显著差异;1 g/kg微生态制剂组的中肠绒毛长度显著高于中草药组,但与其他组之间无显著差异。
3 讨论
在本试验中,与对照组相比,饲料中添加适量中草药提取物、胆汁酸和微生态制剂均有改善试验鱼的生长性能的趋势,尤其是投喂添加0.2 g/kg胆汁酸的饲料显著提高了试验鱼的增重率和特定生长率。这与对杂交罗非鱼[12](O.niloticus×O.aureus)、加州鲈[13](Micropterussalmodies)、牛蛙[14]Ranacatesbeiana)的研究发现一致,分析原因可能是胆汁酸能促进脂肪乳化,扩大脂肪与脂肪酶的接触面积,加速脂肪的消化吸收,提高脂肪利用率,而脂肪利用率的提高可以减少蛋白质作为能量被消耗,从而使更多的蛋白质用于肌体生长。

图1 饲料中添加3种添加剂对吉富罗非鱼幼鱼肝脏形态的影响Fig.1 Effect of three additives on the liver morphology of juvenile O.niloticus
在本试验中,添加1 g/kg的微生态制剂组特定生长率(SGR)有高于对照组的趋势,但添加2 g/kg的微生态制剂的试验鱼SGR显著低于对照组,这与锦鲤(CyprinuscarpioL.)[15]的研究结果相似,在其饲料中添加过高的微生态制剂,降低了锦鲤的生长性能,表明过量添加微生态制剂似乎对鱼的生长存在负面效应。

表4 3种饲料添加剂对吉富罗非鱼幼鱼肠道形态的影响Tab.4 Effect of three additives on the intestinal morphology of juvenile O.niloticus
在本研究中,与对照组相比,饲料中添加中草药提取物、胆汁酸和微生态制剂未对肠道的淀粉酶和蛋白酶活性产生显著影响。但发现饲料中添加0.2 g/kg胆汁酸的试验鱼肠道脂肪酶活性显著高于添加0.1 g/kg的。在对牛蛙[14]的研究中也有类似的发现,饲料中添加0.1 g/kg的胆汁酸可以显著提高其肠道脂肪酶活性,随着胆汁酸添加量的增加,肠道脂肪酶活力逐渐降低。
在本试验中饲料添加胆汁酸及微生态制剂均未对肝细胞的结构产生影响。但是投喂添加中草药提取物组的试验鱼,均发现肝细胞核位于细胞一侧,细胞空泡化等现象。这可能是中草药添加量过高或含有某种损伤肝细胞的因子所致[16]。
肠道是机体消化、吸收营养物质、免疫等的重要场所,其肠绒毛数量和肠道厚度直接影响营养物质的消化吸收[17]。本试验中,与对照组相比,饲料中添加一定量的添加剂均有增加试验鱼的绒毛数量和肌层厚度的趋势,这表明此3种添加剂可改善营养物质的消化吸收和肠道健康。研究发现多种添加剂都能提高肠道绒毛长度和肌层厚度,如添加10~20 mg/kg大豆黄酮可显著促进大菱鲆(Scophthalmusmaximus)肠道组织结构的发育和成熟,提高其后肠肠绒毛的长度[18];饲料中添加0.2 g/kg胆汁酸使得齐口裂腹鱼(Schizothoraxprenanti)的肠道绒毛数增加[19]。而添加50 mg/kg糖萜素(山茶科植物籽中提取的三萜皂苷类与糖类的混合物)则显著提高大菱鲆肠道黏膜厚度[20]。
综上所述,饲料中添加适量的中草药提取物(1 g/kg) 、胆汁酸(0.2 g/kg) 、微生态制剂(1 g/kg)可以改善吉富罗非鱼幼鱼的生长性能,提高消化酶活性。
[1]农业部渔业渔政管理局.2016中国渔业统计年鉴[M].北京:中国农业出版社,2016.
[2]王爱民,韩光明,封功能,等.饲料脂肪水平对吉富罗非鱼生产性能,营养物质消化及血液生化指标的影响[J].水生生物学报,2011,35(1):80-87.
[3]蒋利和,吴宏玉,黄 凯,等.饲料糖水平对吉富罗非鱼幼鱼生长和肝代谢功能的影响[J].水产学报,2013,37(2):245-255.
[4]高泽霞,王卫民.中草药饲料添加剂在水产养殖中的应用[J].中国饲料,2007, (18):32-34.
[5]Acar Ü,Kesbiç O S,Yilmaz S,et al.Evaluation of the effects of essential oil extracted from sweet orange peel (Citrussinensis) on growth rate of tilapia (Oreochromismossambicus) and possible disease resistance againstStreptococcusiniae[J].Aquaculture,2015,437:282-286.
[6]Bulfon C,Volpatti D,Galeotti M.Current research on the use of plant-derived products in farmed fish[J].Aquacult Res,2015,46(3):513-551.
[7]周书耘, 刘永坚, 梁海鸥,等.饲料中添加胆汁酸对军曹鱼生长及体组成的影响[J].南方水产科学,2010,6(4):20-25.
[8]黄炳山,李宝山,张利民,等.胆汁酸对大菱鲆幼鱼生长,脂肪代谢酶及血清生化的影响[J].上海海洋大学学报,2015,24(5):737-744.
[9]牟洪生,劳惠燕,齐振雄,等.微生态制剂 A 对罗非鱼生长及消化酶活性的影响[J].华南师范大学学报(自然科学版),2010,(2):112-115.
[10]Newaj-Fyzul A,Austin B.Probiotics,immunostimulants,plant products and oral vaccines,and their role as feed supplements in the control of bacterial fish diseases[J].J Fish Dis,2015,38(11):937-955.
[11]Fuchs V I,Schmidt J,Slater M J,et al.The effect of supplementation with polysaccharides,nucleotides,acidifiers andBacillusstrains in fish meal and soy bean based diets on growth performance in juvenile turbot (Scophthalmusmaximus)[J].Aquaculture,2015,437:243-251.
[12]Chou B S,Shiau S Y.Optimal dietary lipid level for growth of juvenile hybrid tilapia,Oreochromisniloticus×Oreochromisaureus[J].Aquaculture,1996,143:185-195.
[13]朱 龙,程 洁,王 青,等.胆汁酸对加州鲈生长性能,形体指数及肌肉营养成分的影响[J].水产养殖,2017,(1):28-32.
[14]胡田恩,王 玲,张春晓,等.饲料中添加胆汁酸对牛蛙生长性能,体组成和营养物质表观消化率的影响[J].水生生物学报,2015,39(4):677-685.
[15]史东杰,梁拥军,许金华,等.微生态制剂对锦鲤生长性能、肌肉组成、体色及非特异性免疫的影响[J].河南农业科学,2017,46(1):144-148.
[16]齐 茜,刘洪柏,麦丽开,等.复方中草药对闪光鲟生长及血液生化指标的影响[J].江西农业大学学报,2016,38(1):160-167.
[17]Caspary W F.Physiology and pathophysiology of intestinal absorption[J].American J Clinic Nutrition,1992,55(1Supplement),299-308.
[18]郝甜甜,张利民,李宝山,等.饲料中添加糖萜素对大菱鲆幼鱼体成分,消化酶活力,血脂及肠道组织结构的影响[J].上海海洋大学学报,2015,24(3):391-402.
[19]曾本和,向 枭,周兴华,等.高脂饲料中胆汁酸水平对齐口裂腹鱼肠道组织结构及脂肪代谢酶活性的影[J].水产学报,2016,40(9):1340-1348.
[20]胡海滨,刘金桃,李彦先,等.饲料中大豆黄酮对大菱鲆生长,消化酶活力,抗氧化力及肠道结构的影响[J].水产学报,2014,38(9):1503-1513.

