雌激素及其受体与IL-17在HPV16持续感染阶段的表达研究
,, ,,,
(1.上海市浦东新区人民医院妇产科,上海 201299;2.上海市浦东医院妇产科,上海 201309;3.上海交通大学附属第九人民医院妇产科,上海 200011)
目前已经证实人乳头瘤病毒(human papillomavirus,HPV)感染是子宫颈癌发生的必要因素,几乎100%的子宫颈癌病变中都能检测到HPV,HPV16是HPV中的高危型,与50%以上宫颈癌有关[1]。HPV感染很常见,通常通过性行为传播。在世界范围内,大多数女性在一生中都会感染HPV。对于性行为活跃的妇女,宫颈感染HPV很普遍。据调查,有20%~25%的青春期少女或大学阶段的女性HPV-DNA检测阳性[2]。然而,目前尚未研制出HPV的针对性治疗药物,大部分感染HPV的女性机体免疫系统可将其清除,所以感染不会持续或发展为宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)。低危型HPV自发清除时间为4~9个月,高危型HPV(high risk human papiIlomavirus,HR-HPV)为8~12个月,仅有约10%的感染会持续,这部分感染者才是发生宫颈癌的高危人群。如果对所有感染HR-HPV的患者进行治疗,势必造成大量不必要的医疗资源浪费。研究表明雌激素及其受体与宫颈癌的发生发展密切相关[3-7];IL-17是Th17细胞产生的一种免疫因子,可以上调机体免疫应答,清除病毒或细菌等。本课题探讨在宫颈细胞学正常仅为HPV感染阶段,雌激素(estradiol,E2)、雌激素受体(Estrogen receptor,ER)及白介素-17(interleukin-17,IL-17)所发挥的作用,试图从HPV感染患者中找出持续性感染患者,为缩小目标人群提供参考。
1 资料与方法
1.1 临床资料
样本人群为2014年5月到2017年5月于上海市浦东新区人民医院门诊或住院患者或健康体检人员中进行反向斑点杂交技术检测(HPV分型检测方法)发现的HR-HPV型阳性或阴性、宫颈病理学正常者,凡符合纳入标准,且志愿参加者,签署同意书。纳入标准:年龄20~50岁、汉族、在上海居住2年以上。排除标准:已妊娠或1年内有妊娠计划者、口服避孕药患者、带激素类避孕器者、患免疫系统疾病(包括HIV患者)、卵巢切除患者、卵巢现患病者、闭经、绝经及月经不规律患者。
本研究纳入对象102例,其中4例在研究过程中病理学转为CIN Ⅱ级及以上,5例在研究过程中妊娠,3例返乡,随访失败,以上12例均剔除研究。本研究共纳入90例,按照HPV感染的不同,将研究对象分为3组:HPV阴性组,连续1年检测HPV均为阴性;单一HPV16阳性,但在后续的检测中,HPV16逐渐被清除,简称HPV16清除组;单一HPV16阳性,但在后续的检测中,持续存在,简称HPV16持续感染组。其中HPV阴性组30例,年龄(38.43±11.35)岁;HPV16感染清除组30例,年龄(39.26±10.39)岁;HPV16感染持续组30例,年龄(36.61±10.95)岁。3组研究对象在年龄、居住地、婚姻状况等人口学特征方面分布基本一致,差异无统计学意义(P>0.05)。
1.2 方法
对研究对象均选择在卵泡期(月经周期第5~8天)行宫颈脱落细胞TCT检查及阴道镜活检组织病理检查,阴道镜下见可疑病变者取病变处组织,阴道镜下未见明显病变者取宫颈3、6、9、12点处组织,组织送病理检查,病理切片用免疫组化法检测雌激素受体的表达;采用上海达安医学检测中心的HPV检测专用宫颈刷采集宫颈脱落细胞行HPV分型及定量检测;研究对象于卵泡期(月经周期第5~8天)抽空腹静脉血检测雌二醇水平。
宫颈灌洗液:参照文献[8],在入选对象抽血当天同时取宫颈灌洗液。暴露宫颈口,用5 mL灭菌生理盐水冲洗宫颈口及宫颈表面,于后穹隆吸出灌洗液4 mL,混匀后分装入1.5 mL无菌EP管中,3 000 r/min,4 ℃离心5 min。取上清分装后-80 ℃保存备用,用于检测宫颈微环境中免疫细胞因子IL-17表达水平。
1.3 酶联免疫吸附试验(ELISA)测定雌激素水平及宫颈灌洗液中IL-17水平
应用美国Biocheck公司生产的ELISA检测试剂,严格按照操作规程,批量测定血清中雌二醇(E2)及宫颈灌洗液中IL-17的含量。每块测定板均设双份标准系列和质控,利用伯乐-450酶标仪,于450 nm单波长下读取各孔吸光度(A)值,绘制标准曲线,求得样本中E2及IL-17的含量。
1.4 用免疫组化SP法检测ER
单克隆抗体均购自北京中杉金桥生物技术有限公司,SP检测用TBS代替一抗作为阴性对照,乳腺癌组织作为阳性对照。实验步骤严格按照试剂说明书操作。ER以细胞核内出现棕黄色颗粒为阳性表达细胞,1%~20%为弱阳性(+),21%~30%为中等强度阳性(++),大于30%为强阳性(+++)。阳性细胞百分率=阳性细胞数/计数细胞总数。阳性面积指数=阳性区域面积×OD/总面积
1.5 随访复诊与指标检测
所有研究对象每3个月重复上述所有检测一次,连续1年。如在研究过程中,患者宫颈病理学转为异常,则剔除该实验组,根据相关诊疗规范进行治疗,研究过程中避孕失败而妊娠的对象也予以剔除。
1.6 统计学分析
应用SPSS 13.0统计分析软件经计算机进行统计学分析。计数资料ER的阳性面积指数统计应用χ2检验,计量资料E2及IL-17的含量采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 E2水平波动值
1年内各组研究对象体内雌激素E2水平波动值:HPV阴性组为(3.026 0±0.0153 6)pg/mL,HPV16清除组为(3.005 0±0.0197 9)pg/mL,HPV16持续感染组为(3.045 0±0.0187 5)pg/mL,3组比较差异无统计学意义(F=1.226,P=0.309)。
2.2 ER的表达
各组ER表达比较,差异无统计学意义(χ2=5.406,P=0.067),见表1、图1。
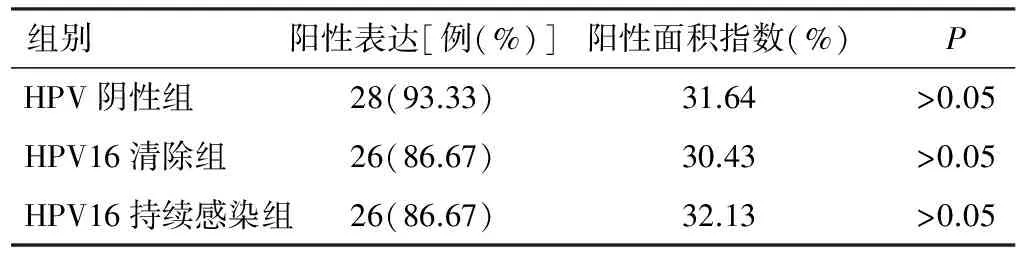
表1 ER在各组中的表达(n=30)
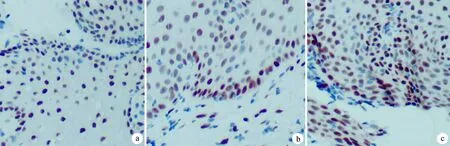
a:HPV16持续感染组;b:HPV16清除组;c:HPV阴性组
2.3 IL-17的表达
HPV阴性组IL-17改变量(2.13±0.11) pg/mL,HPV16清除组(24.32±0.31) pg/mL,HPV16持续感染组(2.08±0.15) pg/mL,IL-17表达浓度差在HPV阴性组与HPV16持续感染组间差异无统计学意义(P>0.05)(t=1.47,P=0.1463),二者与HPV16清除组之间差异具有统计学意义(P<0.05),HPV16清除组中IL-17浓度明显增高。
3 讨论
前瞻性队列研究显示在性行为开始后很快就会发生高危型HPV的感染,大约有一半的年轻女性在开始性行为后的3年内就会感染HPV[9]。
因宫颈癌发病率和病死率逐年升高,而HR-HPV持续感染是宫颈上皮内瘤样病变及宫颈癌发生发展的必要条件,所以绝大部分感染了HR-HPV的患者迫切希望得到有效治疗清除HR-HPV,进而减少或杜绝宫颈癌的发生。但感染了HR-HPV患者仅有约10%感染会持续,这部分感染者才是发生宫颈癌的高危人群。如果对所有感染HR-HPV的患者进行治疗,势必造成大量不必要的医疗资源浪费。因此,如果能有某种方法在宫颈病理学正常的患者中提前筛选出HR-HPV持续性感染者,针对性治疗随访,必将节省大量医疗资源。目前对影响HPV清除和持续感染的因素及宫颈局部微环境在此过程中的作用尚不清楚。
HPV传播和潜伏感染发生在女性下生殖道局部。并不会引起全身症状或病毒血症,因此,宫颈局部免疫状态在HPV感染结局中发挥关键作用。宫颈移行带是HPV感染的主要部位。雌激素是一组类固醇类化合物,在妇女的生育周期中极其重要。在女性体内主要有3种雌激素:雌二醇、雌三醇、雌酮。从月经初潮到绝经期最主要的雌激素是17β-雌二醇[10]。子宫是雌激素发挥生物学效应的靶器官,宫颈鳞状细胞和柱状细胞的交界区,既是雌激素作用的最敏感部位,也是最易受到HPV感染的区域[11]。研究表明,雌激素能促进宫颈靶细胞增殖,并可作为助催化剂促进、启动致癌过程[3]。
高水平的雌激素可增加宫颈癌发生的风险,但是作为激素发生生理效应的重要中介物质,激素受体是激素与肿瘤发生联系的关键环节。激素受体能反映内源性激素的水平及其变化情况。目前可识别的雌激素受体有ERα和ERβ,商品化的ER抗体指的是ERα。在正常情况下,ERα主要存在于子宫、输卵管、宫颈;ERβ主要分布于卵巢,在子宫、宫颈、阴道表达较弱,在生育期,很少表达于输卵管。近年研究发现随着CIN病变程度的增加,ERα的表达逐渐减弱,二者存在负相关的关系,表明ERα的表达减弱与宫颈病变进展有一定的关系[11]。
在我们的研究中发现宫颈细胞学正常的HR-HPV感染阶段,无论是HPV16清除组还是持续感染组,2组中的E2水平的变化与HPV阴性组无明显差异,同时ER在该2组中的表达与HPV阴性组相比差异亦无统计学意义。我们推测在HR-HPV持续感染阶段,患者体内的内源性E2并未发生明显改变,说明在HR-HPV的感染初始阶段,E2对感染的影响不大,因此我们不能通过E2水平的变化从HR-HPV感染患者中找出持续性感染者。本研究中ER在HPV16清除组、HPV16持续感染组及HPV阴性组中表达水平无明显差异,这与其他学者的研究结果似乎不一致[4,11],但我们的研究对象是宫颈细胞学或组织病理学正常的患者,而上述学者[4,11]的研究对象则是宫颈癌和癌前病变患者,组织病理学不同,所以结果不同。通过研究,我们认为ER的表达量主要与组织病理学的改变有关,3组研究对象均是组织病理学正常的患者,因此ER的表达水平在3组间差异并无统计学意义,故我们也不能通过ER水平的检测预检出HR-HPV持续感染患者。
近年来研究的热点“肿瘤微环境”认为炎症、免疫、肿瘤三者有着密切的关系,认为炎症反应在肿瘤的发生、进展、恶性转化、侵袭和转移中都扮演了重要角色[12]。Th17细胞被认为是一群重要的介导炎症反应的细胞,该类细胞能激活树突状细胞和T淋巴辅助细胞,通过释放细胞因子来维持慢性炎症状态和导致癌变的微环境。Th17分泌的细胞因子除了IL-17(IL-17A)外,还包括IL-17F、IL-21、IL-22、IL-6等细胞因子[13]。IL-17是一种重要的炎症介质,其可以通过诱导其他炎症细胞因子(如IL-6)及趋化因子(如MCP-1、MIP-2)等的表达,介导炎症细胞到局部的浸润及组织损伤[14]。大量的实验结果显示,IL-17在各种感染性疾病、自身免疫性疾病、肿瘤、移植物抗宿主等疾病的发生和发展中均发挥了重要作用[15-19]。
本课题通过对宫颈局部微环境中IL-17的检测发现,IL-17表达浓度差在HPV阴性组与HPV16持续感染组间无明显差异,二者与HPV16清除组之间IL-17浓度差异显著,在感染清除组中IL-17浓度明显较初始感染时增高,这说明IL-17浓度的增加有利于HPV病毒的清除。但文献报道IL-17具有促进多种肿瘤生长的作用,这些肿瘤包括膀胱癌、皮肤癌、卵巢癌、乳腺癌[20-21]。IL-17和肝癌有着密切的关系,肝癌细胞中IL-17经过活化IL-6/JAK2/STAT3的AKT通路,促进肝癌的发生与进展[22-23]。樊金炎等[24]研究发现在CIN及宫颈癌患者血清中IL-17表达水平高于慢性宫颈炎患者。这些似乎与我们的实验结果有所不同,但我们的课题研究对象是宫颈细胞学正常的人群,与癌症患者不同,我们推测IL-17在HPV病毒感染阶段的作用机制可能与其在癌症中的作用机制不同。
通过初步研究,我们认为在HR-HPV感染阳性的患者中,IL-17的增加有利于HPV病毒的清除,反之IL-17变化不明显的患者可能预示着将进展为持续性感染。但本课题因研究对象及研究时间所限,且宫颈局部微环境复杂,阴道内微生态亦复杂,究竟一种还是多种免疫因子对HPV病毒的清除产生了影响,尚需要进一步深入的研究。
[1] 安 振,万艳平.HPV16 E6蛋白在宫颈癌中的作用研究进展[J].微生物学免疫学进展,2015,43(3):42-46.doi:10.13309/j.cnki.pmi.2015.03.010.
[2] Moscicki AB,Schiffman M,Kjaer S,et al.Chapter 5:Updating the natural history of HPV and anogenial cancer[J].Vaccine,2006,24(suppl 3):S42-S51.doi:10.1016/j.vaccine.2006.06.018.
[3] 贾美群,陈曾燕,李海波.雌激素和孕激素对人宫颈癌细胞体外生长影响的研究[J].中华肿瘤防治杂志,2009,16(6):431-433.doi:10.16073/j.cnki.cjcpt.2009.06.006.
[4] 冯 静,王建六,魏丽惠.甾体激素与子宫颈癌发生的关系[J].中华妇产科杂志,2006,12(41):861-863.
[5] 王金桃,高尔生,丁 玲,等.内源性雌孕激素及其受体与宫颈癌的关系[J].中华肿瘤杂志,2006,28(7):494-497.doi:10.3760/j.issn:0253-3766.2006.07.004
[6] 白丽霞,孙秀丽,商宇红,等.雌激素对宫颈癌细胞生长及人乳头瘤病毒18E7基因表达的调节[J].中国妇产科临床杂志,2004,5(1):49-68.doi:10.3969/j.issn.1672-1861.2004.01.017.
[7] 孔迎辉,周毅成,刘慧瑜,等.雌、孕激素与HPV感染协同致病作用[J].中国麻风皮肤病杂志,2012,28(1):32-34.doi:10.3969/j.issn.1009-1157.2012.01.014.
[8] 洪 慧,王 鹤,贾超颖,等.HR-HPV感染后宫颈微环境中免疫炎症因子变化[J].安徽医学,2014,35(1):9-12.doi:10.3969/j.issn.1000-0399.2014.01.003.
[9] Moscicki AB.Impact of HPV infection in adolescent populations[J].JA dolesc Health,2005,37(6 Supp l):S3-S9.doi:10.1016/0168-9002(96)00194-5.
[10] Dallenbach-Hellweg G.Structural variations of cervical cancer and its precursors under the influence of exogenous hormones[J].Curr Top Pahtol,1981,70:143-170.
[11] Nair HB,Luthra R,Kirma N,et al.Induction of aromatase expression in cervical carcinomas:effects of endogenous estrogen on cervical cancer cell proliferation[J].Cancer Res,2005,65(23):11164-11173.
[12] 顾依群,高子芬,汪颖南,等.人乳头状瘤病毒、p16INK4A在宫颈鳞状上皮病变中的意义[J].诊断病理学杂志,2008,8 (15):315-319.doi:10.3969/j.issn.1007-8096.2008.04.017.
[13] Jing Y,Han Z,Zhang S,et al.Epithelial-mesenchymal transition in tumor microenvironment[J].Cell Biosci,2011,1:29.doi:10.1186/2045-3701-1-29.
[14] Tosolini M,Kirilovsky A,Mlecnik B,et al.Clinical impact of different classes of infiltrating T cytotoxic and helper cells (Th1,Th2,Treg,Th17) in patients with colorectal cancer[J].Cancer Res,2011,71:1263-1271.doi: 10.1158/0008-5472.CAN-10-2907.
[15] Stockinger B,Veldhoen M,Martin B.Th17 T cells:linking innate and adaptive immunity[J].Semin Immunol,2007,19(6):353-361.doi:10.1016/j.quascirev.2005.08.008.
[16] Du WJ,Zhen JH,Zong ZQ,et al.Expression of interleukin-17 associated with disease progression and liver fibrosis with hepatitis B virus infection:IL-17 in HBV infection[J].Diagn Pathol,2013,8:40.doi:10.1186/1746-1596-8-40.
[17] Yeh CY,Shun CT,Kuo YM,et al.Activated human valvular interstitial cells sustain interleukin-17 production to recruit neutrophils in infective endocarditis[J].Infect Immun,2015,83(6):2202-2212.doi:10.1128/IAI.02965-14.
[18] Karbach S,Croxford AL,Oelze M,et al.Interleukin 17 drives vascular inflammation,endothelial dysfunction,and arterial hypertension in psoriasis-like skin disease[J].Arterioscler Thromb Vasc Biol,2014,34(12):2658-2668.doi:10.1161/ATVBAHA.114.304108.
[19] Moran EM,Mastaglia FL.The role of interleukin-17 in immune-mediated inflammatory myopathies and possible therapeutic implications[J].Neuromuscul Disord,2014,24(11):943-952.doi:10.1016/j.nmd.2014.06.432.
[20] Baharlou R,Khezri A,Razmkhah M,et al.Increased interleukin-17 transcripts in peripheral blood mononuclear cells,a link between T-helper 17 and proinflammatory responses in bladder cancer[J].Iran Red Crescent Med J,2015,17(2):e9244.doi:10.5812/ircmj.9244.
[21] Mendes EA,Mendes TA,dos Santos SL,et al.Expression of IL-4,IL-10 and IFN-γin the liver tissue of cattle that are naturally infected with fasciola hepatica[J].Vet Parasitol,2013,195(1-2):177-182.doi:10.1016/j.vetpar.2013.03.035.
[22] Dhar D,Seki E,Karin M.NCOA5,IL-6,type 2 diabetes,and HCC:The deadly quartet[J].Cell Metab,2014,19(1):6-7.doi:10.1016/j.cmet.2013.12.010.
[23] Santini D,Addeo R,Vincenzi B,et al.Exploring the efficacy and safety of single-agent sorafenib in a cohort of Italian patients with hepatocellular carcinoma[J].Expert Rev Anticancer Ther,2012,12(10):1283-1288.doi:10.1586/era.12.102.
[24] 廖楚舒,邓中华,乐杨桦,等.Th17相关炎症因子与原发性肝癌关系的研究[J].实用预防医学,2016,23(5):554-556.doi:10.3969/j.issn.1006-3110.2016.05.013.
[25] 樊金焱,刘玉玲,邰国香,等.外周血中Th17/Treg细胞及炎症因子水平与宫颈病变程度、HPV危险分型的关系[J].山东医药,2017,57(29):41-43.doi:10.3969/j.issn.1002-266X.2017.29.013.

